临床评分系统预测前列腺癌根治术后生化复发的价值
黄鹏 廖鑫鑫 陆文宝 张良 周海滨 黄玉清 蔡军 曾泉
摘要:目的 建立临床评分模型(CSM)评估前列腺癌根治术后生化复发(BCR)的风险。方法 收集2001年7月~2013年1月在九江学院附属医院和南昌大学第二附属医院泌尿外科接受根治性前列腺切除术(RP)的患者528例,收集患者一般资料和手术资料,包括年龄、治疗前血清tPSA、活检Gleason评分、血清总睾酮、手术切缘状态、包膜侵犯、精囊腺侵犯和淋巴结转移等;Logistic回归分析前列腺癌根治术后BCR的危险因素,利用危险因素建立CSM预测患者术后5年内BCR的风险,并将其分为低风险、中等风险和高风险组,ROC曲线评估CSM的有效性。结果 RP术后患者平均随访时间为(56.77±26.64)个月。多因素Logistic回归分析显示:tPSA(HR=2.312,95%CI:1.624~3.285)、Gleason评分(HR=2.761,95%CI:1.925~4.276)、包膜侵犯(HR=1.925,95%CI:1.235~3.517),手术切缘阳性(HR=2.235,95%CI:1.684~3.927),精囊腺侵犯(HR=2.032,95%CI:1.528~3.529)和淋巴结转移(HR=2.586,95%CI:1.624~4.351)是患者术后BCR的危险因素。低風险、中等风险和高风险组患者术后BCR发生率比较,差异有统计学意义(P<0.05);ROC曲线显示,CSM的曲线下面积为0.7882,当截断值为10.5分时,CSM的敏感性和特异性分别为77.08%、69.83%,可预测RP后5年内BCR的风险(P<0.05)。结论 CSM可预测前列腺癌患者前列腺癌根治术后BCR的风险,当患者的CSM较高时,术后早期干预可能会降低其BCR风险。
关键词:前列腺癌;临床评分模型;生化复发;根治性前列腺切除术
中图分类号:R73 文献标识码:A DOI:10.3969/j.issn.1006-1959.2020.08.025
文章编号:1006-1959(2020)08-0076-04
Abstract:Objective To establish a clinical scoring model (CSM) to assess the risk of biochemical recurrence (BCR) after radical prostatectomy. Methods A total of 528 patients who underwent radical prostatectomy (RP) in the urology department of the Affiliated Hospital of Jiujiang University and the Second Affiliated Hospital of Nanchang University from July 2001 to January 2013 were collected, and the general and surgical data of the patients were collected, including age and treatment Pre-serum tPSA, biopsy Gleason score, serum total testosterone, surgical margin status, capsular invasion, seminal vesicle invasion, and lymph node metastasis;Logistic regression analysis of risk factors for BCR after radical prostatectomy, using risk factors to establish CSM to predict the risk of BCR within 5 years after surgery, and divide it into low-risk, medium-risk, and high-risk groups, ROC curve to evaluate the effectiveness of CSM.Results The average follow-up time of patients after RP was (56.77±26.64) months. Multivariate Logistic regression analysis showed that: tPSA (HR=2.312, 95%CI :1.624~3.285), Gleason score (HR=2.761, 95%CI :1.925~4.276), capsule invasion(HR= 1.925, 95%CI :1.235~3.517), positive surgical margin (HR=2.235, 95%CI :1.684~3.927), seminal vesicle invasion(HR=2.032, 95%CI:1.528~3.529) and lymph node metastasis (HR=2.586, 95%CI :1.624~4.351) is a risk factor for postoperative BCR. The incidence of postoperative BCR in the low-risk, medium-risk, and high-risk groups was statistically significant(P<0.05); the ROC curve showed that the area under the CSM curve was 0.7882. When the cutoff value was 10.5, the CSM s sensitivity and specificity were 77.08% and 69.83%, respectively, which can predict the risk of BCR within 5 years after RP(P<0.05).Conclusion CSM can predict the risk of BCR after radical prostatectomy in patients with prostate cancer. When the CSM of patients is high, early postoperative intervention may reduce their BCR risk.
Key words:Prostate cancer;Clinical scoring model;Biochemical recurrence;Radical prostatectomy
前列腺癌(prostate cancer,PCa)是最常见的恶性肿瘤之一,也是男性癌症死亡的第五大原因[1]。PCa根治术是治疗早期局限性PCa的标准方法,手术治疗效果明确[2]。生化复发(biochemical recurrence,BCR)被认为是PCa根治术后临床复发的前兆,预测术后BCR在PCa根治术后患者的具有重要的临床意义。目前有许多临床评分系统预测BCR,包括Kattan的列线图[3]、前列腺风险评估癌症(CAPRA)评分[4]和前列腺评分系统[5]。虽然以上评分系统均可用于术后BCR风险的评估,但由于上述的研究纳入影响因素较少,可能存在一定的不足,同时也不一定适合国内PCa患者,因此本研究拟建立新的临床评分模型(CSM)以评估PCa根治术后BCR的风险,现报道如下。
1资料与方法
1.1 一般资料 回顾性收集2001年7月~2013年1月在九江学院附属医院泌尿外科和南昌大学第二附属医院泌尿外科诊断为PCa,并接受RP治疗的668例患者,患者年龄54~79岁,平均年龄(68.34±7.62)岁,患者均接受术后随访。RP包括开放性前列腺癌根治术和腹腔镜下前列腺癌根治术。纳入标准:①明确诊断并接受PCa根治术患者;②定期来院接受术后随访和复查的患者;③临床资料完善,能够提取有效信息的患者。排除标准:①接受BCR随访2年以下的患者;②在随访期间内因其他疾病死亡的患者;③接受术前或术后内分泌治疗或盆腔放疗或化疗的患者;④在随访期间失联患者。本研究已通过九江学院附属医院医学伦理委员会批准(批准号:2020000136A)。
1.2方法 收集患者一般资料和手术相关资料。一般资料包括患者年龄、血清总PSA、血清睾酮、前列腺Gleason评分。在清晨空腹进行前列腺穿刺活检之前收集血样,通过直接化学发光测试血清睾酮水平,通过酶促发光法检测总PSA水平。手术相关资料包括前列腺病理分期、包膜侵犯、精囊浸润、手术切缘受累、淋巴结转移和术后Gleason评分,分析前列腺癌根治术后BCR的危险因素。
1.3随访终点 患者术后随访的主要终点为BCR:2次监测总PSA>0.2 ng/ml到最后一次随访的日期视为BCR。
1.4评分模型建立 收集术后随访观察到的BCR患者,并对患者的一般资料和手术相关资料与BCR的危险因素进行多因素分析,同时给予评分赋值。依据评分赋值将患者分为低风险组、中等风险组和高风险组,评估CSM的有效性。
1.5 统计学分析 采用SPSS 18.0软件包进行数据处理,计量资料用(x±s)描述,行t检验;多变量非条件Logistic回归模型用于评估预测前列腺穿刺阳性的预测;临床评分系统内的风险因子的得分基于多变量分析方法的OR值;使用Pearson测试和线性分析等初步统计方法评估评分模型的有效性;受试者工作特性曲线(ROC)进一步评估预测临床评分系统在术后BCR中阳性的预测价值,灵敏度和特异性用于评前列腺穿刺阳性的真实性和可靠性,通过使用Z检验测ROC曲线的价值。P<0.05表示差异有统计学意义。
2结果
2.1患者一般资料 668例患者中,86例不符合相关标准予以剔除,15例患者失去随访,67例患者要求接受术前或术后新辅助内分泌治疗,4例患者在随访5年内死于非前列腺癌相关死亡。最终共有582例患者纳入本次研究。所有患者随访6~122个月,平均随访时间(56.77±26.64)个月,患者RP治疗后5年内BCR为48.90%,患者术前年龄、血清总PSA水平和前列腺穿刺活检的Gleason评分等资料见表1。其中有1名患者的术后病理报告是具有恶性潜能的前列腺间质瘤,未进行Glesaon评分进行分类。
2.2术后BCR的危险因素分析 单因素分析BCR可能的危险因素,结果显示术后BCR与非BCR患者年龄和血清睾酮水平比较,差异无统计学意义(P>0.05),见表2;多因素Logistic回归分析显示,tPSA(HR=2.312,95%CI:1.624~3.285)、Gleason评分(HR=2.761,95%CI:1.925~4.276)、包膜侵犯(HR=1.925,95%CI:1.235~3.517),手术切缘阳性(HR=2.235,95%CI:1.684~3.927),精囊腺侵犯(HR=2.032,95%CI:1.528~3.529)和淋巴结转移(HR=2.586,95%CI:1.624~4.351)是患者术后BCR的独立危险因素,见表3。
2.3临床评分模型 为了进一步评估术后BCR与上述危险因素之间的关联,本研究建立了临床评分系统以评估术后BCR的风险。评分模型的总分为13分,分为三个风险类别:低风险(6~8分)、中等风险(9~11分)和高风险(12~14分),预测BCR的评分标准见表4。
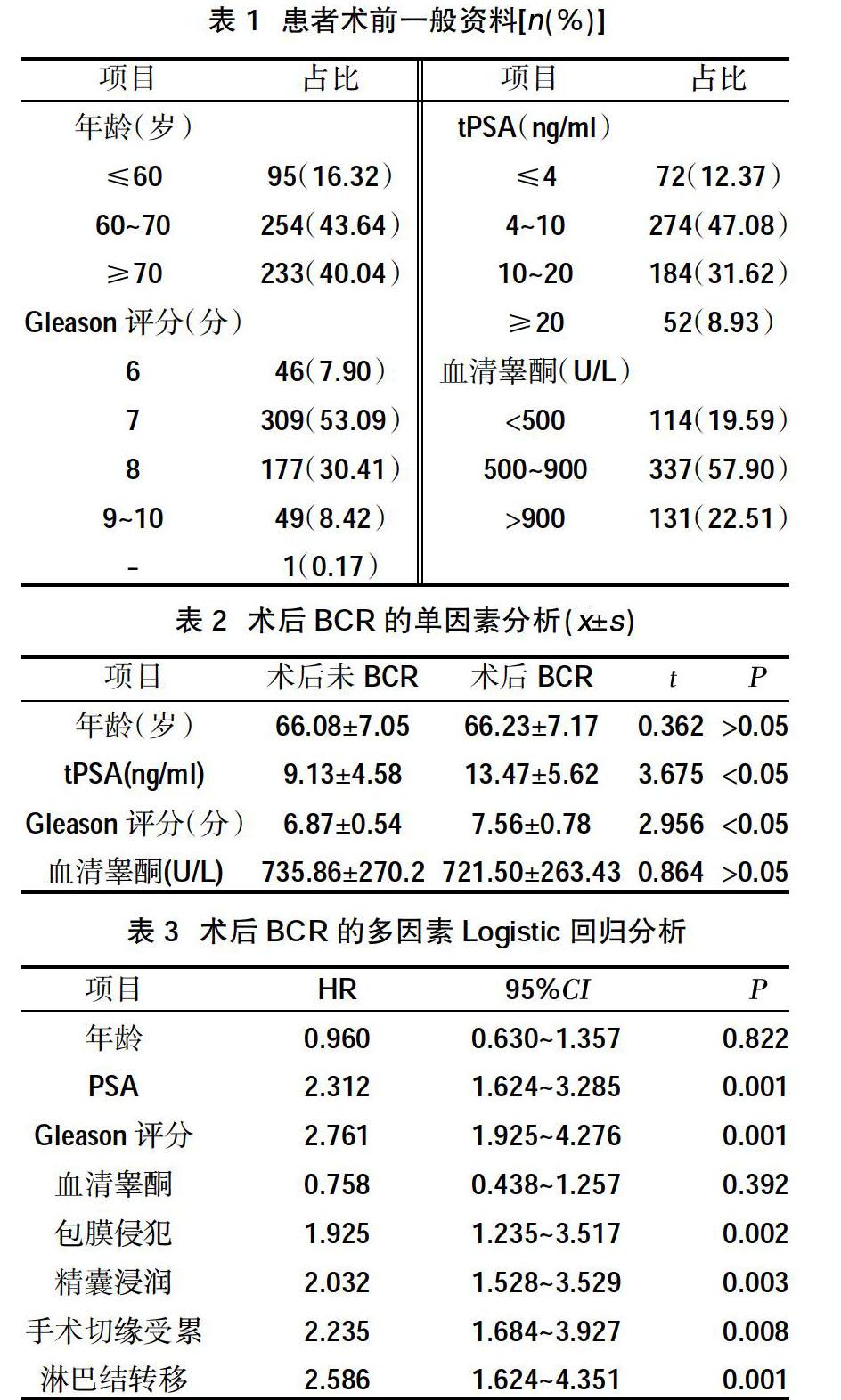
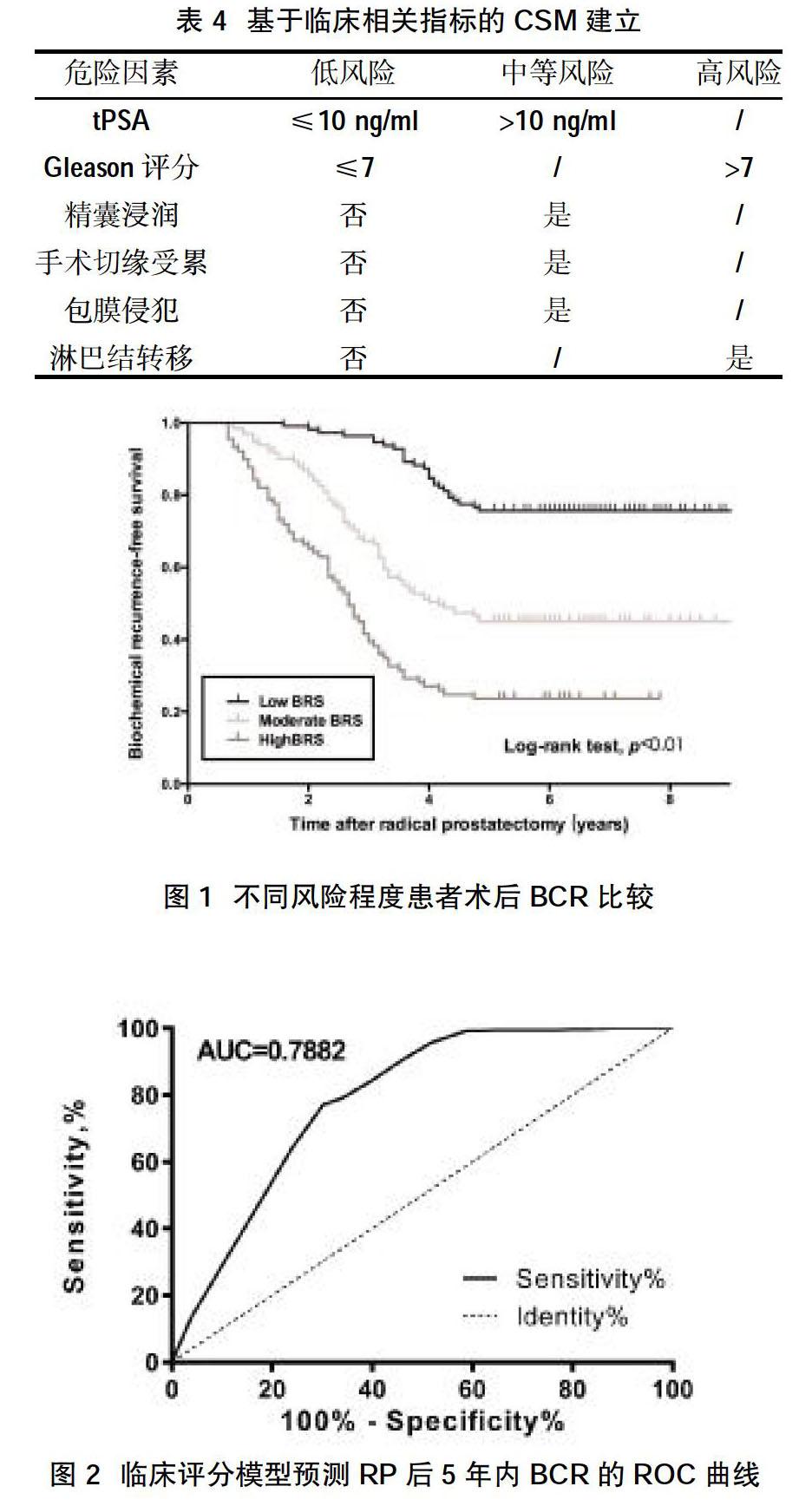
2.4临床评分模型的效能 Pearson检验和线性分析最初验证了臨床评分模型在预测BCR风险中的价值。将582例患者分为低、中、高风险组。根据上述临床评分模型,Kaplan-Meier分析显示,不同风险组患者发生BCR比较,差异有统计学意义,见图1。其中高风险组RP后5年内BCR率为64.72%,中风险组为58.91%,低风险组为28.20%。ROC曲线分析显示:该临床评分模型曲线下面积为0.7882,当截断值为10.5分时,临床评分模型的敏感性和特异性为77.08%和69.83%,可预测RP后5年内BCR的风险,见图2。
3讨论
預测术后BCR对判断前列腺癌复发具有重要意义[6]。本次研究结果显示,PCa患者RP后5年BCR发生率为48.90%,略高于既往研究报告[7-9]。这可能是由于在我院首次接受诊断和治疗的部分局部PC患者的PSA水平较高,这也意味着可能存在局部或远处的微转移。术后Gleason评分是预测BCR的有效的风险指标,Wong LM等[10]研究发现,术后Gleason评分在3+4和3+3之间患者术后BCR的发生风险基本一致,但术后Gleason评分≥8分可增加所有PCa患者和高危人群的癌症特异性死亡率[11]。此外,本次结果还显示,血清tPSA也是BCR的有效预测因子之一。血清tPSA是诊断和追踪PC患者的监测参数,术前血清tPSA水平越高意味着RP后的高风险BCR[12-14]。
阳性手术切缘是一个有争议的预测因子[15],本次研究结果表明手术切缘阳性具有预测BCR的能力。最近的一项荟萃分析也显示,切缘阳性是BCR和前列腺癌特异性死亡的危险因素,多项研究证实术后切缘阳性的患者有必要尽快行二级手术治疗,以降低BCR和肿瘤死亡率[16,17]。淋巴结转移是预测BCR的危险因素[18,19]。本次研究也证实了淋巴结转移可预测患者术后BCR。根治性前列腺切除术也可以选择局部晚期PC患者,但没有远处转移,盆腔淋巴结清扫和淋巴结清扫扩大是非常有意义的。一旦发现淋巴结转移,挽救淋巴结清扫可能会延迟某些患者的BCR和雄激素剥夺治疗[18]。RP术后淋巴结转移负荷低且病理性Gleason评分<8的患者可选择主动监测[19]。许多研究表明,血清睾酮与BCR密切相关[20,21],本研究表明,低血清总睾酮未被证实是BCR的独立预测因子。不一致的结果可能是由于其他积极因素比血清睾酮更有意义,这导致覆盖转移性PC的预测值。
临床评分模型优点可将若干个危险因素组合起来,通过诸如“低危”“中危”或“高危”风险的分类表示出来,两种最常用的预测风险模型是Kattan诺模图[3]和CAPRA评分[4]。手术切缘被认为是BCR的的独立预测因子,但未被纳入上述两种风险模型。因此,本研究其基础上增加了手术切缘因子,以更有效和全面地预测BCR。本次建立的临床评分模型基于多个变量的总分评估BCR的风险:≤8分为低风险,9~11为中等风险,≥12为高风险。本次研究结果显示,当截断值为10.5分时,临床评分模型的敏感性和特异性为77.08%和69.83%,可预测RP后5年内BCR的风险,说明该临床评分模型可以较好的评估PCa患者RP后5年后的BCR发生率。但本研究为回顾性分析,且样本量及纳入危险因素有限,可能尚未捕获其他有效事件。尚需要大样本和更长随访时间的前瞻性研究来验证其效果。
综上所述,CSM可预测前列腺癌患者前列腺癌根治术后BCR的风险,当患者的CSM较高时,临床应在患者术后早期进行干预,以降低其BCR风险。
参考文献:
[1]Richman DM,Tirumani SH,Hornick JL,et al.Beyond gastric adenocarcinoma:Multimodality assessment of common and uncommon gastric neoplasms[J].Abdom Radiol(NY),2017(42):124-140.
[2]Garcíabarreras S,Nunes I,Srougi V,et al.Predictors of early,intermediate and late biochemical recurrence after minimally invasive radical prostatectomy in a single-centre cohort with a mean follow-up of 8 years[J].Actas Urol Esp,2018(42):516-523.
[3]Kattan MW,Eastham JA,Stapleton AM,et al.A Preoperative Nomogram for Disease Recurrence Following Radical Prostatectomy for Prostate Cancer[J].J Natl Cancer Inst,1998,90(10):766-771.
[4]Vainshtein JM,Schipper M,Vance S,et al.Limitations of the Cancer of the Prostate Risk Assessment(CAPRA)Prognostic Tool for Prediction of Metastases and Prostate Cancer-specific Mortality in Patients Treated With External Beam Radiation Therapy[J].American Journal of Clinical Oncology,2016,39(2):173-180.
[5]Fuchsjager MH,Shukla-Dave A,Hricak H,et al.Magnetic resonance imaging in the prediction of biochemical recurrence of prostate cancer after radical prostatectomy[J].BJU International,2009,104(3):315-320.
[6]Jia ZW,Chang K,Dai B,et al.Factors influencing biochemical recurrence in patients who have received salvage radiotherapy after radical prostatectomy:a systematic review and meta analysis[J].Asian J Androl,2017,19(4):493-499.
[7]Morote J,Amo JD,Borque A,et al.Improved Prediction of Biochemical Recurrence After Radical Prostatectomy by Genetic Polymorphisms[J].Urol,2010(184):506-511.
[8]Liesenfeld L,Martina K,Juergen EG,et al.Prognostic Factors for Biochemical Recurrence More than 10 Years after Radical Prostatectomy[J].The Journal of Urology,2017,197(1):143-148.
[9]Hamada,Alaa,Razdan,et al.Early Return of Continence in Patients Undergoing Robot-Assisted Laparoscopic Prostatectomy Using Modified Maximal Urethral Length Preservation Technique[J].Journal of Endourology,2014,28(8):930-938.
[10]Wong LM,Tang V,Peters J,et al.Feasibility for active surveillance in biopsy Gleason 3+4 prostate cancer:an Australian radical prostatectomy cohort[J].BJU International,2016(117):82-87.
[11]Teloken PE,Li J,Woods CG,et al.The impact of prostate cancer zonal origin on pathological parameters at radical prostatectomy and subsequent biochemical failure[J].Journal of Urology,2017:S0022534717745417.
[12]Skove SL,Howard LE,Aronson WJ,et al.Timing of PSA Nadir after Radical Prostatectomy and Risk of Biochemical Recurrence[J].Urology,2017(108):129-134.
[13]Artibani W,Porcaro A,DeMarco V,et al.Management of Biochemical Recurrence after Primary Curative Treatment for Prostate Cancer:A Review[J].Urologia Internationalis,2018,100(3):251-262.
[14]Sokoll LJ,Zhang Z,Chan DW,et al.Do Ultrasensitive Prostate Specific Antigen Measurements Have a Role in Predicting Long-Term Biochemical Recurrence-Free Survival in Men after Radical Prostatectomy[J].Journal of Urology,2016,195(2):330-336.
[15]Zhang L,Wu B,Zha Z,et al.Surgical margin status and its impact on prostate cancer prognosis after radical prostatectomy:a meta-analysis[J].World Journal of Urology,2018,36(11):1803-1815.
[16]Sooriakumaran P,Dev HS,Skarecky D,et al.The importance of surgical margins in prostate cancer[J].Journal of Surgical Oncology,2016,113(3):310-315.
[17]Hamilton RJ,Banez LL,Aronson WJ,et al.Statin medication use and the risk of biochemical recurrence after radical prostatectomy:Results from the Shared Equal Access Regional Cancer Hospital(SEARCH)Database[J].Cancer,2010,116(14):3389-3398.
[18]Harke NN,Godes M,Wagner C,et al.Fluorescence-supported lymphography and extended pelvic lymph node dissection in robot-assisted radical prostatectomy:a prospective,randomized trial[J].World J Urol,2018,36(11):1817-1823.
[19]Pourmand G,Gooran S,Hossieni SR,et al.Correlation of Preoperative and Radical Prostatectomy Gleason Score: Examining the Predictors of Upgrade and Downgrade Results[J].Acta Medica Iranica,2017,55(4):249-253.
[20]Akitake N,Shiota M,Obata H,et al.Neoadjuvant androgen-deprivation therapy with radical prostatectomy for prostate cancer in association with age and serum testosterone[J].Prostate International,2017,6(3):104-109.
[21]Hwang EC,Yu SH,Jo YH,et al.Effect of serum testosterone and percent tumor volume on extra-prostatic extension and biochemical recurrence after laparoscopic radical prostatectomy[J].Asian Androl,2016(18):54-59.
收稿日期:2019-12-13;修回日期:2020-02-27
編辑/成森

