烟草CYP71D亚家族的生物信息学分析
王蕾 赵泽玉 陈明丽 龚达平

摘 要:细胞色素P450(CYP450)是一类超基因家族编码的多功能氧化酶,在生物合成、代谢解毒及植物防御方面具有重要作用。其中CYP71D属于CYP450的一个亚家族,主要在次生代谢物合成和病虫害防御方面起作用。为了更好地了解烟草CYP71D亚家族基因特征和功能,本研究利用生物信息学分析手段及烟草转录组数据,对CYP71D亚家族基因的结构和表达等进行了分析。结果发现,在烟草中共有42个CYP71D亚家族成员,各成员在染色体上并非均匀分布,其氨基酸长度和等电点差异较大,但基因结构、保守结构域数目和分布高度一致;二级结构分析表明,烟草CYP71D亚家族成员具备P450蛋白特征结构域;基因表达模式分析显示,多数CYP71D基因在根、叶、花中特异表达,大部分基因参与了IAA激素、黑胫病、温度等逆境胁迫反应。这为烟草CYP71D亚家族基因功能的深入研究及烟草抗逆品种的培育奠定了基础。
关键词:烟草;CYP71D亚家族;生物信息学分析
Bioinformatic Analysis of CYP71D Subfamily Genes in Tobacco (Nicotiana tabacum L.)
WANG Lei1,2, ZHAO Zeyu1,2, CHEN Mingli1, GONG Daping1*
(1. Tobacco Research Institute, Chinese Academy of Agricultural Sciences, Qingdao 266101, China; 2. Graduate School of Chinese Academy of Agricultural Sciences, Beijing 100081, China)
Abstract: Cytochrome P450 (CYP450) is a supergene family which encodes multifunctional oxidase, playing an important role in biosynthesis, metabolic detoxification, and plant defense. In CYP450 family, the CYP71D subfamily genes mainly function in secondary metabolite synthesis and pest control. In order to better understand the genetic characteristics and functions of tobacco CYP71D subfamily genes, their gene structure and expression pattern were analyzed by bioinformatics tools and transcriptome data. The results showed that there are 42 members in tobacco CYP71D subfamily and they were distributed on the chromosome unevenly. Besides, their amino acid lengths and isoelectric points were quite different, while their gene structure and conserved-domain distribution were highly consistent. The secondary structure analysis showed that CYP71D subfamily members contained the typical conserved domains in P450 proteins. The gene expression pattern analysis showed that most CYP71D genes were specifically expressed in roots, leaves and flowers, and some of them were induced by various elicitors, including phytohormone IAA, temperature and black shank. This study contributes to further researches in the function of CYP71D subfamily genes and breeding for stress-resistant tobacco cultivars.
Keywords: tobacco; CYP71D subfamily; bioinformatics analysis
細胞色素P450(cytochrome P450)是一类以血红素为辅基的B族细胞色素超家族蛋白酶,经过进化扩张形成,广泛存在于各种动物、植物、真菌和细菌中,是植物代谢中最大的酶家族[1]。1969年FREAR[2]首次在棉花(Gossypium hirsutum L.)发现P450s,随后陆续在其他多种植物中发现了P450s,如拟南芥(Arabidopsis thaliana L.)[3],水稻(Oryza sativa L.)[4],苜蓿(Medicago sativa L.)[5],菜豆(Phaseolus vulgaris L.)[6]等。目前已从植物中发现了127个P450基因家族,分为11个簇,包括单家族簇和多家族簇。CYP71簇(简称71 clan)是一个多家族簇,包含CYP71、CYP82、CYP93等多个家族,覆盖了超过半数的P450基因[7-8]。CYP71D亚家族则位于CYP71簇的CYP71家族。
植物P450的功能主要归为两大类,一类参与植物次生代谢物质的合成,如苯丙烷、萜类、植物激素类、黄酮类、木质素和生物碱等[9];一类参与解毒途径,催化外源化合物如除草剂、杀虫剂等变成非毒性物质[10]。CYP71D亚家族在植物中主要参与生物碱类、萜类、黄酮类等抗病原物有关次生代谢物的合成。辣椒CYP71D19 (AF122821)形成的产物在病菌侵染果实表皮时起保护作用[11];烟草CYP71D20能体外催化5-非手性-马兜铃烯(5-epi-aristolochene)和1-脱氧衣壳二醇(1-deoxycapsidiol)形成萜类植保素-甜椒素[12];烟草腺毛中的CYP71D16能催化叶面香气物质西柏三烯二醇的合成[13-16],但并不受外源MeJA的诱导[17]。
烟草是重要的经济作物,也是重要模式植物之一。解敏敏等[18]从烟草基因组中鉴定了44个P450家族,共263个成员,并分析了P450基因在各个组织的表达情况,但对烟草CYP71D亚家族基因功能的研究还不够详细。本研究采用生物信息学的方法从烟草基因组中鉴定了42个CYP71D基因,并分析了CYP71D亚家族成员的基因结构、二级元件及表达模式,以期为烟草CYP71D基因的功能研究及抗病虫品种的培育提供参考。
1 材料与方法
1.1 烟草CYP71D亚家族成员的鉴定及理化性质分析
从Pfam数据库(http://pfam.xfam.org/)下載P450家族种子序列(Pfam ID: PF00067),用HMMER3.0检索烟草K326蛋白数据库[19](https://solgenomics.net/),获得候选P450蛋白。将其与番茄P450家族(http://drnelson.uthsc.edu/ CytochromeP450.html)比对得到候选烟草CYP71D蛋白序列[20]。利用ExPASy ProtParam (http://web.expasy.org/protparam/)分析烟草CYP71D亚家族成员的氨基酸长度、分子量和等电点等理化性质。
1.2 烟草CYP71D亚家族基因结构、保守结构域和二级结构元件分析
利用MEGA 7.0对CYP71D亚家族基因进行多序列比对构建邻接进化树。利用基因预测信息分析CYP71D亚家族成员基因结构,利用MEME (http://meme-suite.org/)预测分析CYP71D亚家族成员蛋白序列的保守结构域,使用TBtools软件进行可视化。以PDB数据库(http://www.rcsb.org/ pdb/home/home.do)获得的拟南芥AtAOS (CYP74A)的结构信息为模板分析CYP71D亚家族成员的二级结构。
1.3 烟草CYP71D亚家族基因表达模式聚类分析
从NCBI SRA数据库(https://www.ncbi.nlm.nih. gov/sra/)下载烟草转录组(RNA-seq)数据,包括TN90各个组织(根、茎、幼叶、成熟叶、衰老叶、未成熟花、成熟花、衰老花和果实);在H2O和IAA中处理24和72 h的南江3号种子;感染黑胫病12、72 h的红花大金元成熟茎组织;高温、中温、低温胁迫下20、40、60 d云烟87的根和叶组织;4 ℃处理0、4、24、48 h的NC567和台烟8号叶组织。利用TopHat2[21]和Cufflink程序分析转录组数据并计算表达量,使用pheatmap程序绘制热图。
2 结 果
2.1 烟草CYP71D亚家族成员的鉴定及理化性质分析
应用HMMER3.0软件检索烟草K326蛋白数据库,共获得639条候选P450蛋白序列。将其与番茄每个亚家族P450蛋白序列比对,鉴定了烟草CYP71D亚家族中93个成员。剔除过短片段(氨基酸序列<350)和不包含K螺旋(ExxR)及血红素结合域(FxxGxxxCxG)的蛋白[22],最终得到42个烟草CYP71D亚家族成员(表1)。烟草CYP71D基因在17条染色体上并非随机分布。其中22号染色体上分布数量最多,有10个基因。在scaffold Nitab4.5_0000390上有4个CYP71D基因串联分布,在scaffold Nitab4.5_0001182、Nitab4.5_0001264、Nitab4.5_0004164、Nitab4.5_0006052和Nitab4.5_ 0008401上分别有2个CYP71D基因串联分布。对烟草CYP71D亚家族成员理化性质分析发现,除Nitab4.5_0000163g0260.1外,其他成员氨基酸长度在417~559 aa之间,分子量介于47~63 kD左右,理论等电点在6.39~9.44之间(表1)。
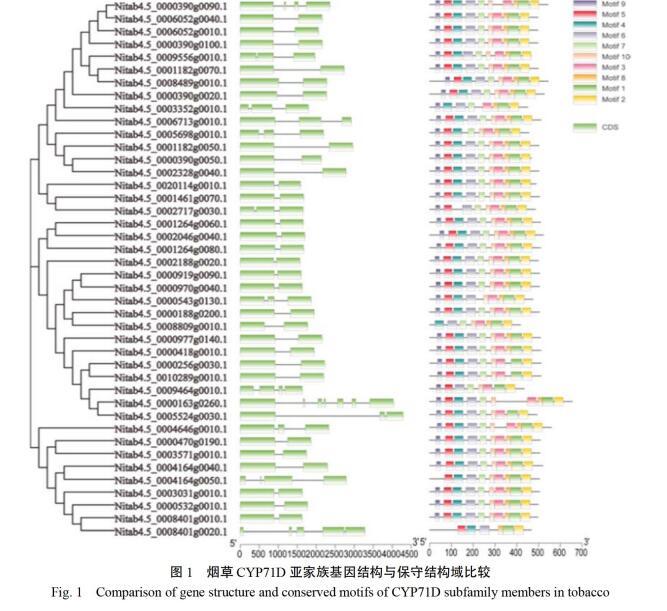
2.2 烟草CYP71D亚家族基因结构与保守结构域分析
系统进化分析和基因结构分析显示(图1),烟草CYP71D亚家族大部分成员只有一个内含子,小部分成员包含多个内含子,多由较长的2个外显子和几个非常短的外显子组成。CYP71D亚家族成员间基因结构与进化距离存在紧密联系,亲缘关系
越近则基因结构越相似,内含子大小越接近。利用MEME搜索烟草CYP71D亚家族成员的保守基序显示,亚家族成员保守基序(motif)的种类、数目和分布高度一致[23]。其中,31个含有全部10个保守基序,11个存在1~3个保守基序的缺失。
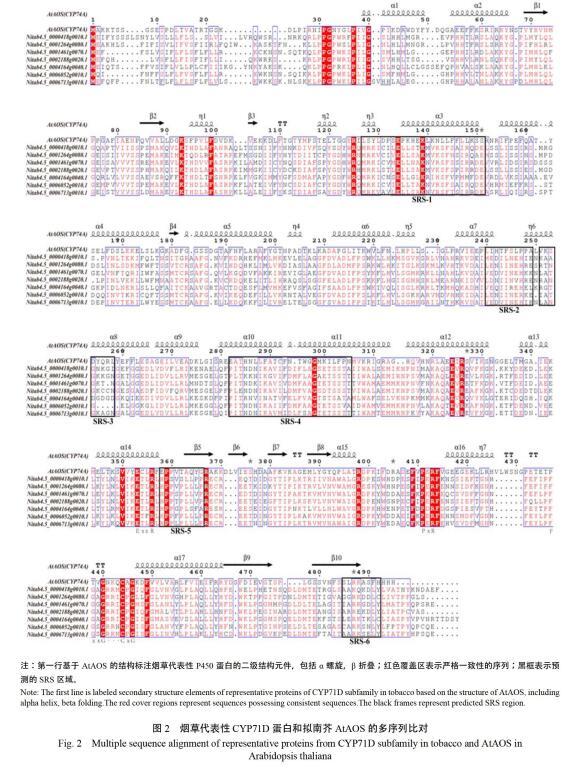
2.3 烟草CYP71D亚家族二级结构预测及分析
以拟南芥AtAOS (CYP74A)基因的二级结构为模板,对烟草CYP71D基因的二级结构分析表明(图2),所有CYP71D家族蛋白序列中都含有P450蛋白典型的保守结构域,包括PERF结构域(PxRx)、K螺旋(ExxR)和C末端的血红素结合域(FxxGxxxCxG)。血红素结合域是鉴定P450蛋白的主要特征结构,该结构域中存在与铁元素形成硫醇盐离子键的绝对保守的半胱氨酸残基(Cys),K螺旋中的谷氨酸(Glu)和精氨酸(Arg)也绝对保守[24],参与P450核心结构的稳定,与PERF结构域形成盐桥发生相互作用。6个底物识别位点(substrate recognition sites,SRS)[25]通过诱导-契合机制识别底物,与底物结合参与随后的催化反应,这些可变区域存在较大差异。
2.4 烟草CYP71D亚家族基因表达模式分析
烟草不同组织及诱导胁迫下的CYP71D基因表达数据聚类分析显示,烟草CYP71D基因的表达模式大致分为6个不同的类群,如图3所示。第1类基因,除Nitab4.5_0005698g0010.1受温度胁迫在根和叶中表达外,其他基因主要在花中表达。第2类基因,部分具有组织特异性表达,如Nitab4.5_0000418g0010.1和Nitab4.5_0001264g0080.1仅在衰老花中特异表达,并且Nitab4.5_ 0000418g0010.1在黑胫病感染的茎组织中表达量上调,Nitab4.5_0001264g0080.1在IAA中吸胀24 h和未经处理萌发72 h的种子中高表达;Nitab4.5_0000977g0140.1在未经处理的休眠种子中特异表达,在H2O和IAA中吸胀后萌发72 h的种子中表达量较高;该类剩余其他基因在所有组织中都几乎不表达。第3类基因,在根、休眠种子中表达量较高,受IAA、温度和黑胫病菌胁迫调控。第4类基因可能是参与温度响应的基因,在根中的表达受温度胁迫调控。第5类基因主要在叶和根组织中表达,受温度、黑胫病菌诱导。第6类基因,可能是参与胁迫应答的基因,受IAA、黑胫病菌、温度等多个因素诱导调控,在休眠种子和根中高表达。
3 討 论
本研究利用生物信息学方法,从烟草基因组中鉴定得到了42个CYP71D亚家族成员。相比番茄基因组中16个CYP71D基因[26],烟草CYP71D基因的数目是番茄的2.6倍,这可能是由于烟草为异源四倍体,大多数基因包含两个拷贝。CYP71D基因在染色体上并非均匀分布,一半成员成簇分布,这可能是基因复制的结果[27]。CYP71D亚家族成员间内含子保守情况与进化相关[28],烟草CYP71D亚家族中大多数成员只有一个内含子,进化距离越近,内含子长度越接近,基因结构越相似。
P450功能的多样性是为了适应各种组织不同代谢途径和环境胁迫进化的结果。大多数进化距离较近的CYP71D亚家族成员在表达谱特征上也比较相似,说明他们可能具有类似的功能。大多数P450基因在植物各组织中表达量较低,特别是一些参与内源信号分子代谢途径的P450基因,受外界生物与非生物胁迫诱导时才响应表达。烟草CYP71D基因的表达模式分析表明,CYP71D亚家族基因在IAA诱导、黑胫病和温度胁迫下,表达量发生不同程度的上调或下调,该CYP71D家族可能主要参与外界胁迫应答反应。
休眠种子和萌发种子中CYP71D基因的表达模式完全相反。CYP71D基因在生长素响应的种子次生休眠过程中可能参与了黄酮醇生物合成、赤霉素代谢等,在生长素响应的种子萌发过程中可能参与了脱落酸、生长素、茉莉酸和水杨酸介导的激素信号通路[29]。在黑胫病菌诱导下,烟草CYP71D亚家族有近一半的基因表达量发生变化。李立芹等[30]、苏振刚等[31]运用抑制性消减杂交技术(SSH)筛选的黑胫病抗性相关的差异表达基因中也包含了P450基因。此外,在烟草抗黑胫病过程中发现有5个miRNA的靶基因编码细胞色素P450[32-33]。这表明P450基因在烟草对黑胫病的抗病过程中起着非常重要的作用。当烟草根和叶受冷热胁迫时,显著影响烟草生理特征[34],本研究中分别有约1/2和1/3的CYP71D基因表达量发生变化。已有研究表明,在多年生黑麦草和高羊茅中,CYP71家族基因参与温度胁迫响应[35]。茶树在冷热胁迫下,CYP71A26基因表达量下降,而CYP71B34表达量上升[36]。本研究还发现,烟草部分CYP71D成员受多种逆境胁迫和激素响应均出现表达量明显变化,这些基因具体的分子调控机理还有待进一步研究。
4 结 论
本研究通过生物信息学方法从烟草基因组中鉴定出42个CYP71D亚家族基因,这些基因在染色体上并非均匀分布,理化性质差异较大,但基因结构和保守结构域高度一致。表达模式分析表明,CYP71D亚家族大部分基因参与IAA诱导、黑胫病和温度等胁迫过程,可能在植物防御反应方面具有重要的作用。这为CYP71D亚家族基因功能的深入研究和抗逆烟草品种的培育提供了参考。
参考文献
[1]DANI?LE W R, REN? F. Cytochromes P450: a success story[J]. Genome Biology, 2000, 1(6): 1-9.
[2]FREAR D S, SWANSON H R, TANAKA F S. N-Demethylation of substituted 3-(phenyl)-1-methylureas: isolation and characterization of a microsomal mixed function oxidase from cotton[J]. Phytochemistry, 1969, 8(11): 2157-2169.
[3]MAO G, SEEBECK T, SCHRENKER D, et al. CYP709B3, a cytochrome P450 monooxygenase gene involved in salt tolerance in Arabidopsis thaliana[J]. BMC Plant Biology, 2013, 13(1): 169.
[4]KAIFA W, HUIQIN C. Global identification, structural analysis and expression characterization of cytochrome P450 monooxygenase superfamily in rice[J]. BMC Genomics, 2018, 19(1): 35.
[5]LI L, CHENG H, GAI J, et al. Genome-wide identification and characterization of putative cytochrome P450 genes in the model legume Medicago truncatula[J]. Planta, 2007, 226(1): 109-123.
[6]SHAILENDAR K M, SRIKIRAN C S, BABU P R, et al. Classification of cytochrome P450s in common bean (Phaseolus vulgaris L.)[J]. Plant Systematics and Evolution, 2015, 301(1): 211-216.
[7]NELSON D, DANI?LE W R. A P450-centric view of plant evolution[J]. The Plant Journal, 2011, 66(1): 194-211.
[8]NELSON D R. Progress in tracing the evolutionary paths of cytochrome P450[J]. Biochim Biophys Acta, 2011, 1814(1): 14-18.
[9]解敏敏. 烟草重要基因篇:8. 烟草P450基因[J]. 中国烟草科学,2015,36(2):118-120.
XIE M M. Important genes of tobacco: 8. Tobacco P450 gene[J]. Chinese Tobacco Science, 2015, 36(2): 118-120.
[10]MOORE M T, KR?GER R. Effect of three insecticides and two herbicides on rice (Oryza sativa) seedling germination and growth[J]. Archives of Environmental Contamination & Toxicology, 2010, 59(4): 574-581.
[11]OH B, KO M K, KIM Y, et al. A cytochrome P450 gene is differentially expressed in compatible and incompatible interactions between pepper (Capsicum annuum) and the anthracnose fungus, colletotrichum gloeosporioides[J]. Molecular Plant-Microbe Interactions, 1999, 12(12): 1044-1052.
[12]RALSTON L, KWON S T, SCHOENBECK M, et al. Cloning, heterologous expression, and functional characterization of 5-epi-aristolochene-1,3-dihydroxylase from tobacco (Nicotiana tabacum)[J]. Archives of Biochemistry & Biophysics, 2001, 393(2): 222-235.
[13]WANG E M, WANG R, DEPARASIS J, et al. Suppression of a P450 hydroxylase gene in plant trichome glands enhances natural-product-based aphid resistance[J]. Nature Biotechnology, 2001, 19(4): 371-374.
[14]向章敏,唐遠驹,郑少清,等. 不同晒晾烟品种西柏烷二萜醇的研究[J]. 中国烟草科学,2015,36(5):53-58.
XIANG Z M, TANG Y J, ZHENG S Q, et al. Study on cembrenediol content in different cultivars of sun-cured tobacco[J]. Chinese Tobacco Science, 2015, 36(5): 53-58.
[15]何康,张怀宝,杜咏梅,等. 超临界CO2萃取烟花中西柏三烯二醇工艺研究[J]. 中国烟草科学,2017,38(2):81-87.
HE K, ZHANG H B, DU Y M, et al. Studying of supercritical CO2 extraction of cembratriene-diols from tobacco flowers[J]. Chinese Tobacco Science, 2017, 38(2): 81-87.
[16]付秋娟,杜咏梅,刘新民,等. 超高效液相色谱法测定烟草西柏三烯二醇[J]. 中国烟草科学,2017,38(3):67-73.
FU Q J, DU Y M, LIU X M, et al. Determination of cembratriene-diol in tobacco by ultra performance liquid chromatography[J]. Chinese Tobacco Science, 2017, 38(3): 67-73.
[17]冯琦,王永,武东玲,等. 外源MeJA诱导烟草叶面防御反应[J]. 中国烟草科学,2013,34(5):83-88.
FENG Q , WANG Y, WU D L, et al. Defense response of tobacco leaf surface to exogenous methyl jasmonate[J]. Chinese Tobacco Science, 2013, 34(5): 83-88.
[18]解敏敏,龔达平,李凤霞,等. 烟草细胞色素P450的基因组学分析[J]. 遗传,2013,35(3):379-387.
XIE M M, GONG D P, LI F X, et al. Genome-wide analysis of cytochrome P450 monooxygenase genes in the tobacco[J]. Inheritance, 2013, 35(3): 379-387.
[19]EDWARDS K D, FERNANDEZ P N, DRAKE S K, et al. A reference genome for Nicotiana tabacum enables map-based cloning of homeologous loci implicated in nitrogen utilization efficiency[J]. BMC Genomics, 2017, 18(1): 448.
[20]NELSON D R. Cytochrome P450 nomenclature[J]. Methods in Molecular Biology, 1998, 107: 15-24.
[21]KIM D, PERTEA G, TRAPNELL C, et al. TopHat 2: Accurate alignment of transcriptomes in the presence of insertions, deletions and gene fusions[J]. Genome biology, 2013, 14(4): R36.
[22]SYED K, MASHELE S S. Comparative analysis of P450 signature motifs ExxR and CxG in the large and diverse kingdom of fungi: Identification of evolutionarily conserved amino acid patterns characteristic of P450 family[J]. Plos One, 2014, 9(4): e95616.
[23]RUPASINGHE S, SCHULER M A. Homology modeling of plant cytochrome P450s[J]. Phytochemistry Reviews, 2006, 5: 473-505.
[24]贺丽虹,赵淑娟,胡之璧. 植物细胞色素P450基因与功能研究进展[J]. 药物生物技术,2008(2):142-147.
HE L H, ZHAO S J, HU Z B. Gene and function research progress of plant cytochrome P450s[J]. Pharmaceutical Biotechnology, 2008(2): 142-147.
[25]王珺霞,毕杰,卢星宇,等. 哺乳动物细胞色素P450酶中底物识别位点与功能的进化关系[J]. 生物物理学报,2015,31(2):154-164.
WANG J X, BI J, LU X Y, et al. Evolutionary relationship of substrate recognition sites with protein functions of mammalian cytochrome P450 enzymes[J]. Acta Biophysica Sinica, 2015, 31(2): 154-164.
[26]VASAV A P, BARVKAR V T. Phylogenomic analysis of cytochrome P450 multigene family and their differential expression analysis in Solanum lycopersicum L. suggested tissue specific promoters[J]. BMC Genomics, 2019, 20(1): 116.
[27]HOLUB E B. The arms race is ancient history in Arabidopsis, the wildflower[J]. Nature Reviews Genetics, 2001, 2(7): 516-527.
[28]PAQUETTE S M, BAK S, FEYEREISEN R. Intron-exon organization and phylogeny in a large superfamily, the paralogous cytochrome P450 genes of Arabidopsis thaliana[J]. DNA Cell Biol, 2000, 19(5): 307-317.
[29]李振华. 外源生长素和赤霉素信号调控烟草种子休眠与萌发的机理[D]. 北京:中国农业大学,2017.
LI Z H. Mechanism on exogenous auxin and gibberellin signal induced seed dormancy and germination in tobacco[D]. Beijing: China Agricultural University, 2017.
[30]李立芹,鲁黎明. 抑制性消减杂交技术(SSH)及其在烟草生物学研究中的应用[J]. 中国烟草科学,2011(3):97-102.
LI L Q, LU L M. Application of suppression subtractive hybridization (SSH) on tobacco research[J]. Chinese Tobacco Science, 2011(3): 97-102.
[31]苏振刚,杨爱国,孙玉合,等. 黑胫病菌诱导的烟草SSH文库构建及其分析[J]. 作物學报,2011,37(10):1763-1770.
SU Z G, YANG A G, SUN Y H, et al. Construction and analysis of tobacco SSH library induced by phytophthora parasitica var. nicotianae[J]. Acta Sinica, 2011, 37(10): 1763-1770.
[32]GARCIA D. A miRacle in plant development: role of micro RNAs in cell differentiation and patterning[J]. Seminars in Cell and Developmental Biology, 2008, 19(6): 586-595.
[33]黄飞燕,叶贤文,王戈,等. 烟草黑胫病胁迫相关miRNA鉴定及功能分析[J]. 基因组学与应用生物学,2018,37(1):373-385.
HUANG F Y, YE X W, WANG G, et al. Identification and functional analysis of mi RNA related to tobacco black shank stress[J]. Genomics and Applied Biology, 2018, 37(1): 373-385.
[34]李琦瑶,王树声,周培禄,等. 低温胁迫对烟苗叶形及生理特性的影响[J]. 中国烟草科学,2018,39(1):17-23.
LI Q Y, WANG S S, ZHOU P L, et al. Effects of low temperature stress on leaf shape and physiological characteristics in tobacco seedlings[J]. Chinese Tobacco Science, 2018, 39(1): 17-23.
[35]TAO X, WANG M X, DAI Y, et al. Identification and expression profile of CYPome in Perennial ryegrass and Tall fescue in response to temperature stress[J]. Frontiers in Plant Science, 2017, 8: 1519.
[36]单睿阳,林郑和,陈志辉,等. 茶树细胞色素P450基因CYP71A26与CYP71B34的克隆及差异表达特征分析[J]. 茶叶科学,2018,38(5):450-460.
SHAN R Y, LIN Z H, CHEN Z H, et al. Molecular cloning and expression analysis of cytochrome P450 CYP71A26 and CYP71B34 genes in tea plants (Camellia sinensis)[J]. Tea Science, 2018, 38 (5): 450-460.
基金项目:中国烟草总公司科技重大专项项目“K326和红花大金元品种蚜虫抗性的定向改良”[110201801024(JY-01)]
作者简介:王 蕾(1994-),女,硕士研究生,主要从事作物遗传育种研究。E-mail:wanglei941220 @163.com
*通信作者,E-mail:gongdaping@caas.cn
收稿日期:2019-10-16 修回日期:2020-01-02

