基于GC-MS的6种常见霉菌纯培养期间挥发性物质的检测
胡振阳 都立辉 杨卫民 刘凌平 袁 康 袁 建 鞠兴荣
(南京财经大学食品科学与工程学院;江苏省现代粮食流通与安全协同创新中心;江苏高校粮油质量安全控制及深加工重点实验室1,南京 210023) (国家粮食和物资储备局标准质量中心2,北京 100037)
我国每年都会储藏和轮换大量粮食[1],由于粮食生产的地区不均衡性,我国“北粮南运”,粮食工程可达2亿吨左右[2]。粮食生产中不可避免的携带的虫卵和霉菌孢子,随着粮食的收获进入储藏环节,造成了粮食安全隐患。据联合国粮农组织(FAO)估算,全世界因粮食等农作物产品受霉菌污染所造成的经济损失可达数千亿美元,而我国每年因霉菌污染造成的粮食损失高达2 100万t,占全国粮食总产量的4.2%,同时产毒霉菌产生的毒素对全世界25%的粮油作物造成污染[3],甚至严重威胁人畜健康[4,5]。霉菌由于消耗其营养成分, 快速繁殖造成粮食营养价值、加工工艺品质等受到严重影响[6]。因此,粮食中霉菌污染的早期检测是预防和控制粮食中霉菌污染的关键。由于霉菌不断分解霉变粮食有机质会产生一些特征挥发性物质,随着粮食种类、污染霉菌的种类、污染程度的改变,这些代谢产物会发生变化,而这些挥发性物质可作为粮食霉变的指标[7,8]。
早期关于对不同含水量的小麦霉变检测也证实霉变粮食的挥发性组分的特征性[9]。目前,多数研究侧重于稻谷霉菌数量的定性区分[10,11],缺乏对稻谷中霉菌自身特征性挥发性成分的研究。本研究利用气相色谱质谱联用(GC-MS)技术对六种稻谷中常见霉菌的挥发性气体物质进行检测分析,以期找出不同种类霉菌生长阶段的特异性挥发性物质,来精确筛选霉菌种类,获取早期预防粮食霉变的准确信息,为粮食中进一步霉菌的快速检测及早期预警提供参考。
1 材料与设备
1.1 实验材料
马铃薯葡萄糖琼脂培养基(PDA)、标准菌株灰绿曲霉3.3975以及由南京财经大学从稻谷中分出并经基因鉴定的亮白曲霉菌株、橘灰青霉Pp、产黄青霉M31、尖孢镰刀菌Pr、有毒镰刀菌6株。
1.2 主要仪器
GC(7890A)-MS(5975C)气质联用分析仪;50/30 μm-PDMS/DVB/CAR固相微萃取头;65 μm-PDMS/DVB固相微萃取头;手动SPME进样手柄; YX-280A型手提式不锈钢压力蒸汽灭菌器;WH-2微型旋涡混合仪;BCD-268WSV型冰箱;血球计数板;EX30生物显微镜。
2 实验方法
2.1 霉菌孢子悬浮液的收集与处理
将6种稻谷霉菌接种到经120 ℃灭菌20 min的马铃薯葡萄糖琼脂培养基(PDA)中于28 ℃培养箱中培养7 d,取5 mL的灭菌水于培养基表面。轻微振荡后,移取培养基表面的孢子悬浮液于EP管中。将孢子悬浮液置于WH-2微型旋涡混合仪振荡混匀20 s,取50 μL混匀的孢子悬浮液于清洗干净的血球计数板上,在显微镜下观察并计数。将6种霉菌孢子悬浮液的孢子浓度用无菌水调至106个/mL数量级的浓度,置于-20 ℃冰箱中保藏备用。
2.2 霉菌的培养
以灰绿曲霉3.3975为例,分别取10 mL经120 ℃灭菌20 min的马铃薯葡萄糖琼脂培养基(PDA)分别置于2个100 mL的锥形瓶中,摇匀,共计得到2瓶的PDA培养基。待培养基凝固后,取50 μL稻谷霉菌孢子悬浮液加入到装有培养基的1个锥形瓶中,摇匀,剩余1瓶PDA培养基加入50 μL的无菌水做空白对照,用锡纸及无菌膜封住锥形瓶瓶口,28 ℃条件下培养,共培养15 d,每隔1 d进行GC-MS检测分析,其中每个样品均检测3次。其余5种稻谷霉菌培养条件同上。
2.3 GC-MS检测
分别选取培养1、3、5、7、9、11、13 d和15 d的霉菌样品及空白样品进行GC-MS检测分析,把装有样品的锥形瓶置于30 ℃恒温水浴锅中平衡1 h,分别使用50/30 μm-PDMS/DVB/CAR和65 μm-PDMS/DVB两种固相微萃取头定期检测样品,所有实验均测定3次,将固相微萃取头穿过无菌膜、锡纸的小孔插入到锥形瓶中,顶空萃取40 min后,将萃取头迅速插入到GC-MS进样口中,250 ℃不分流模式下解析5 min。
气相色谱条件:色谱柱为HP-5MS毛细管柱(30 m×0.25 mm,0.25 μm),进样口温度为250 ℃,总流量为34 mL/min,隔垫吹扫流量为3 mL/min,载气为氦气,设定流速为1.0 mL/min,采用不分流的分流方式,GC-MS升温程序见表1。
质谱条件:接口温度为280 ℃,离子源为EI,离子源温度为230 ℃,电子能量70 eV,质量扫描范围(m/z)50~400 amu,采集模式为全扫描。

表1 GC-MS升温程序
2.4 实验数据处理
实验数据经计算机检索,并与NIST 08标准质谱库匹配求得,统计匹配度大于80的挥发性成分。采用峰面积归一化法,以各挥发性物质的峰面积占总峰面积的比值表示该物质的相对含量。采用Excel软件进行数据统计及绘图。
3 结果与讨论
通过对每个样品GC-MS谱图检索结果中的挥发性成分进行分类,可分成烷类、烯类、醇类、酮类、醛类、酸酯类、杂环类及其他共七大类,与曹俊等[12]的研究结果基本一致,并对挥发性物质类别的含量进行统计分析,各个成分的含量变化趋势以柱状图展示。
3.1 空白样品挥发性物质分析
由图1可知,醛类物质含量最高,其次是烷类物质,醛类物质基本先增加后减少,第7 d含量最多,其他类物质变化趋势不明显。这方面两种固相微萃取头萃取所得结果相同,而酸酯类、醇类和酮类物质含量在使用50/30 μm固相微萃取头检测时的结果比较低,这与65 μm固相微萃取头萃取所得结果有些差异,说明同样培养基采用不同固相微萃取头萃取所得的挥发性物质也会不同,这应主要与固相微萃取头表面的纤维涂层有关,不同的纤维涂层可以吸附不同的物质。
采用不同的固相微萃取头可精准筛选出同一真菌代谢途径中生物合成的衍生化合物,例如,在同一培养介质中始终能被检测到的挥发性成分可作为实时监测并鉴别霉菌污染的指示物。对典型挥发性指示物选取合适的传感装置,进行构建粮食中霉菌污染实时监测的系统,并通过结合模式识别法可同时鉴别出霉菌种类,为后期实时监测提供良好的参考价值。


图1 空白样品挥发性物质分析
3.2 灰绿曲霉3.3975的挥发性物质分析
由图2a可知,第1 d,醛类物质含量最高。这与对应的空白样品相同。第3/5 d,烯类物质迅速增加,醛类物质含量降至0,杂环类物质有所增加。烷类物质在整个过程中先增加后减少,第9 d含量最高;烯类物质在霉菌生长过程中,先减少后增加。与对应的空白样品相比较得出特殊性挥发性成分:1,3-二氯苯,1,4-二氯苯,双环辛-1,3,5-三烯,吡嗪,1,3-二嗪。


图2 灰绿曲霉3.3975的挥发性物质分析
由图2b可以看出,第1 d,醛类物质最多,这同样与相对应的空白样品的结果相似。第3 d,醛类物质含量有所下降,杂环类物质增加,与对应的空白样品相似,不同的是空白样品醇类物质增加,而培养灰绿曲霉3.3975样品的醇类物质几乎不变,这与霉菌的生长有关。第5 d,烷类物质和醇类物质迅速增加,而醛类物质减少至0。此后挥发性物质主要是烷类物质,至15 d烯类物质迅速增加。2种固相微萃取头对灰绿曲霉3.3975的挥发物质分析,同样存在不可避免的差异性,但1,3-二氯苯、1,4-二氯苯两种产物几乎在每次的测定中均被显著地稳定检测出,2种固相微萃取头检测互相佐证将其判定为特殊性挥发性成分。
3.3 亮白曲霉的挥发性物质分析
由图3a可知,第1 d醛类物质含量最高,第3 d酮类含量为0,而烷类和烯类物质含量较高,第5 d烯类物质含量最高,此后烯类物质减少,而醇类物质逐渐增加。其特殊性挥发性物质是十一烷、乙基苯、苯乙烯、柠檬烯、桉油精、1,3-二嗪。
由图3b可知,第1 d醛类物质相对含量最高,第3 d酮类物质迅速增加,这一结果在2种萃取头上获得的结果差异较大,第5 d杂环类物质和烷类物质迅速增加,与用50/30 μm-PDMS/DVB/CAR固相微萃取头检测不同的是,第5 d后杂环类相对含量减少,而烷类和醇类物质含量较高。其特殊性挥发性成分以其烷类和醇类物质为主,分别是十一烷、十二烷、二叔丁基对甲酚、桉油精,其中桉油精是一种醇类物质。


图3 亮白曲霉的挥发性物质分析
3.4 橘灰青霉Pp的挥发性物质分析
由图4a可知,第3 d烷类物质含量较高。得出的特殊挥发性物质:柠檬烯、罗汉柏烯、1-乙基环戊烯、倍半水芹烯、2-甲氧基-3-(1-甲基乙基)吡嗪、2-甲氧基-3-(1-甲基丙基)吡嗪、2-甲氧基-3-(2-甲基丙基)吡嗪、十二烷、二十八烷、亚乙基环戊烷。
由图4b可知,第1 d醛类物质含量最高,此后主要为烯类和杂环类物质,其特殊性挥发性成分为1-乙基环戊烯、α-柏木烯、罗汉柏烯、2-甲氧基-3-(2-甲基丙基)-吡嗪、2-甲基异莰醇、1,3-二甲氧基苯。1,3-二甲氧基苯可作为一种曲霉属中杂色曲霉群特异性挥发性物质的指标。较早的研究发现,其仅在杂色曲霉菌培养过程中检测到[13,14]。在本研究中,该化合物在橘灰青霉生长代谢阶段中同样被检测到,与Matysik等[15]在链格孢菌、拟青霉和各种青霉菌的顶空固相微萃取中检测分析结果一致。


图4 橘灰青霉Pp的挥发性物质分析
3.5 产黄青霉M31的挥发性物质分析
由图5a可知,特殊挥发性成分有:邻二甲苯、对二甲苯、乙苯、1,4-二氯苯、1,3-辛二烯、苯乙烯、双环[4.2.0]辛-1,3,5-三烯、3-环庚烯-1-酮、1,3-二嗪,既有与65 μm固相微萃取头萃取得到相同的物质,也有不同的物质。现今被检测到的挥发性物质,例如1-辛烯-3-醇、2-苯乙醇和1,3-二甲氧基苯,大多不同的真菌属都可挥发产生[16]。
观察图5b可知,第1 d主要为醛类物质,第3 d醛类物质迅速下降,而烯类和烷类物质显著增加,此后挥发性物质主要为烷类和烯类物质。在第11 d烯类物质含量很高,而此时烷类物质含量很低。得出的特殊性挥发性物质是:邻二甲苯、对二甲苯、1,3-二甲苯、1,3-二氯苯、1,3-辛二烯、5-(1-甲基亚乙基)-1,3-环戊二烯。


图5 产黄青霉M31的挥发性物质分析
3.6 尖孢镰刀菌Pr的挥发性物质分析
观察图6a可知,对比65 μm固相微萃取头的结果,物质含量变化相似,得出的特殊挥发性物质是柠檬烯、贝壳杉烯、十一烷、十二烷、1,3-二嗪。
由图6b可知,第1 d醛类和烷类物质含量较高,第3 d烯类和酸酯类物质显著增加,此后挥发性物质主要是烯类物质。得出的特殊挥发性成分有柠檬烯、贝壳杉烯、1,8-二甲基-4-(1-甲基乙烯基)螺[4.5]癸-7-烯、三十一烷、十四烷、1,3,5-三氯-2-甲氧基苯。


图6 尖孢镰刀菌Pr的挥发性物质分析
3.7 有毒镰刀菌的挥发性物质分析
观察图7a可知,第1 d醛类物质含量最高;第3 d主要是醛类和醇类物;第5天烷类、烯类、酸酯类物质增多;第7 d杂环类物质含量最高;第9 d主要是烷类、烯类和杂环类物质;此后主要是酮类和醛类物质。得到的主要挥发性物质有1,3-二甲苯、乙苯、1-氯-2-甲氧基苯、1,3-二氯-2-甲氧基苯、2,4-二氯-5-氟苯乙酮、3-氯-4-甲氧基苯甲醛、3,4-二甲氧基苯甲醛、苄腈、萘。
1,3-二甲苯在Roussel等[17]的研究中发现为曲霉属的特异挥发性组分。这是首次在有毒镰刀菌生长代谢过程中检测出1,3-二甲苯的存在,但50/30 μm-PDMS/DVB/CAR固相微萃取头发现其作为主要挥发性成分,由于分析监测的手段日益增多,多种挥发性组分也日益显现,为后期实时监测途径提供不同真菌属代谢组分,为快速定性定量检测奠定坚实基础。
由图7b可知,第1 d醛类物质含量最高,第3 d酸酯类物质显著增加,5~9 d主要为烯类、酸酯类和杂环类及其他物质,11 d后主要为酮类和醛类物质,其特殊的挥发性物质是三环庚烷、3-蒈烯、α-石竹烯、顺式-α-红没药烯、(E)-3,7-二甲基-1,3,6-辛三烯、3-氯-4-甲氧基苯甲醛、3,4-二甲氧基苯甲醛、2,4-二氯-5-氟代苯乙酮、甲氧基乙酸,2-十四烷基酯。

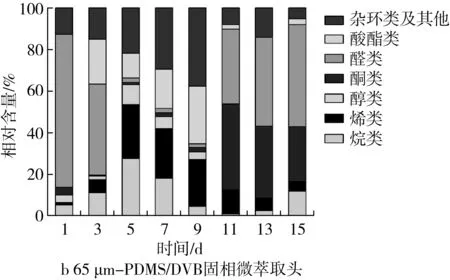
图7 有毒镰刀菌的挥发性物质分析
3.8 讨论
GC-MS检测结果表明,灰绿曲霉的醛类物质由高到低,烯类物质先减少后增加,烷类物质先增加后减少;亮白曲霉醛类物质由高到低,烯类物质先增加后减少,醇类物质含量逐渐增加;橘灰青霉前期醛类物质含量最高,中后期主要为烯类和杂环类物质;产黄青霉前期醛类物质含量最高,中后期主要为烷类和烯类物质;尖孢镰刀菌前期醛类和烷类物质,中期烯类和酸酯类物质,后期主要是烯类物质;有毒镰刀菌前期醛类物质,中期酸酯类物质显著增加,后期主要为烯类、酸酯类和杂环类及其他物质。同种菌属间不同生长代谢阶段挥发性物质种类与含量差异显著,而不同菌属间的特征挥发性物质差异更加显著,表明微生物在生长过程中,其产生的挥发性物质种类逐渐增加,相应增加其特异性。
对于微生物产生复杂的挥发性组分而言,受关注度也渐渐显露,但纷繁复杂的功能作用仍难以阐释。本研究初步确定6种稻谷常见霉菌的特征挥发性物质,但这些物质在霉菌生长阶段的释放机理尚不清楚, 可在今后的研究中进行深入探讨。挥发性组分在调节作物生长、发育、防御以及作物间信号通路联络具有丰富的优势[18]。但报道称,现已关注的10 000种微生物中,仅有400种能够产生挥发性化合物[19]。本研究中的6种稻谷优势真菌在不同的顶空固相微萃取头被检测出的挥发性成分显现出良好的特异性,将其对比研究参考,更有可能鉴定出对应菌属的生长状态,快速响应粮食品质的防控方案。此外,其挥发性组分被农业科学家视为控制各种植物病原体的生物防治剂及作物生长的生物肥料,在食品工业中,其生物防治特性被用于采后作物疾病预防。而关于被作为生物燃料的潜在来源的研究,微生物挥发性组分的优势更加突显[20]。
4 结论
利用GC-MS技术,采用两种不同的萃取头对6种粮食储藏过程中的特征霉菌在纯培养基上生长期间产生的挥发性成分进行研究。结果表明,6种常见稻谷霉菌生长期间产生的挥发性物质主要是烷类、烯类、醇类、酮类、醛类、酸酯类、杂环类及其他等七大类。筛选出6种霉菌的特异性挥发性组分,其中,灰绿曲霉:1,3-二氯苯、1,4-二氯苯;亮白曲霉:十一烷、桉油精;橘灰青霉Pp:1-乙基环戊烯、2-甲氧基-3-(2-甲基丙基)-吡嗪;产黄青霉M31:邻二甲苯、对二甲苯、1,3-辛二烯;尖孢镰刀菌Pr:柠檬烯、贝壳杉烯;有毒镰刀菌:3-氯-4-甲氧基苯甲醛、3,4-二甲氧基苯甲醛。与仅通过二氧化碳的气体浓度检测霉菌的生长相比,相应霉菌特征成分的检测更有可能鉴定到对应霉菌种类的生长,可通过构建粮食中霉菌污染实时监测的系统鉴别出霉菌种类,尤其是霉菌的早期实时在线监测,为粮食储藏的精准安全控制提供参考。

