前列腺癌中微小RNA-362-3p的表达及意义
王 刚,姚丽霞,杨 涛,彭克楠,郭留雄,魏 东,谷守义,刘俊江
(河北省人民医院 1.泌尿外科,2.老年病二科,3.检验科,河北 石家庄 050051)
前列腺癌是男性生殖系统中常见的肿瘤,病变的发生与基因和遗传因素的改变有关[1]。微小RNA(miRNAs)是近年发现的与肿瘤形成和进展有关的因子,通过与靶mRNA的3′UTR区域结合发挥调控靶基因的作用[2]。本研究通过在The Cancer Genome Atlas(TCGA)数据库中对前列腺癌中miRNAs的差异性表达进行筛选,选择在前列腺癌中异常表达明显、且尚未见报道的微小RNA-362-3p(miR-362-3p)进行研究,并应用软件预测下游的靶因子,选择与miR-362-3p关联性最强的上皮型粘附素(E-cadherin)、基质金属蛋白酶-11(MMP-11)和基质金属蛋白酶-14(MMP-14)作为靶基因,探讨其临床意义及相关性。
1 资料与方法
1.1 一般资料
选择2014年1月至2016年6月确诊为前列腺癌的患者67例为研究对象。纳入标准:①术后病理确诊为前列腺癌,并符合WHO中的标准;②首诊患者。排除标准:①多原发癌;②术前行放、化疗。年龄55~86岁,中位年龄67岁。留取术后的肿瘤组织作为观察组。同期,选择前列腺增生的组织67例为对照组,年龄56~84岁,中位年龄68岁。均留取病变组织的新鲜冻存标本(-80 ℃保存)和石蜡包埋组织。二组在年龄的比较中无明显差别。研究经医院伦理委员会批准,家属均签订知情同意书。
1.2 miR-362-3p的检测
检测前列腺癌和前列腺增生组织中miR-362-3p的表达。应用实时荧光定量qRT-PCR法进行检测。引物由江苏楚天生物科技公司合成。上游:5′-GATGACACTGAGGCTGAG-3′,下游:5′-ACGTGCACTTCGTCCGCTT-3′内参为U6,上游:5′-GGAACAGAGAAAGATTAGC-3′,下游:5′-TTGGAATTCACG AATTCCG-3′。提取总RNA,cDNAs由TaqMan MicroRNA合成,试剂购自江苏楚天生物科技公司。循环参数:95 ℃ 10 min,1个循环;95 ℃ 30 s,59 ℃ 30 s,72 ℃ 30 s,共31个循环,72 ℃延伸6 min。60 ℃进行信号采集,记录Ct值。通过2-ΔΔCt法表示结果。ΔΔCt=[Ct目的基因(未知样品)-Ct对照(未知样品)]-[Ct目的基因(校正样品)-Ct对照(校正样品)]。
1.3 免疫组化的检测
免疫组化SP法检测E-cadherin和MMP-11表达。简略步骤为:石蜡包埋前列腺癌组织,4 μm切片,DAB显色,以黄色和黄褐色为阳性。E-cadherin阳性部位是细胞膜,MMP-11阳性部位是细胞质和/或细胞膜,选择5个显色最明显的400倍视野进行计数,计算阳性率并取平均值。
1.4 Western Blot法
应用Western Blot法检测前列腺癌组织中MMP-14的表达,以MMP-14与GAPDH比值表示MMP-14的相对表达量。
1.5 统计学方法
应用SPSS17.0软件进行数据分析。实验中计量资料应用均数±标准差表示,两组间的比较应用独立样本的t检验。相关分析行Pearson相关分析。行K-M生存分析,以α=0.05为检验水准,以P<0.05为差异具有显著性。
2 结 果
2.1 两组中miR-362-3p表达
见图1显示实时荧光定量PCR的扩增曲线,如表1所示,miR-362-3p在观察组中的表达显著低于对照组(P<0.05)。
(n=67)
2.2 观察组不同临床特征分组患者术后组织中miR-362-3p表达
MiR-362-3p在脉管癌栓、Gleason分级、转移和不同TNM分期的表达中有统计学差别(P<0.05),而在不同年龄、神经累犯的表达中无统计学差别(P>0.05)。见表2。
2.3 观察组中miR-362-3p表达的生存分析
观察组均进行术后3年(36月)的随访,方式为电话、门诊及家访等形式,截止时间点2019年6月30日。其中生存30例,死亡34例,失访患者3例。死亡患者确诊后的生存时间7~36个月,生存中位数为20个月。生存分析显示miR-362-3p与生存时间有关(χ2=6.31,P=0.001)。见图2。
2.4 前列腺癌组织miR-362-3p与E-cadherin、MMP-11的相关性
如图3A所示,E-cadherin表达部位是在癌细胞的细胞膜,呈棕黄色,E-cadherin在前列腺癌中的阳性率范围3~55%,平均21.4%。相关分析显示miR-362-3p与E-cadherin呈正相关性(r=0.59,P=0.013)(见图3B)。
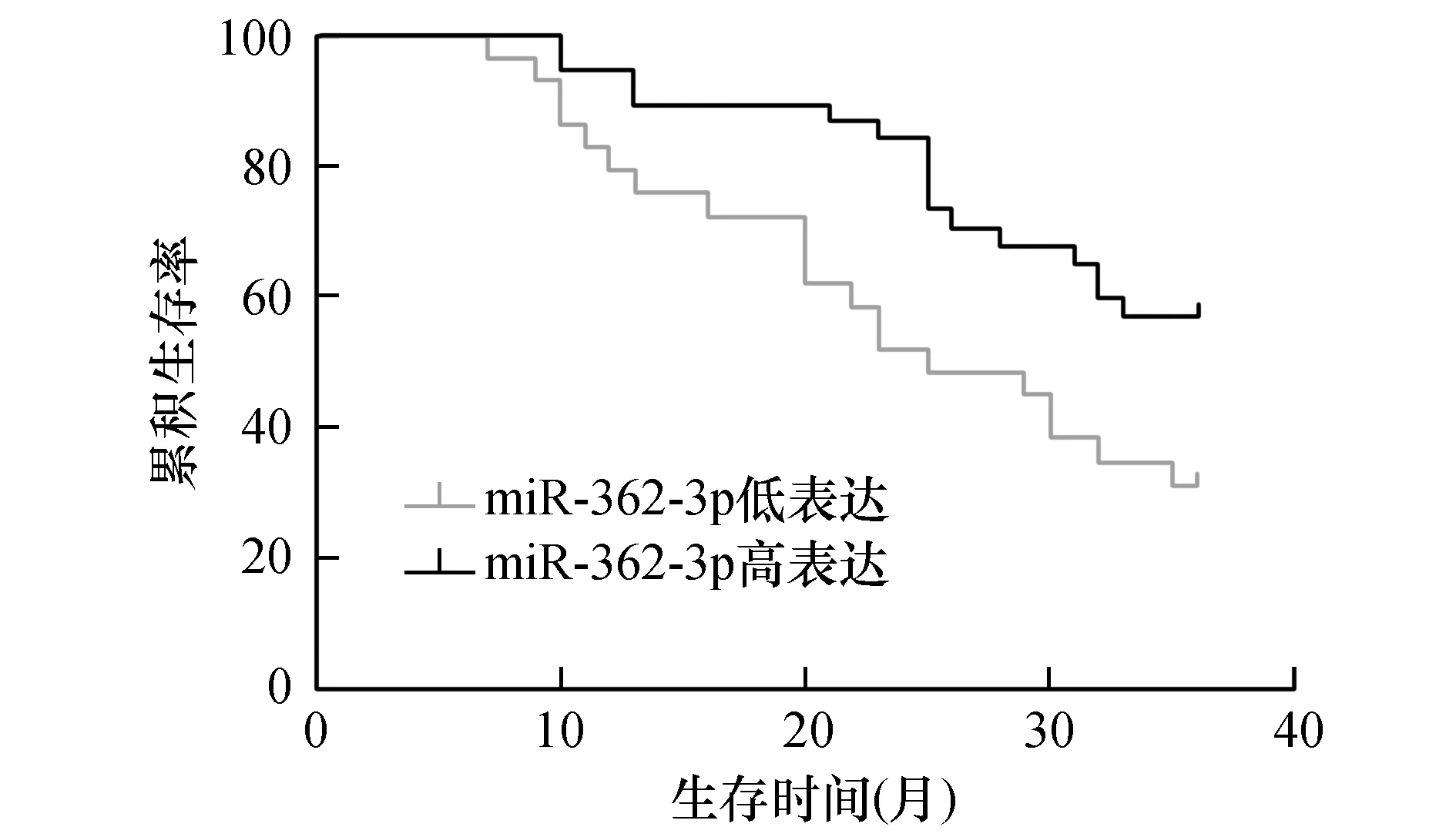
图2 miR-362-3p生存分析图
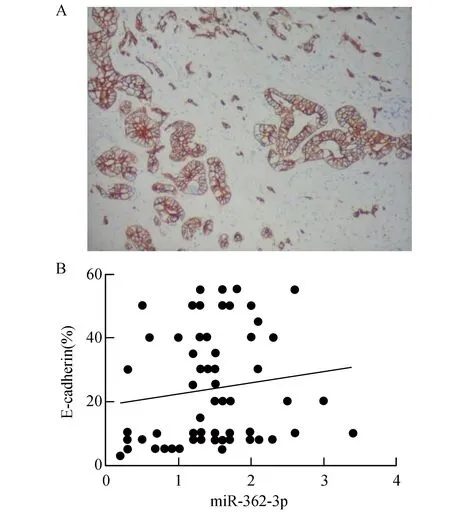
图3 E-cadherin在前列腺癌中表达及其与-cadherin之间具有相关性A:E-cadherin在前列腺癌中表达的免疫组化图(200×),B:miR-362-3p与E-cadherin之间具有正相关的趋势散点图
2.5 前列腺癌组织MMP-11的表达,及与miR-362-3p相关性
如图4A所示,MMP-11表达部位是在癌细胞的细胞质和细胞膜,呈棕黄色,MMP-11在前列腺癌中的阳性率范围10~70%,平均39.0%,相关分析显示miR-362-3p与MMP-11呈负相关性(r=-0.50,P=0.019)。见图4B。
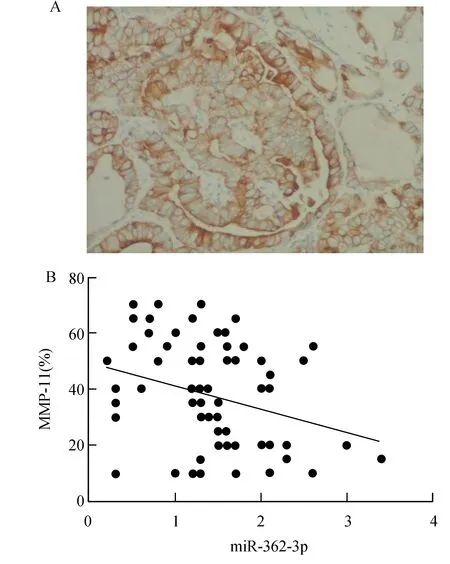
图4 MMP-11的表达及其与miR-362-3p相关性A:MMP-11在前列腺癌中的表达(400×);B:miR-362-3p与MMP-11之间的相关趋势散点图
2.6 前列腺癌中miR-362-3p与MMP-14的相关性
如图5所示,Western Blot法检测MMP-14在前列腺癌中表达,结果显示,MMP-14在癌组织中的表达较高,范围是0.9~3.8,平均2.1。相关分析显示miR-362-3p与MMP-14呈负相关性(r=-0.49,P=0.021)(见图6)。

图5 MMP-14在前列腺癌中的表达
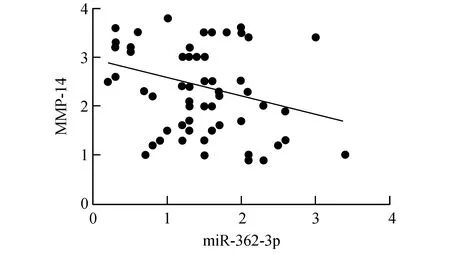
图6 miR-362-3p与MMP-14相关性的散点图
3 讨 论
前列腺癌病变的机理与基因和遗传因素密切相关[3],涉及到DNA、RNA及蛋白表达的异常调控。miRNAs是近年发现的与肿瘤相关的因子[4]。其作为非编码单链RNA分子,长度为18-25核苷酸,由前体miRNA剪切产生,与靶基因mRNA的3′-UTR区域的特异性因子结合引起mRNA降解或翻译的抑制,不仅对细胞增殖和凋亡进行调控,还对肿瘤的转移、上皮间质转化有重要的调控作用。我们在基因库中筛选到miR-362-3p是重要的腺癌调控因子,其靶基因有40多个,本研究选择的靶因子均为转移相关的[5-6]。E-cadherin是细胞粘附因子中的成员,在正常的上皮细胞中高表达,在肿瘤细胞中的表达常下调,对同质型粘附具有重要作用[7]。MMP-11和MMP-14是基质金属蛋白酶家族中的成员,对细胞外基质和Ⅳ型胶原的降解作用强,其异常表达后可以引起肿瘤转移屏障降解,使肿瘤细胞易于离开原发灶形成转移灶,为肿瘤侵袭提供重要的帮助[8-9]。
本研究显示miR-362-3p在前列腺增生和前列腺癌组织中的表达有明显差异,提示miR-362-3p表达下调是肿瘤形成的重要分子事件。前列腺增生为非肿瘤性病变的组织,其组织中miR-362-3p具有一定的表达量,与抑癌基因的作用相似。结果显示miR-362-3p在有无脉管癌栓和转移的表达中差别有统计学意义,提示miR-362-3p低表达可以促进肿瘤的转移[10]。Gleason分级和TNM分期是与肿瘤进展和预后有关的指标,本研究发现了miR-362-3p在不同Gleason分级和TNM分期中的表达有差异,提示miR-362-3p异常表达对判断肿瘤的生物学行为可能有一定意义。本研究发现了miR-362-3p的表达与生存时间的关系,提示检测miR-362-3p的表达对判断预后有一定意义,即miR-362-3p低表达患者的预后差。MiR-362-3p的作用与较多的下游因子有关,如通过CD82促进胃癌细胞上皮间质的转化[11],在肾癌中miR-362-3p表达下降并靶向NEMO样激酶基因调节肿瘤的进展[12]。这些作用与本实验发现的miR-362-3p在前列腺癌中表达的结果较为一致。相关分析显示miR-362-3p与MMP-11、miR-362-3p与MMP-14、miR-362-3p与E-cadherin具有相关性,提示miR-362-3p低表达时可通过改变上述因子的表达进而调节肿瘤的进展,也间接证实了miR-362-3p对MMP-11、MMP-14和E-cadherin的靶向关系,但是其具体靶向关系尚需后续应用双荧光素酶报告基因实验来证实。MiR-362-3p异常表达能促进肿瘤细胞粘附性改变[13-14],引起细胞间连接的松散,细胞易于离开原发灶出现播散,为肿瘤的转移提供条件。MMP-11和MMP-14高表达时能引起肿瘤细胞周围的基质、基底膜和Ⅳ型胶原溶解,使细胞转移的屏障作用减弱或消失,引起肿瘤细胞发生迁移。MiR-362-3p在不同类型肿瘤中的表达作用可能不同[15]。赵越等[16]在喉鳞癌中发现miR-362-3p高表达,认为其在鳞癌中具有癌基因样的作用,其作用可能与肿瘤的低氧环境有关,因此miR-362-3p可能仅在腺癌中具有肿瘤抑制的作用。我们在基因数据库的分析中也显示出E-cadherin、MMP-11和MMP-14是miR-362-3p的下游靶基因,与本实验的部分结论具有一致性。E-cadherin是与miR-362-3p关联性最强的因子,提示miR-362-3p对调控粘附的作用更强。MMP-11和MMP-14被活化后其下游调节通路多且复杂[9]。MMP-14也受控于多种因子[17-18],MMP-14在MMPs调节网络中可能具有核心调控作用[19]。miR-362-3p与前列腺癌预后的关系是本研究中的重要发现,但是由于本实验中标本收集的局限性,尚需要后续进行多中心、大样本分析验证后明确。
总之,miR-362-3p在前列腺癌中低表达,与转移指标具有相关性,可能是判断前列腺癌预后的指标。

