血清HMGB-1、MIF、TIMP-1在评估脑出血患者预后中的价值
潘 红
(海安市人民医院检验科中心实验室,江苏 海安 226600)
脑出血是非外伤性脑实质出血疾病,具有较高的发病率、致残率及死亡率[1]。脑出血导致的占位性损伤,可引起周围脑组织循环障碍、代谢紊乱[2],最终引起脑组织缺血缺氧[3]。免疫因子在脑出血发生发展过程中发挥重要作用。生理条件下,巨噬细胞移动抑制因子(Macrophage mobility inhibitor,MIF)在神经细胞、脑脊液和血中表达稳定,脑出血时,MIF表达失调,血中含量发生明显变化[4]。高迁移率蛋白-1(high mobility group box-1,HMGB-1)作为一种炎性介质,在患者组织损伤及修复过程中具有放大炎症反应的作用,不仅对多种疾病的发生抑制,且对外界刺激的敏感性低,稳定性强[5]。近年来,在脑血管疾病中,组织基质金属蛋白酶抑制剂-1(tissue inhibitor of metalloproteinase,TIMP-1)受到越来越多的学者关注。本研究拟动态监测脑出血患者血清HMGB-1、MIF和TIMP-1水平的变化情况,并对其临床意义进行分析,报道如下:
1 资料与方法
1.1 一般资料
本研究经医院伦理委员会批准后进行。选取本院2017年1月至2018年1月收治的100例脑出血患者作为脑出血组,其中男55例,女45例,46~76岁,平均(58.3±4.6)岁。另选取同期来本院进行体检的100例健康者作为健康组,体检无脑血管疾病相关症状,影像学检查未发现脑出血病变,其中男58例,女42例,48~75岁,平均(57.9±4.7)岁。两组一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 脑出血组纳入与排除标准
脑出血组纳入标准:①符合第四届全国脑血管病学术会议制定的脑出血诊断标准[6],且经头颅CT或MRI检查确诊为脑出血;②首次发病,且均于发病后24h内入院;③既往无脑出血相关疾病;④近期(1个月内)未服用激素类、免疫抑制剂或抗生素药物治疗;⑤患者知情并签署知情同意书。脑出血组排除标准:①外伤性颅内出血、颅内肿瘤、脑梗死、蛛网膜下腔出血、脑血管畸形、混合性脑出血患者;②恶性肿瘤、心肝肾功能明显异常者;③近期感染、肺栓塞、凝血功能障碍、下肢深静脉血栓、意识障碍、自身免疫系统缺陷及合并神经系统感染的患者;④有头颅手术史的患者。
1.3 治疗方法
脑出血组入院后,给予患者脱水、营养神经及对症治疗等常规处理。脑出血后24 h内、3天、5天、7天和14天,分别于采集空腹下的静脉血5 mL,抽取对照组空腹静脉血5 mL,先室温下放置30 min,再于4 ℃、3 000 r/min下离心10 min后取上层血清,置于-80 ℃冰箱中保存待检。
1.4 酶联免疫吸附法
采用酶联免疫吸附法(ELISA)检测血清中HMGB-1、MIF和TIMP-1含量,检测步骤按试剂盒说明书进行操作,三种试剂盒均由美国R&D公司提供。动态监测脑出血患者入院后24 h内、3天、5天、7天和14天的血清HMGB-1、MIF和TIMP-1含量,并与健康组比较。
1.5 出血量观察
根据出血量大小进行分组,出血量>30 mL者,记为大量脑出血;出血量为15~30 mL者,记为中量出血;出血量<15 mL,记为少量出血。出血量的计算均由一个人完成。
1.6 病情观察
以病情严重程度为依据进行分组,意识状态清楚,且肌力III级以上者,记为轻型;若中等程度意识障碍,且肌力II~III级者,记为中型;若重度意识障碍,且肌力0~I级,记为重型。
1.7 预后评分
对脑出血患者90天随访,采用改良Rankin评分(modifiedRankin scale,mRS)与格拉斯哥预后评分(Glasgowoutcome scale,GOS)进行预后评价,mRS>2分与GOS<4分则判定为不良预后[7-9]。
1.8 统计学方法
2 结 果
2.1 血清HMGB-1、MIF和TIMP-1含量
与健康组比较,脑出血组患者入院后24 h内、3天、5天、7天和14天的血清HMGB-1、MIF和TIMP-1含量均显著升高(P<0.05),脑出血患者入院后血清HMGB-1、MIF和TIMP-1含量先逐渐上升,至入院后5天达高峰,再逐渐降低,入院后14天的血清HMGB-1、MIF和TIMP-1含量与健康组比较差异无统计学意义(P>0.05)。详见表1。
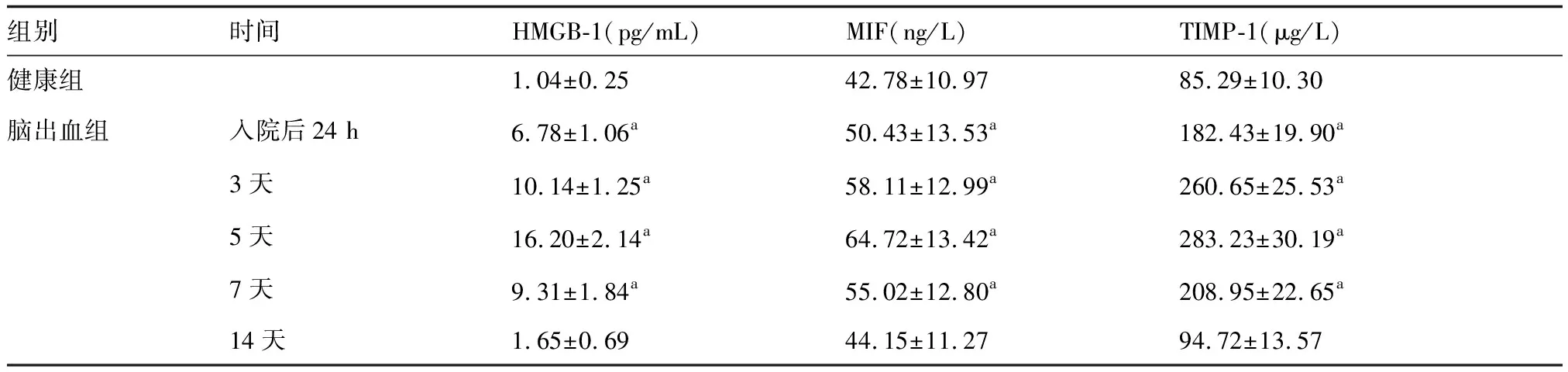
表1 脑出血患者和健康者血清HMGB-1、MIF和TIMP-1含量比较
与健康组比较,aP<0.05(n=100)
2.2 脑出血患者血清HMGB-1、MIF和TIMP-1水平与出血量的相关性
发病24h时,出血量大的患者HMGB-1、MIF和TIMP-1水平最高,显著高于中量和少量出血组(P<0.05)。Pearson相关分析结果显示,血清HMGB-1、MIF和TIMP-1水平与出血量大小呈正相关性(P<0.05)。具体见表2。
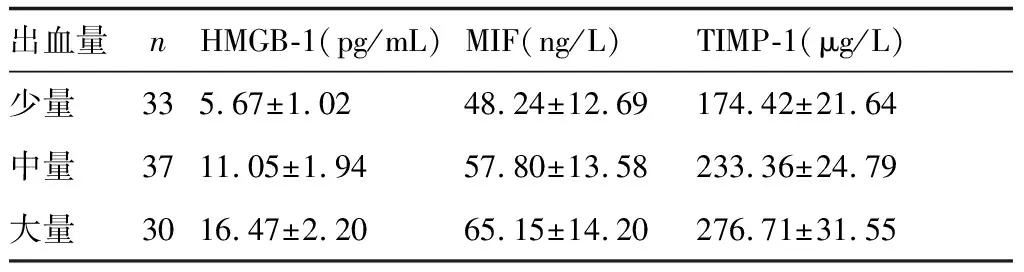
表2 脑出血患者血清HMGB-1、MIF和TIMP-1水平与出血量的相关性
2.3 脑出血患者血清HMGB-1、MIF和TIMP-1水平与病情严重程度的相关性
发病24h时,病情重型组患者的HMGB-1、MIF和TIMP-1水平最高,显著高于病情中型和轻型组,比较差异具有统计学意义(P<0.05)。Pearson相关分析结果显示,血清HMGB-1、MIF和TIMP-1水平与病情严重程度呈正相关性(P<0.05)。详见表3。
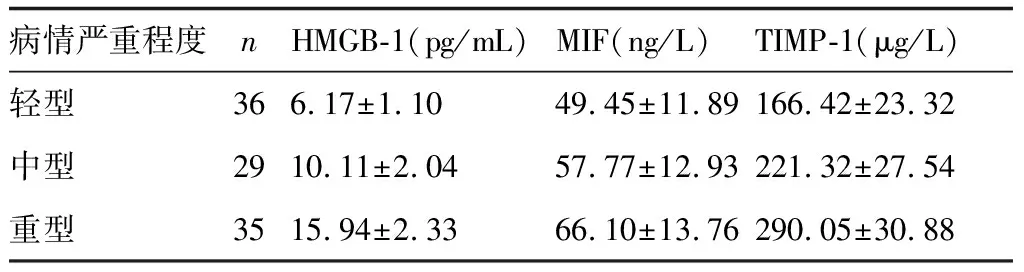
表3 脑出血患者血清HMGB-1、MIF和TIMP-1水平与病情严重程度的相关性
2.4 脑出血预后的多因素Logistic回归分析
因变量为出院后90天不良预后,将HMGB-1、MIF、TIMP-1、出血量、病情严重程度及脑室出血作为自变量,经多因素Logistic回归分析显示,HMGB-1、MIF、TIMP-1、出血量、病情严重程度与不良预后密切相关,可作为独立危险因素。详见表4。
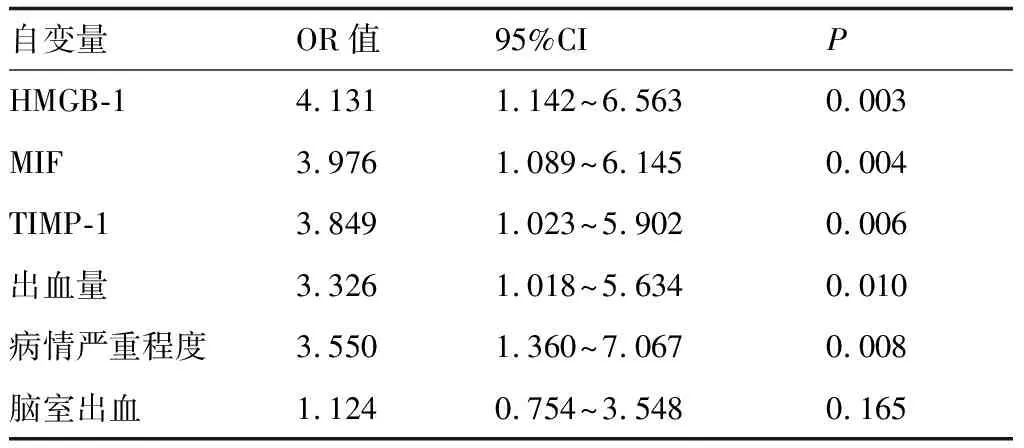
表4 脑出血预后的多因素Logistic回归分析
3 讨 论
脑出血是神经系统一种常见的危急重症,可形成局部血肿,直接破坏脑组织,出现继发性脑损伤,影响机体微环境的形成[10-11]。脑出血后机体释放炎症因子,引起脑水肿而加重脑损伤[12]。MIF是一种重要的炎症因子,使巨噬细胞迁移加速、粥样斑块形成加速、胆固醇样物质沉积和血管硬化[13],并通过释放溶酶体酶而对脑血管病变进展起促进作用。脑出血发生时,MIF的活性激活,增强神经细胞的炎性环境程度[14]。本文对脑出血患者入院后不同时间点的血清MIF含量进行检测,发现脑出血发病后血清MIF含量先上升后下降,在发病5天时达到高峰,并显著高于健康组,且Pearson相关分析显示血清MIF与出血量大小、病情严重程度呈显著正相关,提示脑出血患者血清MIF的表达可一定程度上对病情程度和预后进行预测。
HMGB-1广泛存在于各种组织和器官中,脑出血患者神经受损,坏死的细胞组织的细胞膜会被损坏,导致细胞内的HMGB-1向胞外释放。HMGB-1具有多种作用,可参与机体炎症反应[15]。有研究发现,脑出血过程中给予HMGB-1抗体治疗,可抑制HMGB-1释放,改善脑水肿。本研究发现,与健康者比较,脑出血发病后,血清HMGB-1水平有明显升高的趋势,且其含量与出血量、病情严重程度呈正相关,提示血清HMGB-1可作为脑出血严重程度及预后预测的重要指标。
有研究发现,神经细胞、血管内皮细胞等在缺血、缺氧等情况下可合成更多的MMP-9,高水平的MMP-9在应激状态下能破坏细胞外基质(ECM),损伤血-脑屏障,继而导致血管源性水肿的发生[16]。TIMP-1是MMP-9的内源性抑制剂,在机体应激状态下呈高表达,通过结合MMP-9而抑制蛋白酶的活性,进而减轻血脑屏障的损伤[17]。本研究结果显示,脑出血组患者不同时间点血清TIMP-1含量均显著高于健康组,血清TIMP-1含量在脑出血发病后逐渐升高,在发病5天后达到高峰。本研究结果还发现,脑出血24h时,出血量大的患者血清TIMP-1水平最高,显著高于中量和少量出血者;血清TIMP-1水平与出血量多少、病情严重程度均呈正相关。推测可能是因为脑血肿对病灶周围组织血管产生压迫,减少局部血流量,引起组织缺氧而产生炎症反应,使MMP-9表达升高,进而正反馈调节TIMP-1的表达。本研究对脑出血预后的多因素Logistic回归分析结果显示,HMGB-1、MIF、TIMP-1、出血量、病情严重程度是预后不良的独立危险因素。
综上所述,血清HMGB-1、MIF和TIMP-1可作为脑出血预后额的独立危险因素,其联合检测对脑出血预后评估具有重要意义。

