兜兰萎蔫病病原菌的分离与鉴定
崔学强,李秀玲,范继征,邓杰玲,孙明艳,张自斌,黄昌艳,卜朝阳
(广西农业科学院花卉研究所,广西 南宁 530007)
【研究意义】兜兰(Paphiopedilum)又称拖鞋兰、仙履兰,是兰科(Orchidaceae)兜兰属植物的统称,隶属于杓兰亚科(Cypripedioideae),是兰科中较原始的类群,也是兰科植物中最具特色、最具经济价值和观赏价值的类群之一[1-3]。近年来,兜兰盆花以新奇特的审美成为花卉界新宠,其产业化规模也越来越大。但在兜兰资源保护与产业化发展过程中,兜兰萎蔫病(Paphiopedilumwilt disease)病害频发,使其观赏价值和商品价值极大降低,也严重影响兜兰野生资源的迁地保护及产业化发展进程,已成为兜兰产业健康发展的瓶颈,但目前有关兜兰萎蔫病的研究鲜有报道。因此,明确引起兜兰萎蔫病的病原菌,对研发有效防治药剂及促进兜兰产业的健康发展具有重要意义。【前人研究进展】兰花病害以真菌性病害为主,占兰花病害的2/3以上[4]。兜兰萎蔫病又称兰花萎蔫病[2],分布广,危害大,与兰花炭疽病和兰花黑腐病并称为危害兜兰的三大真菌性病害[5]。徐波等[6]明确了尖孢镰刀菌(Fusariumoxysporum)为兜兰茎腐病病原菌,并选出能抑制该病菌的8种有效杀菌剂。覃茜等[7]采用组织分离法对广西雅长兰科植物国家级自然保护区叶斑病兰花植株进行病原菌分离,根据形态学特征并结合多基因系统学对病原菌进行鉴定,发现兰花叶斑病的致病菌为镰刀菌。张志光等[8]开展兜兰立枯病病原菌及颉抗菌防治研究,发现立枯丝核菌是兜兰立枯病的主要病原菌,绿色木霉菌T8菌株对立枯丝核菌有明显的拮抗作用。徐波等[9]采用组织分离法对具有典型症状的兜兰炭疽病标本进行病原物分离培养,通过形态学观察和rDNA ITS序列分析对兜兰炭疽病病原菌进行鉴定,并开展兜兰炭疽病病原菌室内药剂筛选,明确了胶孢炭疽菌为兜兰炭疽病病原菌,并筛选出能抑制该病菌的4种有效杀菌剂。杨丽芬等[10]研究发现,胶孢炭疽菌是云南墨兰炭疽病的主要病原菌,该病原菌对兜兰具有一定的侵染性。焦鹏等[11]采用菌落直径法和孢子萌发法测定并比较6种杀菌剂对兰花枯萎病菌尖孢镰刀菌的室内抗菌活性,发现啶菌恶唑对菌丝生长和孢子萌发都有很强的抑制能力。连彩等[12]筛选出对兰花枯萎病病原菌尖孢镰刀菌具有较强拮抗作用的高效菌株3A3-15菌株,经鉴定该菌株为芽孢杆菌属(Bacillusvelezensis)。黄鹏等[13]选择6种杀菌剂对建兰茎腐病病原菌尖孢镰刀菌的毒力及联合作用进行分析,结果表明苯醚甲环唑+多菌灵和多菌灵+肟菌酯合理比例混配能较好防控建兰茎腐病的发生。姚锦爱等[14]开展建兰茎腐病病原菌尖孢镰刀菌生物学特性研究,发现不同地域或兰科寄主植物上尖孢镰刀菌的生物学特性存在一定差异,建兰茎腐病病原菌尖孢镰刀菌受温度影响较明显,35 ℃以上高温和15 ℃以下低温对病原菌生长、产孢和孢子萌发具有明显抑制作用。【本研究切入点】本研究课题组前期对兜兰种植基地病害的调查发现,兜兰萎蔫病是兜兰生产中发生较严重的病害,而目前关于兜兰萎蔫病的研究鲜见报道。【拟解决的关键问题】分析兜兰萎蔫病发病原因和发病规律,并进行病原菌分离鉴定,明确其致病菌,为兜兰萎蔫病的防控及兜兰产业的健康发展提供科学依据。
1 材料与方法
1.1 试验材料
试验于2018年1月至2019年12月在广西农业科学院进行。兜兰萎蔫病病害样本采集于广西农业科学院花卉研究所观赏植物研发推广中心的带叶兜兰、同色兜兰、紫纹兜兰、卷萼兜兰、亨利兜兰和长瓣兜兰发病植株。
1.2 试验方法
1.2.1 病原菌分离、培养与致病力测定 从温室采集具有兜兰萎蔫病典型症状的新鲜病叶,参考钱双宏等[15]的常规组织分离法分离和培养病原菌。产孢后进行单孢纯化,观察形态特征并根据孢子形态进行鉴定。参考钱双宏等[15]、江秀均等[16]的方法进行离体接种和活体接种培养,离体接种培养7 d后对比观察离体叶片的发病症状和田间症状,活体接种培养15 d后对比观察活体叶片的发病症状和田间症状,并从发病部位进行病原菌分离,观察孢子的形态特征。
1.2.2 病原菌的形态学鉴定和rDNA-ITS序列分子鉴定 参考钱双宏等[15]的方法,待培养的病原菌产孢后进行单孢纯化,并参照陆家云[17]的方法进行病原菌形态学鉴定。参照陈吉良等[18]的方法提取病原真菌DNA。引物为通用的真菌引物ITS1和ITS4。PCR反应体系20 μl:2×TaqPCR Master Mix 10 μl,ITS1和ITS4各1 μl,DNA模板1 μl,ddH2O 7 μl。扩增程序:94 ℃预变性4 min;94 ℃ 1 min,54 ℃ 45 s,72 ℃ 1 min,进行35个循环;72 ℃延伸10 min。对PCR产物进行琼脂糖凝胶电泳检测,回收目的片段,并进行连接转化,选取阳性克隆送至生工生物工程(上海)有限公司进行测序,将测序结果在NCBI上进行BLAST在线同源比对。
2 结果与分析
2.1 兜兰萎蔫病病害的症状
选取叶片情况、根系情况、整株状态和受感染力度4个指标对不同种类兜兰萎蔫病发病情况进行统计,评价不同种类兜兰受萎蔫病的影响程度。由表1可知,紫纹兜兰、卷萼兜兰和亨利兜兰受萎蔫病影响较严重,其中,发病的紫纹兜兰整株呈萎蔫状,叶表皮出现环状或带状的紫红色病变,根茎也被侵染变为紫红色,病情较严重时,基部叶片变黄腐烂,根茎也发生深度腐烂,导致植株枯萎死亡;卷萼兜兰和亨利兜兰的发病情况与紫纹兜兰相似,受感染叶片呈紫红色环状病变并扩展至整片叶片,同株其他叶片叶色变浅,呈严重失水状态,后期叶从基部断开,致使整株死亡;而带叶兜兰和同色兜兰受萎蔫病影响较轻,叶片呈现病变后扩展,受感染叶片呈萎蔫状,同株其他叶片受感染较轻,部分根系腐烂,其余根系尚好;长瓣兜兰具有较大的肉质叶片,受感染后叶片枯死,但其他叶片受影响较小,部分根系腐烂,整株状态尚可。

表1 不同种类兜兰萎蔫病的发病情况
2.2 病原菌的分离与培养
从兜兰萎蔫病病斑中分离到3株病原菌,分别命名为WY-1、WY-2和WY-3。从图1可看出,3株病原菌的菌落颜色存在明显差异,其中,WY-1菌株整个菌落均呈纯白色;WY-2菌株的菌落中间呈棕红色,边缘菌丝呈棕黄色,气生菌丝较另外2株菌株发达;WY-3菌株的菌落中间呈灰色,边缘菌丝呈白色。
2.3 病原菌的致病力测定
对分离到的3株菌株分别进行离体和活体接种,发现WY-1菌株和WY-3菌株均无发病症状产生,WY-2菌株接种后全部发病,因此,确定WY-2为引起兜兰萎蔫病的主要病原菌株。用离体接种(图2)和活体接种(图3)2种方法将纯化的WY-2菌株回接到健康兜兰植株叶片上,离体接种约5 d后离体叶片开始发病,活体植株叶片接种约15 d后开始发病,活体接种和离体接种症状均与田间自然发病症状相同。从发病叶片上再分离得到的菌株在PDA培养基上的培养特性与纯化菌株一致,镜检后观察到相同形态特征的分生孢子,表明所分离到的WY-2菌株为兜兰萎蔫病病原菌。

图1 兜兰萎蔫病病原菌的分离和培养结果

图2 离体接种WY-2菌株的兜兰叶片发病情况

图3 活体接种WY-2菌株的兜兰叶片发病情况
2.4 兜兰萎蔫病病原菌的形态学鉴定
观察发现,兜兰萎蔫病病原菌的气生菌丝生长茂盛,菌落初为棕红色,随着菌落的扩大,开始变为红色(图4-A),菌落正面颜色较浅,背面颜色较深。镜检观察到病原菌菌丝发达,分枝繁茂(图4-B),小型分生孢子数量多,单胞,卵形、椭圆形或卵圆形;中型孢子(图4-C)数量少,2~3分隔,多为2分隔,壁薄,镰刀形,较均匀地向两端逐渐收缩变尖,顶细胞稍呈钩状,孢子大小为31.4~46.8.2 μm×3.2~4.5 μm;大型孢子(图4-D)3~5分隔,多为4分隔,壁薄,镰刀形,较均匀地向两端逐渐收缩变尖,顶细胞稍呈钩状,孢子大小为43.8~56.4 μm×3.2~5.0 μm。
2.5 兜兰病原菌的rDNA-ITS序列分子鉴定
使用真菌通用引物ITS1/ITS4对致病性菌株的rDNA-ITS序列进行PCR扩增,扩增产物(图5)经测序,目的片段长度572 bp,将测序结果在NCBI上进行BLAST同源性比对,结果该菌株与镰刀孢属尖孢镰刀菌(Fusariumoxysporum)的相似性达99.0 %。
3 讨 论
镰孢菌属(Fusarium)真菌是常见的兰花病原真菌,常引起兰花叶斑病、花斑病、枯萎病、假茎或根腐病等[19]。尖孢镰刀菌隶属于镰孢菌属,其引起的枯萎病是一种世界性分布的土传维管束真菌病害,寄主范围广,可引起瓜类、茄科、香蕉、棉及花卉等100多种植物发生枯萎病,近年来兰花萎蔫病在云南、广东、广西、福建、浙江和安徽等地均有不同程度发生[6]。兜兰萎蔫病病原菌除危害兜兰外,还危害蝴蝶兰属、兰属、卡特兰属、石斛属和香荚兰属植物等[2]。本研究发现兜兰萎蔫病病原菌属于尖孢镰刀菌,与徐波等[6]的研究结果一致。
病原菌致病力测定是病害病原菌鉴定的重要环节,通过致病力测定可排除一些非致病菌株,减少后期工作量。本研究致病力测定采用离体接种和活体植株接种两种方法,其中,离体接种法具有操作简便、接种发病时期短、鉴定病原菌较快捷等优点,但由于离体接种脱离植物体,发病环境和条件有较大改变,会存在一定的测定误差,因而目前更多采用活体接种法进行致病力测定。而活体接种也存在接种发病周期长、鉴定等待期较长等缺点。本研究在致病力测定方面同时采用两种方法,测定结果准确可靠。

图4 兜兰萎蔫病病原菌的形态
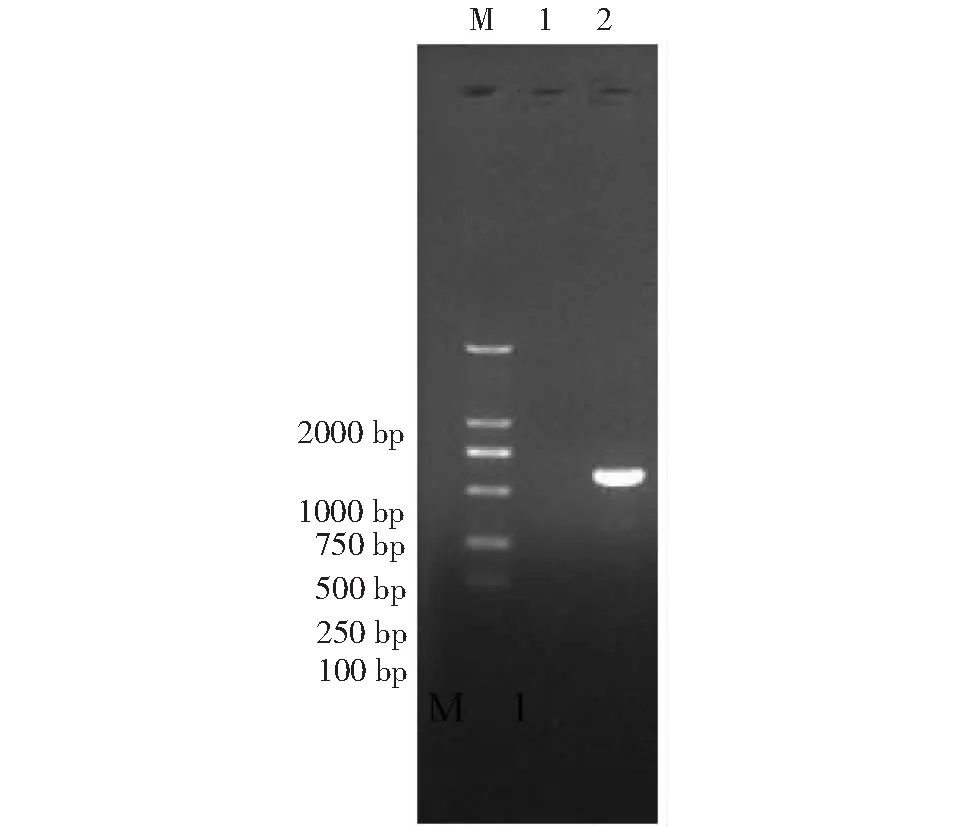
M:DL2000 DNA Marker;1:阴性对照(ddH2O);2:菌株PCR扩增产物
本研究结果表明,带叶兜兰、同色兜兰、紫纹兜兰、卷萼兜兰、亨利兜兰和长瓣兜兰因属性差异较大,其受萎蔫病的危害程度相差迥异。长瓣兜兰为广西分布的野生兜兰物种,具有肉质的叶片和强大的根系,在广西迁地保护的适应性较强[20],受萎蔫病影响较小;带叶兜兰和同色兜兰在广西也具有较广的分布区域,适应性较强[21],抗萎蔫病能力较强;紫纹兜兰和卷萼兜兰叶片较薄,根系相对较少,易受萎蔫病感染,感染后叶片颜色很快变淡、根系腐烂而致植株死亡。
已有研究表明,很多作物均会发生镰刀菌引起的病害,但目前对兰科植物镰刀菌的研究主要集中在病原菌分离鉴定及药剂筛选等方面[6-13],对其致病机理的研究鲜有报道,这将是兰科植物镰刀菌后期研究的主要方向。此外,针对病原进行生物学防治,研发有效拮抗菌药剂是主要途径,且目前已有在兰科植物应用生物抗菌剂[14,21-22]及针对其病原菌进行分子生物学研究[23]的报道。
4 结 论
依据兜兰萎蔫病病原菌的形态学和分子生物学特性,可确定其致病菌为尖孢镰刀菌;同时采用离体接种和活体植株接种法测定兜兰萎蔫病病原菌致病力具有较高的可靠性。

