HPV E6/E7 mRNA联合TCT检测在宫颈癌筛查的临床应用价值
秦 艳,朱 怡
(上海中医药大学附属第七人民医院妇产科,上海 200137)
宫颈癌是常见的妇科恶性肿瘤,高危型人乳头瘤病毒(human papillomavirus,HPV)持续感染是其发病的主要原因,早期开展高效筛查有助于预防癌前病变[1]。宫颈液基薄层细胞学检测(liquid-based cytology test,LBC或TCT)为宫颈癌筛查的重要手段,但其检测宫颈上皮内瘤变(CIN)2级以上病变的灵敏度及阳性预测值较低,漏诊率高。2016年宫颈癌筛查指南将HPV检测纳入宫颈癌筛查中,虽然能提高筛查的灵敏度、病变检出率,但特异度不足,在检出CIN2+同时也检出无临床意义的HPV感染,使阴道镜转诊与后续随访工作量增加[2]。宫颈癌筛查目的在于检出疾病而非HPV感染,而E6/E7转录及翻译是高危型HPV感染导致宫颈上皮细胞恶性转化的必经之路,因此检测E6/E7较检测HPV DNA有更高的准确性及临床意义[3]。本研究主要分析HPV E6/E7 mRNA联合TCT在上海高桥地区宫颈癌筛查中的应用价值。
1资料与方法
1.1临床资料
选取2017年1月至2018年12月在上海市第七人民医院妇科门诊行宫颈癌联合筛查的女性1 925例,纳入标准:①均有阴道分泌物增多、白带异常、宫颈糜烂、接触性出血、宫颈肿物等症状;②尚未接受系统治疗,知情同意取宫颈脱落细胞及宫颈活检组织进行检查;③24h内无性生活且无宫颈放射治疗史。排除标准:①因良性疾病需切除子宫;②有宫颈癌与癌前病变(包括CIN2级、CIN3级)史;③其他妇科恶性肿瘤;④人类免疫缺陷病毒(HIV)感染及器官移植。依据宫颈筛查方法分为:对照组(HPV DNA+TCT筛查)1 050例、观察组(高危型HPV E6/E7 mRNA+TCT筛查)875例。对照组年龄30~65岁,平均(47.18±4.96)岁;病程1~3个月,平均(2.41±0.26)个月。观察组年龄31~65岁,平均(47.12±4.99)岁;病程1~3个月,平均(2.46±0.23)个月。两组一般资料比较差异无统计学意义(均P>0.05),具有可比性。
1.2研究方法
受试者均同时留取TCT、HPV标本,取材前3d无阴道冲洗及阴道用药史。采集方法:①采用凯普宫颈细胞收集保存系统与去RNA酶宫颈细胞保存系统采集宫颈细胞标本各1份;②放置阴道扩张器,采用无菌棉球拭去宫颈分泌物;③将新柏氏液基细胞学(TCT)检测专用采样刷放置在宫颈鳞柱状上皮交界处,并顺时针旋转,旋转3~5圈后将采样器前端折断,放置在含专用细胞保存液的专用试管中,室温下保存待测。
1.2.2筛查方法
1.2.2.1 TCT筛查 采用膜式液基超薄细胞学和离心沉淀技术,对宫颈脱落细胞进行固定、染色,由检验科医师依据国际癌症协会推荐的Bethesda系统(The Bethesda System,TBS,2001年)进行宫颈细胞学诊断,包括:未见上皮内病变细胞或恶性细胞(NILM)、不能明确意义的非典型鳞状细胞(ASCUS)、不能除外上皮内高度病变的非典型鳞状细胞(ASCH)、鳞状上皮内低度病变(LSIL)、鳞状上皮内高度病变(HSIL)、鳞状细胞癌(SCC)[4]。
1.2.2.2 HPV E6/E7 mRNA检测 采用聚合酶链式反应(PCR)检测HPV E6/E7 mRNA(QuantiVirusTM,科蒂亚)水平,以导流杂交基因芯片技术(HybridMax,凯普)在TCT结果未知的情况下独立进行检测,可检测15种高危型HPV和7种低危型HPV。将待测标本离心弃去上清液,加入裂解液、蛋白酶K,恒温保存1.5h,取出标本振荡,加入96孔检测板,并设空白对照2孔、阳性质控2孔,经2种捕获探针捕获目的mRNA,采用3级信号放大,加底物及催化剂,进行病毒mRNA杂交,生成支链DNA(bDNA)复合物,以碱性磷酸酶标记的发光探针杂交到固相复合物上,采用突光检测仪检测标本发光值,按拷贝数进行计算,以相对发光强度(RLUs)比≥1诊断为HPV E6/E7 mRNA阳性。
1.2.2.3阴道镜检测 转诊阴道镜标准:细胞学≥ASCUS,统计时以TBS≥LSIL及ASCUS/HPV+为标准计算联合筛查的阴道镜转诊率,阴道镜由专职阴道镜医师操作。细胞学与HPV检测均呈阴性者认为无宫颈病变,不必接受阴道镜检查与活检。
1.2.2.4结果判读 由我院经验丰富的病理医师进行细胞学及组织病理学阅片,诊断意见不一致时另请2位高年资病理医师一起阅片,将≥2位病理医师的统一意见作为最终结果。活检结果采用Richart标准分级,分为正常、CIN1级、CIN2级、CIN3级/浸润性宫颈癌(invasive cervical cancer,ICC)。患者满意度评估:应用Zung氏焦虑自评量表系统评估患者焦虑程度,<60分提示无或轻度焦虑,为满意;≥60分提示中重度焦虑,为不满意[5]。
1.3统计学方法
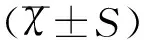
2结果
2.1两组筛查结果比较
观察组HPV E6/E7 mRNA初筛阳性率为31.09%(272/875),低于对照组HPV DNA初筛阳性率39.14%(411/1 050),χ2=13.535,P<0.01。
2.2不同Bethesda分类患者的HPV DNA及HPV E6/E7 mRNA阳性率比较
Bethesda分类中,NILM、LSIL、HSIL患者的HPV DNA阳性率高于HPV E6/E7 mRNA阳性率(P<0.01),且总体HPV DNA阳性率高于HPV E6/E7 mRNA阳性率(P<0.01),而在ASCUS、ASCH、SCC中HPV DNA阳性率与HPV E6/E7 mRNA阳性率比较差异无统计学意义(P>0.05),见表1。

表1 不同Bethesda分类患者的HPV DNA及HPV E6/E7 mRNA阳性率比较[n(%)]
2.3不同病理分级患者的HPV DNA及HPV E6/E7 mRNA检测结果比较
随着病理分级增加,HPV E6/E7 mRNA阳性率、HPV DNA阳性率及mRNA拷贝数上升(P<0.01),DNA拷贝数比较差异无统计学意义(P>0.05)。进一步两两比较结果显示:CIN3级/ICC患者HPV E6/E7 mRNA阳性率明显高于正常、CIN1级、CIN2级患者(χ2值分别为67.481、37.525、37.622,均P<0.05);CIN3级/ICC患者mRNA拷贝数明显高于正常、CIN1级、CIN2级患者(t值分别为117.88、36.503、24.238,均P<0.05);CIN3级/ICC患者HPV DNA阳性率明显高于正常、CIN1级、CIN2级患者(χ2值分别为84.864、78.233、87.488,均P<0.05)。CIN1级、CIN2级、CIN3级患者HPV DNA阳性率、HPV E6/E7 mRNA阳性率比较差异均无统计学意义(均P>0.05),见表2、表3。
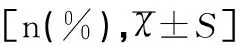
表2 观察组不同病理分级患者的HPV DNA检测结果比较
注:*P<0.05。
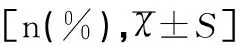
表3 对照组不同病理分级患者的HPV DNA检测结果比较
注:*P<0.05。
2.4两组阴道镜转诊率、满意度比较
观察组阴道镜转诊率低于对照组,患者满意度高于对照组(均P<0.01),见表4。
2.5不同检测方法的筛查价值比较
HPV E6/E7 mRNA联合TCT筛查的灵敏度、特异度、准确度分别为37.40%(181/484)、98.72%(386/391)、64.80%(567/875),HPV DNA联合TCT筛查的灵敏度、特异度、准确度分别为19.97%(116/581)、67.59%(317/469)、41.23%(433/1 050),见表5。HPV E6/E7 mRNA联合TCT筛查评估高级别宫颈上皮内瘤变(CIN分级2~3级)及宫颈癌的灵敏度、特异度、准确度高于HPV DNA联合TCT筛查(χ2值分别为39.894、138.474、106.147,均P<0.05)。

表4 两组阴道镜转诊率、患者满意度比较[n(%)]
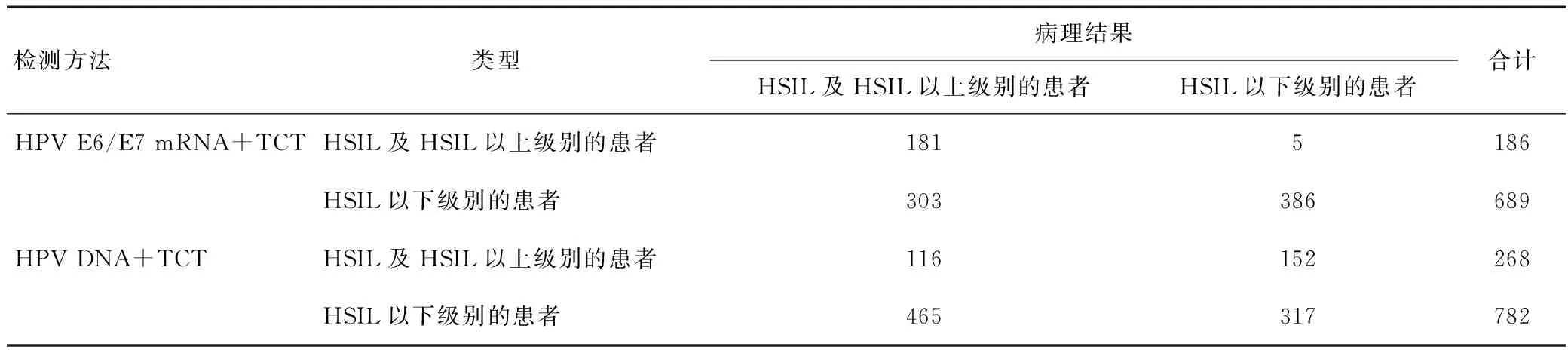
表5 两种不同检测方法的筛查价值比较(n)
3讨论
3.1宫颈癌的诊断及HPV E6/E7 mRNA应用前景
HPV感染是宫颈癌发生发展的重要因素,研究证实,HPV基因组早期区编码可干扰细胞周期调控的E6/E7癌蛋白,高危型HPV E6/E7是病毒致癌基因转录产物,参与宿主细胞靶向结合,其表达及转录数量直接决定着细胞恶性转化的可能性[6]。HPV E6/E7 mRNA作为有活性的癌基因在宫颈组织中表达,若癌基因无表达,则提示该癌基因无活性,不会发生癌变,因此可依据HPV E6/E7 mRNA的表达对宫颈上皮病变进展风险进行有效评估,以更准确地判断宫颈上皮内病变程度与预后[7]。
3.2 HPV DNA联合TCT筛查及HPV E6/E7 mRNA联合TCT筛查结果
本研究中,1 050例女性接受HPV DNA联合TCT筛查,875例接受HPV E6/E7 mRNA联合TCT筛查。结果显示,观察组中HPV E6/E7 mRNA初筛阳性率为31.09%(272/875),较对照组中HPV DNA初筛阳性率39.14%(411/1 050)低,与王娟等[8]报道的406例患者中,HPV DNA阳性率47.0%高于HPV E6/E7 mRNA检测阳性率31.2%的结果一致。当前HPV的分子诊断方法主要依赖于对HPV DNA标记物检测,HPV检测是病因学依据,但无法判断出其感染宫颈的具体阶段及癌基因活性程度,而相对来说,HPV E6/E7标记物则能表达癌基因在宫颈组织中的活性,E6蛋白会与P53蛋白、泛素连接酶结合而生成三聚体复合物,导致P53蛋白失去抑癌活性,E7蛋白则可调控多种蛋白并使细胞无限增殖、癌变,且E6、E7蛋白的共同表达可发挥协同作用,增强转化能力,使细胞过度增殖,最终引起宫颈癌的发生,因而HPV E6/E7 mRNA可作为一个评估宫颈癌风险的较好指标[9]。
3.3 HPV DNA及HPV E6/E7 mRNA阳性率与Bethesda分类的关系分析
本研究发现在Bethesda分类中,NILM、LSIL、HSIL患者的HPV DNA阳性率高于HPV E6/E7 mRNA阳性率,而总体HPV DNA阳性率也高于HPV E6/E7 mRNA阳性率,表明部分HPV感染患者尚未引起宿主细胞的病理改变。在诊断为ASCUS、ASCH、SCC患者中,HPV DNA阳性率与HPV E6/E7 mRNA阳性率比较差异无统计学意义(P>0.05),这与既往文献报道一致[10-11]。因此在筛查出ASCUS及以上患者中,两种方法检测效能相近。
3.4 HPV DNA及HPV E6/E7 mRNA检测结果与病理分级的关系分析
本研究也显示,随着病理分级增加,HPV E6/E7 mRNA阳性率、HPV DNA阳性率增加,且病理分级增加,mRNA拷贝数上升,而DNA拷贝数未发生明显变化,这与李剑等[12]的报道结果相似,提示HPV E6/E7 mRNA检测可能具有更高的敏感度,HPV基因与宫颈细胞基因整合是导致CIN转化为宫颈癌的重要原因,宿主感染HPV病毒后,因为HPV病毒过度表达E6/E7而引发免疫逃逸,促进正常细胞逐渐转化为癌细胞[13],且Sotirija等[14]的动物实验也发现HPV E6、E7蛋白过度表达会抑制抑癌基因表达而激活端粒酶,影响细胞周期的调控,使宫颈组织细胞增殖率上升,发生宫颈癌变。近期一项大规模Meta研究(44 477例)也发现,HPV E6/E7 mRNA检测在宫颈癌筛查中有较高价值,可作为宫颈癌病变启动监测指标,提早发现高级别病变,并进行临床干预[15]。
3.5 HPV E6/E7 mRNA联合TCT的筛查价值
本研究HPV E6/E7 mRNA联合TCT筛查评估高级别宫颈上皮内瘤变及宫颈癌的患者的灵敏度、特异度高于HPV DNA联合TCT筛查,与既往研究报道一致,且观察组阴道镜转诊率低于对照组,而患者满意度较对照组高,说明HPV E6/E7 mRNA联合TCT可能具有更高的筛查价值[16-17]。但两种检测方法的灵敏度仍较低,因此在筛查子宫颈癌中,细胞形态学低敏感性及HPV DNA标记物检测的低特异性均需要提高,采用更具有特异性的方法进行演算而非采用细胞形态学及HPV DNA检测,尤其对于年轻群体,可能选择HPV E6/E7 mRNA联合TCT具有更高的筛查价值,国外也有关于推荐采用HPV E6/E7 mRNA检测评估宫颈上皮内瘤变患者治疗后的复发风险的研究[18]。
综上所述,HPV E6/E7 mRNA联合TCT检测在高桥地区宫颈癌筛查中具有较高临床价值,未来可作为重要辅助检测手段。

