NHFOV治疗早产儿RDS的临床研究
王昌燕,赵 宏,蒋银萍,裴怀腾
(中国西电集团医院新生儿科,陕西 西安 710077)
呼吸窘迫综合征(respiratory distress syndrome,RDS)是早产儿中常见的危重并发症,发病率及病死率均较高,常需要呼吸支持[1]。美国和欧洲的相关指南都推荐早期应用无创通气模式治疗RDS可获得理想疗效[2-3]。目前常用的无创通气方式为经鼻持续气道正压通气(nasal continue positive airway pressure,NCPAP),但上述无创呼吸支持在肺部疾病较重时仍难以改善二氧化碳潴留,还需气管插管和有创呼吸机通气治疗[4]。无创高频振荡通气(noninvasive high-frequency oscillatory ventilation,NHFOV)是一种较新的无创通气模式[5],其通过鼻塞或鼻导管给予的气流产生连续正压,用超过生理通气的高频率振荡叠加在该压力之上实现有效的气体交换。NHFOV自1998年首次用于临床后逐渐受到推广,关于新生儿NHFOV的安全性和疗效仍需进一步深入研究[6]。本研究旨在探讨NHFOV治疗早产儿RDS的疗效及安全性,为临床合理决策提供依据。
1研究对象与方法
1.1研究对象
选择2017年1月至2019年3月在西电集团医院新生儿科诊治的RDS患儿,RDS的诊断参照《实用新生儿学》[7]标准:①有呼吸困难表现,包括气促、呼吸次数>60次/min,伴有呻吟、吸气性三凹征、且呼吸困难呈进行性加重;②胸部X线片提示RDS改变。按照2012版加拿大新生儿呼吸评分标准[8],选择入院初始呼吸评分为中或重度呼吸窘迫,无其它严重呼吸循环系统合并症的RDS患儿,排除评分为轻度呼吸窘迫、先天性心脏病、呼吸道畸形、消化道畸形及感染性疾病、活动性颅内出血等患儿。本次共纳入174例患儿,按随机数字表法分为NHFOV组和NCPAP组,各87例。研究获得本院伦理委员会批准和家属书面知情同意。
1.2方法
对所有RDS患儿在气管插管下以200mg/kg气管内滴入猪肺磷脂注射液(国药准字号:H20080429),拔出气管插管后继续经双侧鼻塞NHFOV(NHFOV组)或经双侧鼻塞NCPAP(NCPAP组)通气。NHFOV(型号:海伦-Leoniplus)参数初设:吸氧浓度30%~40%,平均气道压6~12cmH2O,频率6~12Hz,振幅是平均气道压的2~3倍,以看见下颌较好的振荡、胸片显示肺下界在第8~9后肋为宜。NCPAP(型号:stephon)参数初设:吸氧浓度30%~40%,呼气末正压6~8cmH2O,流量6~8L/min。未入选的患儿给予猪肺磷脂注射液后继续有创通气。有创通气指征:伴有频繁呼吸暂停、严重呼吸困难、无创呼吸支持1h后再次评估患儿临床症状及血气分析无改善者。根据血气分析和临床表现调整呼吸机各参数。两组患儿在呼吸支持的同时均给予改善循环、营养支持,维持体温、血压、血糖、电解质等内环境稳定。
无效:需使用有创机械通气,治疗1h后患儿的临床症状及体征(如呼吸困难、呻吟、紫绀、三凹征等)改善不明显或持续加重、出现呼吸暂停,动脉血气指标无明显好转或恶化;有效:临床症状减轻或缓解,动脉血气指标明显改善,趋向恢复正常水平,能够撤呼吸机。
主要观察指标:临床有效率和治疗前后动脉血气变化指标;次要指标:死亡率、有创通气持续时间、无创通气持续时间、第二剂肺表面活性剂(pulmonary surfactant,PS)的使用率、支气管肺发育不良及气漏、颅内出血(≥3级)并发症发生率。
ELISA试剂盒由美国R&D公司提供,严格按照说明书进行操作。采集两组患者治疗前及治疗后12、24、48h肘部静脉血1mL,置于采血管中,4℃环境中静置10min,以3 500r/min速度离心15min,收集上清液,使用酶联免疫吸附法进行检测SP-D和AQP-5的水平。
1.3统计学方法
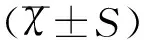
2结果
2.1两组的一般情况
两组患儿的性别、胎龄、出生体重、上机前血气分析参数、呼吸评分等方面比较差异均无统计学意义(均P>0.05),见表1。
2.2两组的临床疗效及并发症情况
NHFOV组的临床治疗有效率显著高于NCPAP组(P<0.05),NHFOV组的第二剂PS使用率显著低于NCPAP组(P<0.05),NHFOV组的无创通气时间显著低于NCPAP组(P<0.05);两组气漏、支气管肺发育不良、颅内出血(≥3级)发生率及死亡率比较差异均无统计学意义(均P>0.05),有创通气时间(治疗失败后改有创通气时间)比较,差异也无统计学意义(P>0.05),见表2。
2.3两组动脉血气指标在各时间点的情况
分别对两组各自PaO2、PaCO2、PaO2/FiO2、RI、pH指标在治疗前后的数据进行重复测量方差分析,结果显示两组中这些指标在治疗后均得到显著改善,治疗前后NCPAP组和NHFOV组各自组内比较差异均有统计学意义(均P<0.05);将上述指标按治疗后12、24、48、72h各时间点进行两组间比较显示:治疗前两组无显著性差异(均P>0.05),治疗后各时间点PaO2、PaO2/FiO2、pH水平NHFOV组均显著高于NCPAP组,差异均有统计学意义(P<0.05),治疗后各时间点PaCO2和RI水平NHFOV组均显著低于NCPAP组,差异均有统计学意义(均P<0.05),见表3。

表1 两组一般资料的比较结果
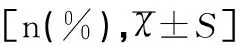
表2 两组临床疗效及并发症的比较结果
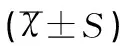
表3 两组各时间点动脉血气指标比较结果
2.4两组血清SP-D和AQP-5水平在各时间点的情况
分别对两组血清SP-D、AQP-5水平在治疗前后进行重复测量方差分析,结果显示治疗后两组均显著升高,差异均有统计学意义(均P<0.05);将SP-D、AQP-5水平按治疗后12、24、48、72h时间点进行两组间比较显示:治疗12h之内两组无显著性差异(均P>0.05),治疗12h后各时间点SP-D、AQP-5水平NHFOV组均显著低于NCPAP组,差异均有统计学意义(均P<0.05),见表4。
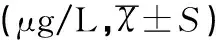
表4 两组各时间点血清SP-D和AQP-5水平的比较结果
3讨论
3.1 NHFOV治疗RDS的安全性和有效性
RDS是PS相对或绝对缺乏导致肺泡进行性萎陷而引起的[9],多见于早产儿、择期剖宫产及糖尿病母亲分娩的新生儿,少数见于足月儿,主要表现为生后数小时内出现进行性呼吸困难、呻吟、吸气性三凹征、青紫和呼吸衰竭,为新生儿期严重肺部疾病,如不及时有效治疗,病死率高达40%~60%,其是导致早期新生儿死亡的主要原因之一。有文献指出无创呼吸支持是解决早产儿呼吸问题的最优方法[10]。NHFOV为有创高频震荡通气的衍生模式,是一种全新的无创通气模式,除具有无创连接的优点外,还在改善通气、促进二氧化碳排出方面具有明显优势,且无需与自主呼吸同步,更因其小容量及低压力而显著降低肺损伤风险[11-12]。有研究发现NHFOV不但可以降低肺部炎症反应,促进肺泡发育,还可以降低无创通气吸气过程中喉部狭窄的发生率[13]。因此在理论上具有很好的临床应用前景,但其安全性和有效性仍需大量研究加以证实。
本研究结果显示,NHFOV组患儿在治疗后其肺换气及通气功能均优于NCPAP组,在治疗后12~72h,NHFOV组PaO2、PaO2/FiO2、pH均显著高于NCPAP组(均P<0.05);治疗12h后NHFOV组PaCO2、RI明显降低,且均显著低于NCPAP组,差异均具有统计学意义(均P<0.05),表明NHFOV较NCPAP具有更好的氧合性能,且促二氧化碳排出效果优于NCPAP。NHFOV组有效率明显高于NCPAP组,NHFOV组无创通气时间、第二剂PS使用率均明显低于NCPAP组,差异均具有统计学意义(均P<0.05),但有创通气时间无显著差异(P=0.65)。两组的气漏、支气管肺发育不良、颅内出血等并发症及死亡率方面并无显著差异(均P>0.05)。本研究结果说明在RDS治疗中,NHFOV较NCPAP改善肺部氧合和促进通气的临床疗效更佳,而并不增加并发症和死亡风险。
3.2 NHFOV对肺损伤的影响
SP-D是肺泡Ⅱ型细胞分泌产生的,能够识别且清除肺内的异物及凋亡细胞,并参与炎性反应调节,可反映肺泡损伤、肺泡Ⅰ型和Ⅱ型细胞损伤等。上述细胞受损时可使SP-D释放增多,肺泡上皮细胞及毛细血管通透性增加使SP-D进入血液增多,血清水平明显升高[14]。AQP-5在肺泡Ⅰ型上皮细胞、黏膜下的腺泡上皮细胞的顶膜区,对细胞内外水的分布有重要作用。AQP-5可维持细胞内外水的平衡,可调节肺脏的黏液,尤其是清除肺泡内的液体有重要作用,与肺水肿的形成有关,在肺泡Ⅰ型上皮细胞受损时AQP-5可被释放,血清水平增高[15]。本研究结果表明,两组的血清SP-D、AQP-5水平在治疗初期12h内差异不大,12h后NHFOV组明显低于NCPAP组,且差异均具有统计学意义(均P<0.05),说明NHFOV可降低肺损伤,分析可能与其平均气道压(mean airway pressure,MAP)较稳定,避免了肺泡过大起伏和低容量、低压力产生较小的肺泡剪切力有关。
综上所述,NHFOV治疗早产儿RDS具有很好的安全性,较NCPAP具有更佳的改善氧合、促进通气效应,降低肺损伤风险,且不增加相关并发症风险。对NHFOV的临床研究中均未见报道气胸和颅内出血等严重并发症,尽管研究对象中甚至包括一部分超低体重早产儿[16-18],这一点与本研究结果一致,因此值得临床推广。
3.3本研究的不足之处
本研究样本量较小,为单中心研究,而且NHFOV仅与NCPAP进行了比较,未涉及其他无创或有创通气模式,因此关于NHFOV临床应用的疗效及安全性仍需大量多中心随机对照试验进行评估。

