乙二醇对阀冷系统6063铝合金的腐蚀影响
于志勇1,宋小宁1,程一杰1,冯礼奎1,洪灿飞1,杨 磊,朱志平
(1. 国网浙江省电力有限公司 电力科学研究院,杭州 310014; 2. 长沙理工大学 化学与生物工程学院,长沙 410014)
近年来,直流输电工程技术发展迅速,对我国经济的均衡发展起到了重要的促进作用。可控硅换流阀是直流输电工程的核心设备,其价值占换流站成套设备总价的22%~25%[1-2]。换流阀运行时通入大电流,会产生高热量,导致可控硅温度急剧上升,若无有效冷却,可控硅将被烧毁,造成直流输电系统停运。工程上普遍采用双水冷对可控硅高温元件进行冷却,即内冷水冷却可控硅,外冷水冷却内冷水。阀冷系统的内冷水为除盐水,电导率≤0.5 μS/cm(正常控制在0.3 μS/cm以内),pH为7±0.2[3]。
在水中加入乙二醇可显著降低水的冰点,且不会改变水的电导率。通常通过在阀冷系统内冷水中加入乙二醇来降低其冰点,防止阀冷系统停运时内冷水结冰[4-5]。但乙二醇在使用过程中易酸化,逐步生成乙醇酸、乙二酸等物质,使阀冷系统(铝合金散热器)发生腐蚀[6]。同时,阀冷系统的内冷水路将阀塔内各个不同电位的水冷电抗器、水冷电阻及散热片连接起来,不同电位金属件之间的水路会产生电解电流,导致金属件发生电解腐蚀[7]。
阀冷系统散热器底座(6063铝合金)在长期运行过程中受乙二醇、电流的影响会发生腐蚀,导致内冷水回路中腐蚀产物增多,散热器管道堵塞,均压电极结垢,造成系统停运[8-9]。天广直流广州换流站、三常直流龙泉换流站以及宜宾-金华±800 kV直流输电工程金华换流站均出现过类似的问题,导致系统停运。目前,由阀冷系统故障导致的直流输电系统停运约占全年故障数的66%,阀冷系统的腐蚀与结垢问题是影响高压直流输电系统稳定运行的主要因素之一。
范金龙等[6]研究了3A21铝合金在乙二醇水溶液中的腐蚀行为,认为:乙二醇易发生氧化,氧化产物增强了溶液的腐蚀性并参与了3A21铝合金的腐蚀过程。金星等[10]研究了铝合金在乙二醇-水模拟冷却液中的腐蚀行为,结果表明:AA6061铝合金在乙二醇-水溶液中的初期腐蚀速率较低,随后腐蚀速率较高。但目前关于乙二醇、电流对6063铝合金散热器的腐蚀研究较少。
本工作通过失重法、电化学方法研究了6063铝合金在乙二醇溶液中的腐蚀特性。采用红外光谱分析腐蚀试验后乙二醇溶液的特征,利用电感耦合等离子光谱仪(ICP)检测试验后溶液中的铝离子含量,利用透反射金相显微镜、扫描电子显微镜(SEM)、能谱仪(EDS)对试样表面腐蚀产物进行分析,得到6063铝合金在乙二醇溶液中的腐蚀特性。
1 试验
1.1 试样的制备
试验材料为 6063铝合金,其化学成分(质量分数)为:0.45%~0.9% Mg,0.20%~0.60% Si,0.70% Fe,≤0.1% Cu,≤0.1% Mn,≤0.1% Zn,≤0.1% Ti,≤0.1% Cr,余量为Al。
1.2 浸泡腐蚀试验
将6063铝合金割成40 mm×13 mm×2 mm的试样。用除盐水(电导率≤0.1 μS/cm)配制体积分数分别为0%、10%、20%、40%的乙二醇溶液,作为腐蚀介质。在通10 mA直流电与不通电条件下,将试样全浸于腐蚀介质中,浸泡时间分别为5、10、15、20、25、30 d。根据换流站内冷水的典型工作温度,确定试验温度为(50±1) ℃。采用电子分析天平(精度为 0.1 mg)对腐蚀前后的6063铝合金试样进行称量。通过失重法计算腐蚀速率,如式(1)所示。
vcorr=Δw×87 600/(A·t·ρ)
(1)
式中:vcorr为试样的腐蚀速率,mm/a;Δw为试样腐蚀前后的质量差,g;A为试样的表面积,cm2;t为腐蚀时间,h;ρ为试样的密度,g/cm3。
使用AVATAR360型傅里叶变换红外光谱分析仪(FTIR)对试验后溶液中的基团进行检测,使用电感耦合等离子光谱仪(ICP)检测浸泡腐蚀后溶液中的铝离子含量。对试样进行清洗、干燥,采用透反射金相显微镜、场发射扫描电镜(SEM) 观察试样的微观腐蚀形貌,并用扫描电镜附带的能谱仪(EDS)分析腐蚀产物的化学成分。
1.3 电化学测试
电化学测试采用三电极体系,其中6063铝合金为工作电极,铂电极为辅助电极,Ag/AgCl电极为参比电极。将6063铝合金切割成10 mm×10 mm×2 mm的电极试样,在一端焊上导线,并用环氧树脂封装非工作面制作成工作电极。
试验介质为含NaCl的乙二醇腐蚀溶液,用40 mL乙二醇、50 mL 0.1 mol/L NaCl溶液及110 mL除盐水配制,试验温度控制在(50±1) ℃。
测试前,将铝合金电极在试验介质中浸泡0.5 h,以获得稳定的电位。电化学测试在CHI 660D型电化学工作站上进行,极化曲线扫描范围为-100~100 mV(相对于开路电位),扫描速率为1 mV/s;利用CHI 660D软件拟合并计算腐蚀电流密度(Jcorr),自腐蚀电位(Ecorr),阳极Tafel斜率(ba)和阴极Tafel斜率(bc)。电化学阻抗谱(EIS)测试的频率范围为10 mHz~100 kHz,交流信号幅度为±5 mV;然后,使用ZsimpWin软件对电化学阻抗谱进行拟合。
2 结果与讨论
2.1 浸泡腐蚀试验
2.1.1 腐蚀速率
由图1(a)可知,在除盐水中加入乙二醇后,6063铝合金的腐蚀速率明显增大,且随着乙二醇含量的增大,腐蚀速率增大,这说明乙二醇溶液中存在腐蚀性物质,并且乙二醇含量越高,腐蚀性物质含量越高,溶液的腐蚀性越强。由图1(b)可知,通入10 mA直流电流后,6063铝合金的腐蚀速率明显增大,其原因在于,电流会破坏铝合金表面的氧化膜,使铝合金基体与腐蚀溶液直接接触,从而加剧腐蚀。
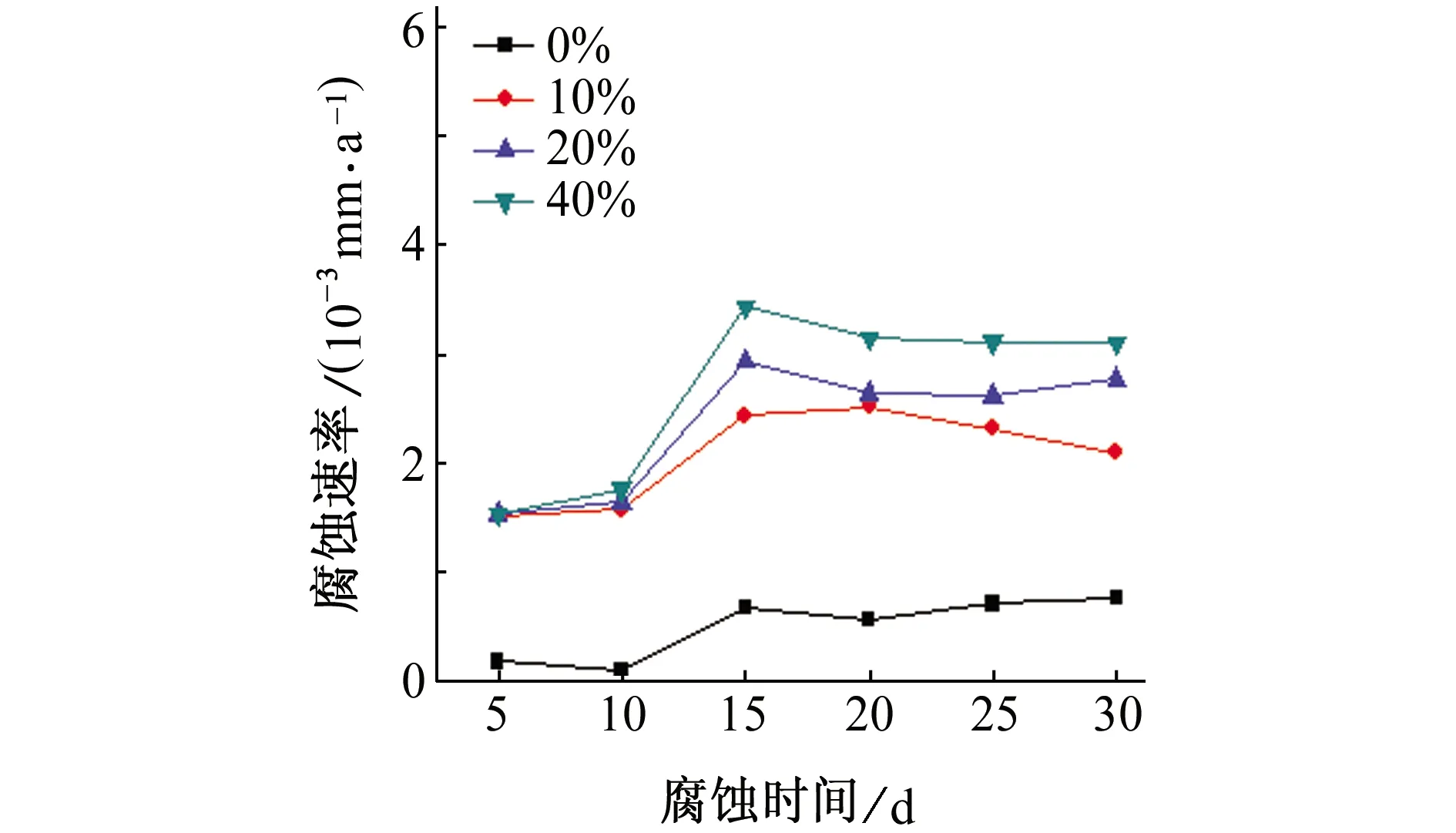
(a) 不通电
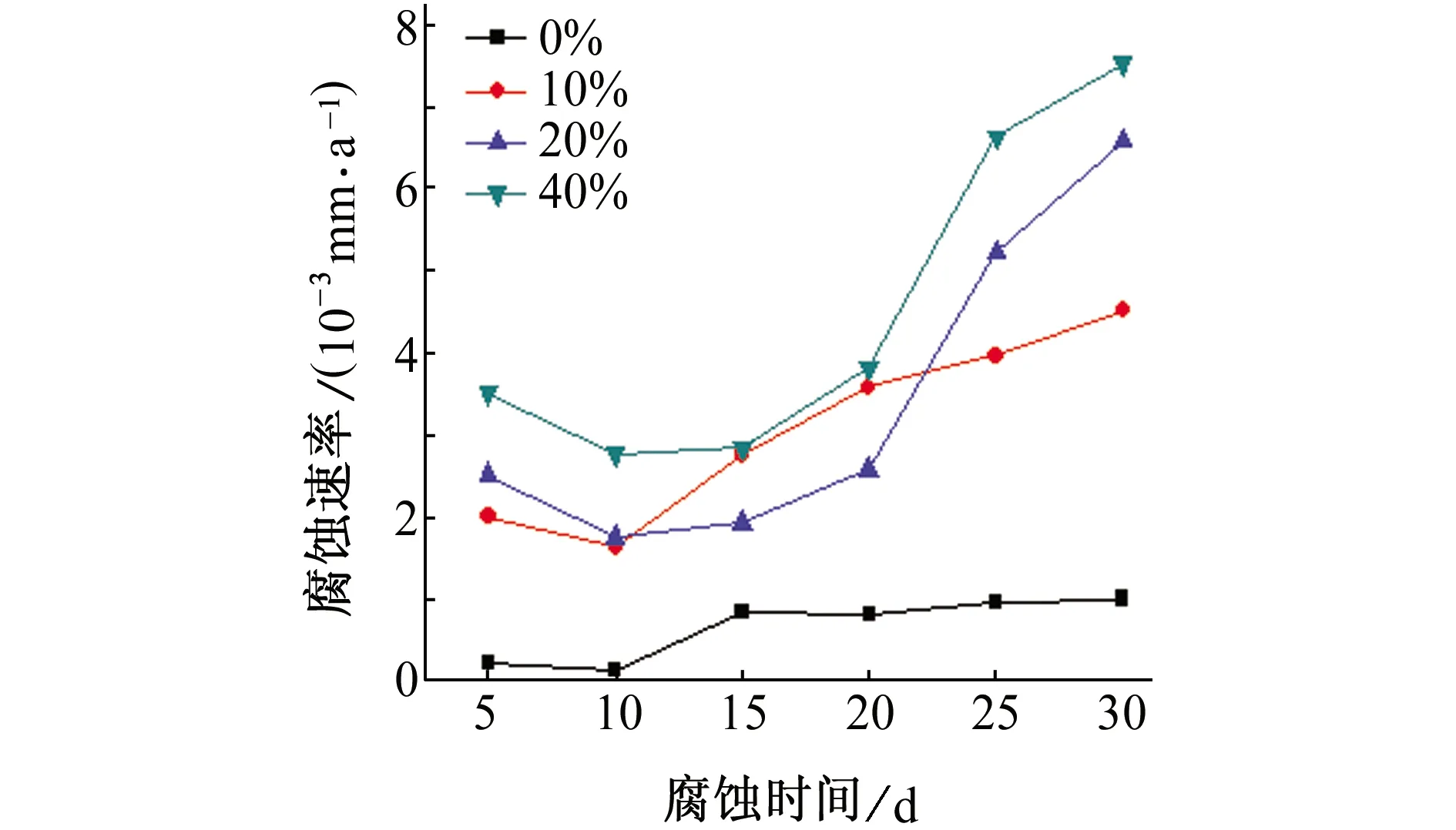
(b) 通10 mA直流电图1 不同通电情况下6063铝合金在不同含量乙二醇溶液中的腐蚀速率Fig. 1 Corrosion rates of 6063 aluminum alloy in ethylene glycol solution of different concentrations without current (a) and with 10 mA DC current (b)
2.1.2 红外光谱
由图2中可以看到,红外谱图中位于3 500~ 3 200 cm-1处的强宽吸收峰为醇羟基伸缩振动的特征吸收峰,位于1 610~1 550 cm-1处和1 420~1 300 cm-1处的吸收峰为羧基(-C=O)的特征吸收峰[11]。羧基(-C=O)的出现,说明乙二醇中的羟基会被氧化形成羧基,生成乙醇酸、乙二酸等腐蚀性物质,其总反应见式(2)[12]。

COOH-COOH+2H2O
(2)
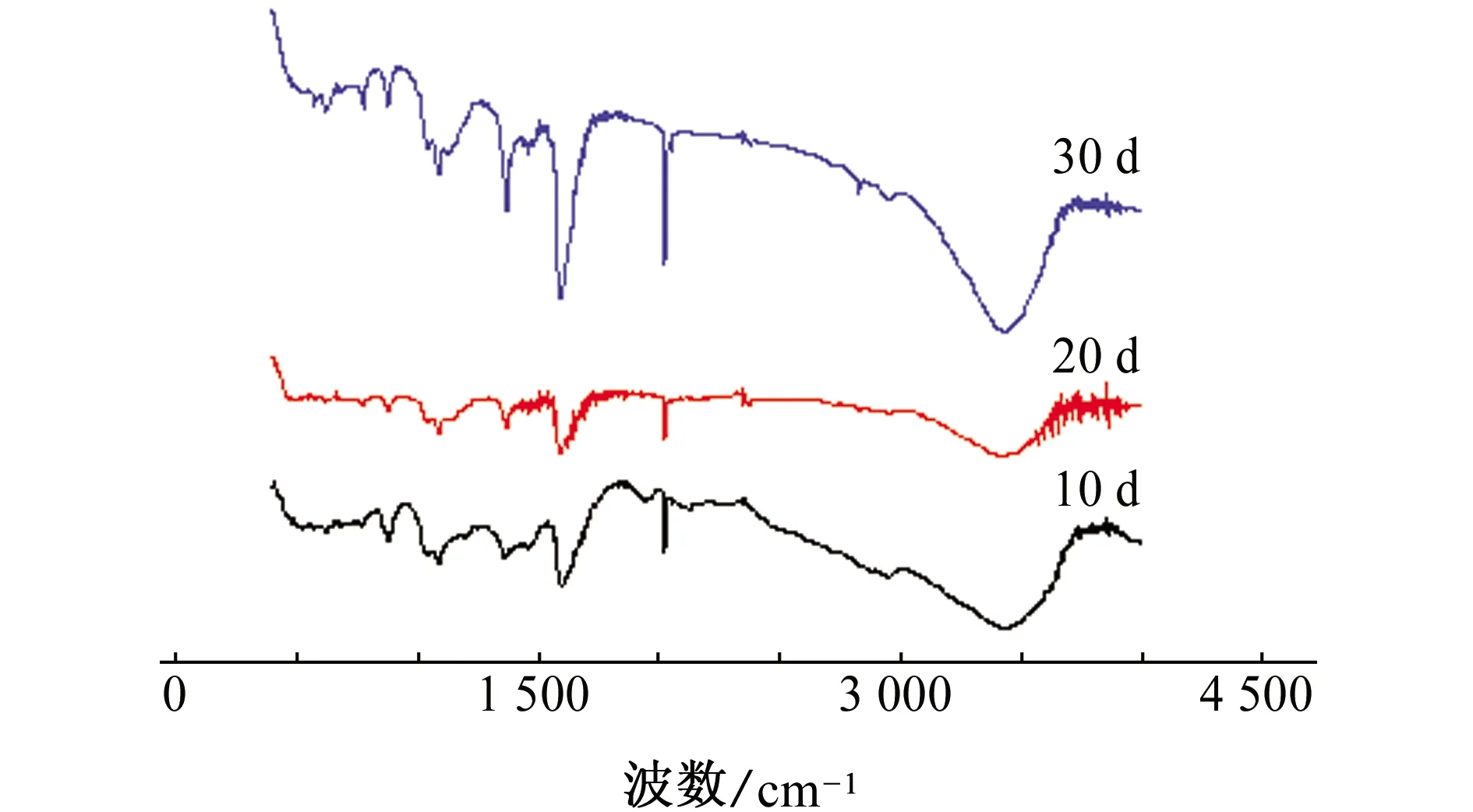
图2 腐蚀不同时间后20%乙二醇溶液的红外光谱Fig. 2 Infrared spectra of 20% ethylene glycol solution after corrosion for different periods of time
2.1.3 铝离子含量
由图3可见,乙二醇溶液中铝离子含量随腐蚀时间延长而明显增大,这表明6063铝合金试样在乙二醇溶液中均发生了较为严重的腐蚀;同时通10 mA直流电后,溶液中铝离子含量较不通电时的有大幅度提高,这说明直流电加速了6063铝合金试样在乙二醇溶液中的腐蚀。
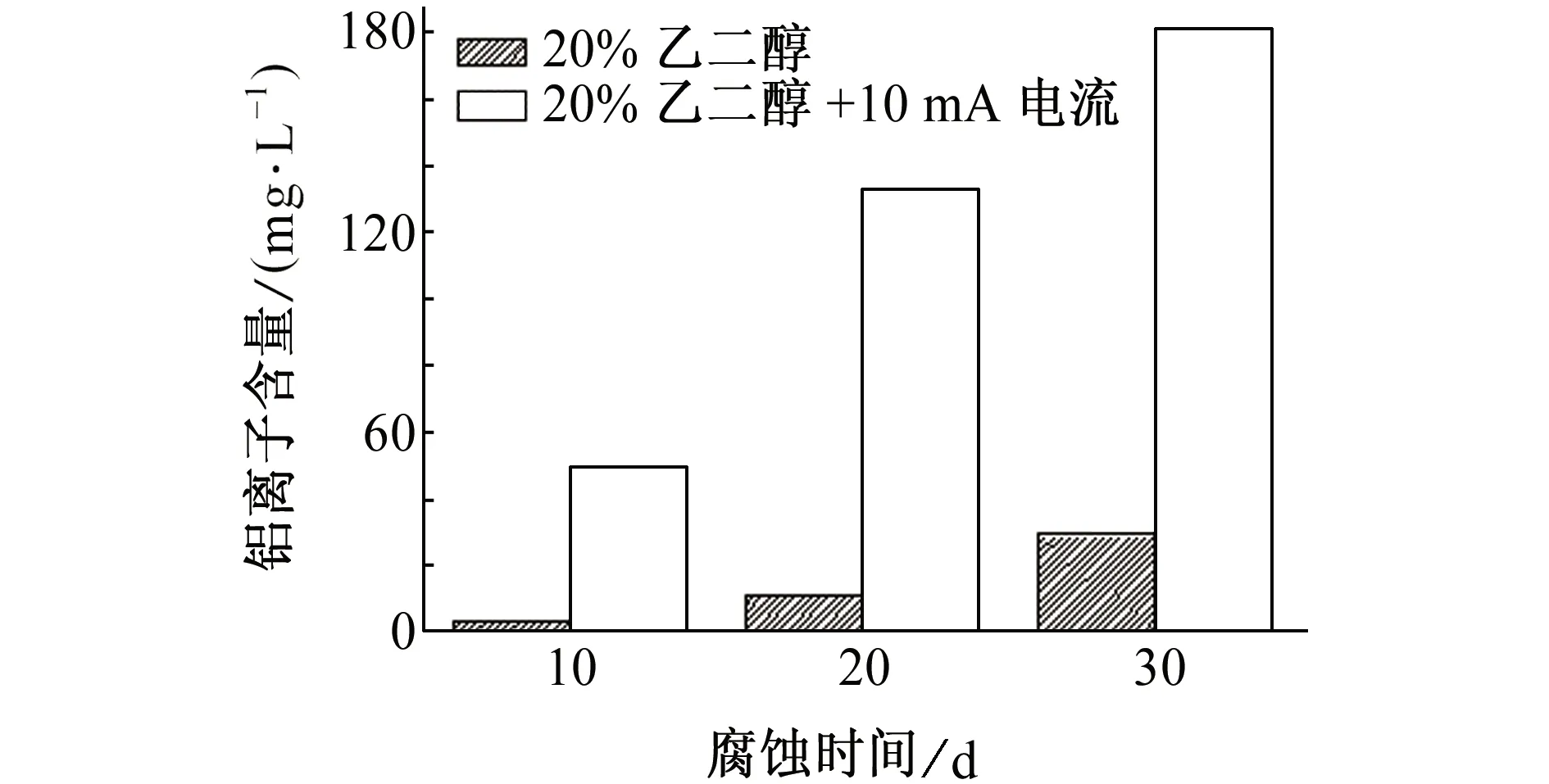
图3 腐蚀不同时间后20%乙二醇溶液中铝离子的含量Fig. 3 Aluminum ion content in 20% ethylene glycol solution after corrosion for different periods of time
2.2 电化学试验
2.2.1 极化曲线
从图4和表1可知,在含NaCl的乙二醇溶液中6063铝合金的自腐蚀电位较低,随着浸泡时间的延长,自腐蚀电位先降低后升高,腐蚀电流密度持续增大。
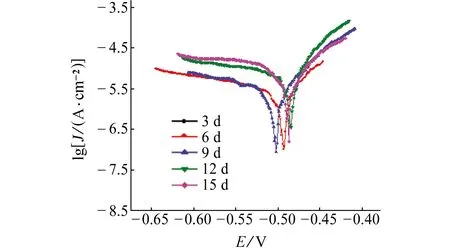
图4 6063铝合金在含NaCl的乙二醇溶液中浸泡不同时间时的极化曲线Fig. 4 Polarization curves of 6063 aluminum alloy immersed in ethylene glycol solution containing NaCl for different periods of time
浸泡初期,乙二醇分子黏性较大,可吸附到6063铝合金试样表面,对其起到一定的防护作用,腐蚀电流密度较小,腐蚀速率较低[4,10]。浸泡时间延长后,乙二醇分子被氧化,生成乙醇酸、乙二酸等腐蚀性物质[6],破坏试样表面的氧化膜,使局部区域产生电位差,试样表面附着腐蚀产物,腐蚀坑底充当腐蚀电池的阳极(小面积),而腐蚀坑口周围的钝化膜为阴极(大面积),坑底与坑口周围形成了小阳极/大阴极的活化-钝化电池[13],加速腐蚀反应的进行。随着腐蚀时间的进一步延长,6063铝合金试样表面附着的腐蚀产物增多,覆盖于试样表面,阻碍了乙二醇溶液与铝合金基体的接触,导致自腐蚀电位升高,但是由于活化-钝化电池的影响,二次相颗粒与铝合金基体之间的微电偶耦合作用增强[14],以及乙醇酸、乙二酸等物质的增多增强了溶液的腐蚀性,导致腐蚀电流密度增大,腐蚀速率加快。
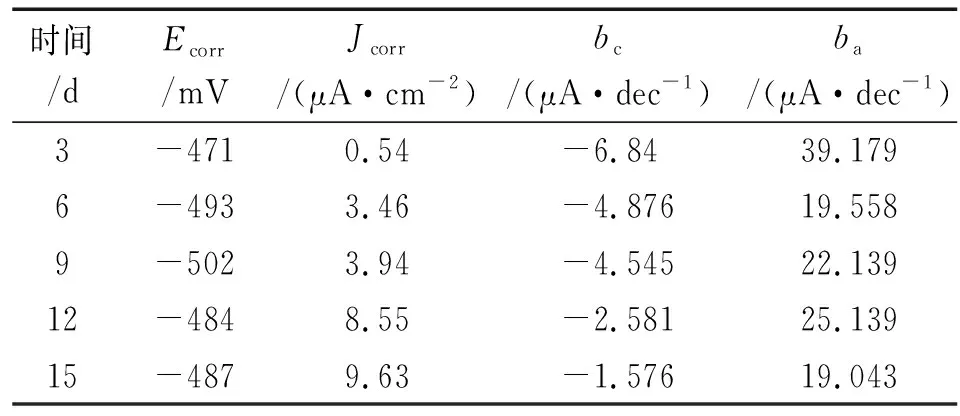
表1 6063铝合金在含NaCl的乙二醇溶液中极化曲线的拟合电化学参数Tab. 1 Electrochemical parameters fitted from the polarization curves of 6063 aluminum alloy in ethylene glycol solution containing NaCl
2.2.2 电化学阻抗谱
图5为6063铝合金在含NaCl的乙二醇溶液中浸泡不同时间时的电化学阻抗谱。图6为电化学阻抗谱对应的等效电路图。其中,浸泡时间为3、6、9 d的电化学阻抗谱对应于图6(a)所示等效电路;浸泡时间超过9 d以后(12 d、15 d)金属表面氧化膜受到破坏,生成的腐蚀产物不再具有保护性,孔蚀增多,适用图6(b)所示等效电路。
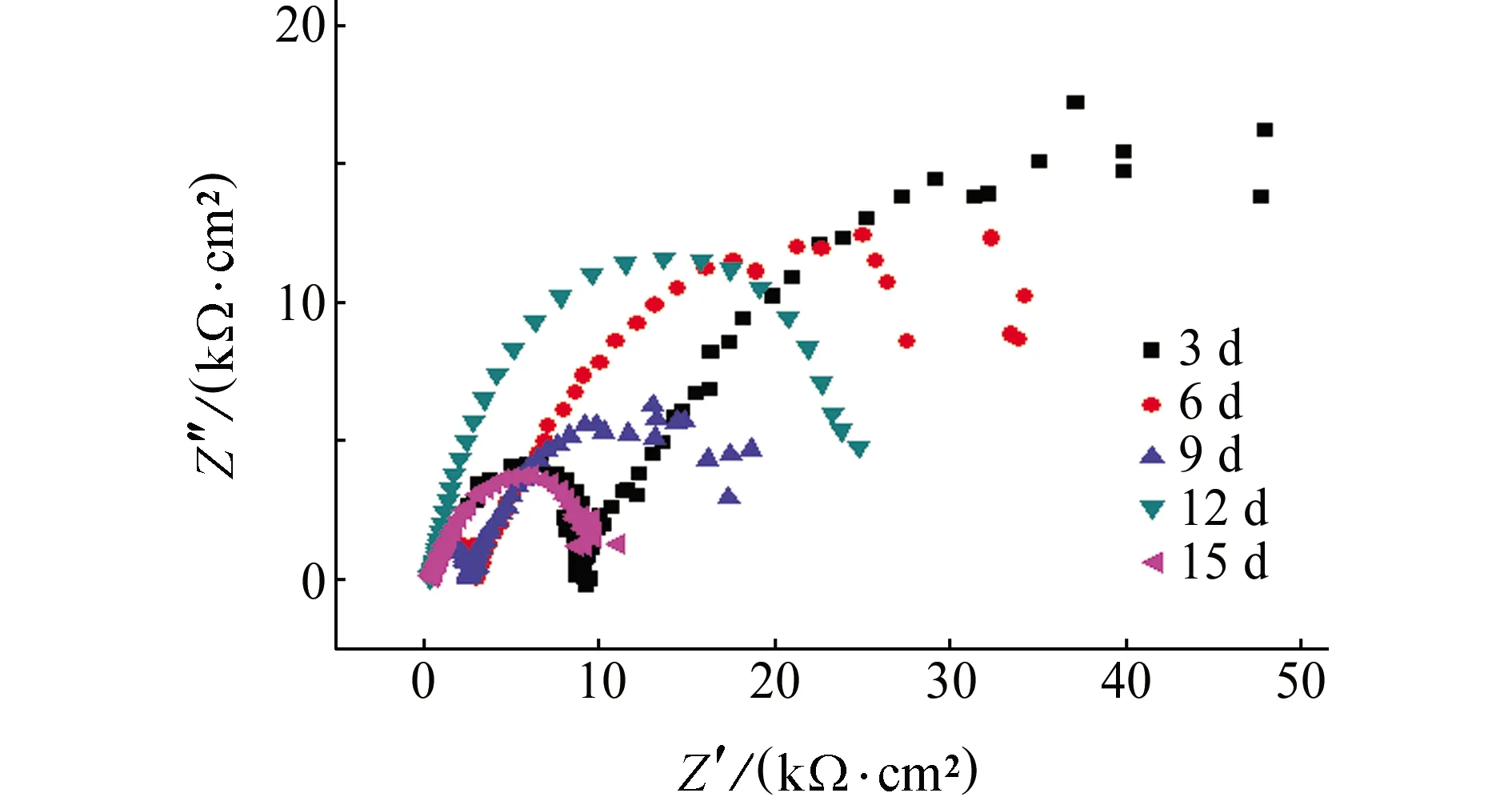
图5 6063铝合金在含NaCl的乙二醇溶液中浸泡不同时间时的电化学阻抗谱Fig. 5 EIS of 6063 aluminum alloy immersed in ethylene glycol solution containing NaCl for different periods of time
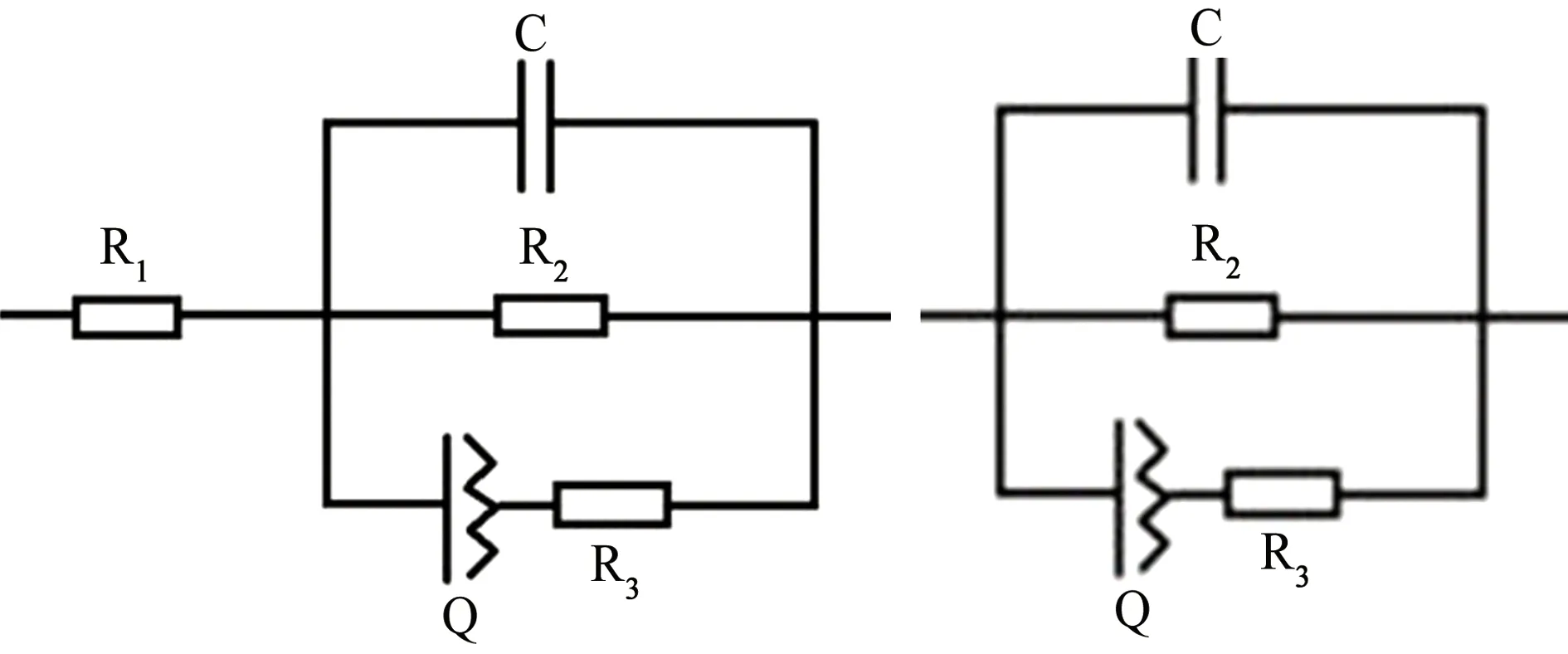
(a) 3、6、9 d (b) 12、15 d图6 6063铝合金在含NaCl的乙二醇溶液中浸泡不同时间时电化学阻抗谱对应的等效电路图Fig. 6 Equivalent circuit diagrams of EIS for 6063 aluminum alloy immersed in ethylene glycol solution containing NaCl for different periods of time
等效电路图中各等效元件为溶液电阻R1,膜层与溶液之间的双电层电容C,膜层与溶液之间的电荷传递电阻R2,膜层与基体之间的双层电容(常采用常相位元件Q代表,反映电极反应过程中电荷穿过电极表面和电解质溶液之间两相界面转移过程的难易程度[15-17]),金属基体和膜层之间的电荷转移电阻R3。电化学阻抗谱中没有出现Warburg阻抗,表明电极反应过程中没有氧浓差与扩散,高、低频区都由电化学反应控制[18-20]。表2为拟合得到各等效元件表示的电化学参数。

表2 6063铝合金在含NaCl的乙二醇溶液中电化学阻抗谱的拟合结果Tab. 2 Fitted results of EIS for 6063 aluminum alloy immersed in ethylene glycol solution containing NaCl
由电化学阻抗谱可知,浸泡3、6、9 d时6063铝合金的阻抗谱都由高频区和低频区两段容抗弧组成,而浸泡12 d和15 d时6063铝合金的阻抗谱由单一的高频区容抗弧组成,低频区的容抗弧消失。这是由于浸泡初期,乙二醇分子的吸附导致电荷转移电阻较大,阻挡了铝合金基体与腐蚀溶液之间的电荷转移,保护铝合金基体免受腐蚀;随着溶液中乙二醇被氧化及腐蚀性物质生成,溶液的腐蚀性增强,氧化膜受到破坏,形成的膜不再具有保护性,电荷转移电阻减小,电容值变大,腐蚀更容易进行,并且铝合金试样表面的孔蚀发展倾向变大,孔蚀愈加严重。
由表2数据可知,随浸泡时间的延长,R1和R3的值呈减小趋势,说明溶液中腐蚀性物质增多,与氧化膜反应,将其破坏,电荷传递过程更容易进行,材料的耐蚀性也变差。同时,浸泡的前9 d,Q值呈现波动状态,说明氧化膜在生成的同时会发生溶解,短时间浸泡过程中氧化膜的溶解和生成处于动态平衡;浸泡时间超过9 d后,Q值减小,说明氧化膜的溶解速率大于其生成速率,导致铝合金的腐蚀程度加重。
2.3 腐蚀产物分析
图7为在20%乙二醇溶液中浸泡20 d后6063铝合金的表面SEM形貌和EDS谱。结果表明,腐蚀产物中的元素主要为C、O、Al,二次相颗粒主要为Mg、Si(Mg2Si)。腐蚀产物中含有C,而溶液中仅乙二醇及其氧化产物中含有C,这说明乙二醇及其氧化产物参与了铝合金的腐蚀过程[21-22]。腐蚀破坏了铝合金表面的氧化膜,形成结构疏松的腐蚀产物,疏松的腐蚀产物无法抑制腐蚀,因此随着浸泡时间的延长,铝合金腐蚀会加重。此外,乙二醇逐步被氧化形成乙醇酸、乙二酸等物质,这些物质的形成增强了乙二醇溶液的腐蚀性[6],加速了铝合金表面点蚀的形成与发展。
图8为6063铝合金在20%乙二醇溶液中浸泡不同时间后的表面形貌。由图8可知,6063铝合金试样表面有一定的缺陷,如小坑、划痕等。溶液中的腐蚀性物质在这些位置优先吸附、积聚,导致这些部位氧化膜的溶解速率相对较快。同时,腐蚀坑的形成与铝合金基体在二次相颗粒周围的活性点[23]和局部溶解有关,二次相颗粒与相邻铝基体之间形成微电偶耦合[13],铝合金基体作为阳极,优先溶解。随着时间的延长,溶液中腐蚀性物质增多,铝合金基体具有较高的溶解活性,基体的溶解活性越高,微电偶耦合作用越强,基体腐蚀越严重。
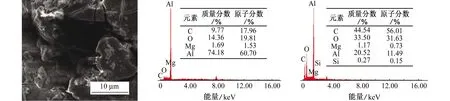
(a) SEM (b) EDS谱,蚀孔内 (c) EDS谱,蚀孔外图7 在20%乙二醇溶液中浸泡20 d后6063铝合金表面的SEM形貌与EDS谱Fig. 7 SEM morphology and EDS spectra of 6063 aluminum alloy immersed in 20% ethylene glycol solution for 20 d:(a) SEM morphology; (b) EDS spectrum, inside of pit; (c) EDS spectrum, outside of pit

(a) 5 d (b) 10 d (c) 15 d

(c) 20 d (d) 25 d (d) 30 d图8 6063铝合金在20%乙二醇溶液中浸泡不同时间后的表面形貌(200×)Fig. 8 Surface morphology of 6063 aluminum alloy immersed in 20% ethylene glycol solution for different periods of time (200×)
3 结论
(1) 乙二醇造成换流站阀冷系统6063铝合金腐蚀,并且腐蚀速率随着乙二醇含量的增大而增大;直流电的通入进一步加速了铝合金试样在乙二醇溶液中的腐蚀。
(2) 溶液中部分乙二醇会被氧化成乙醇酸、乙二酸等腐蚀性物质,增强溶液的腐蚀性,加速铝合金腐蚀。
(3) 乙二醇腐蚀介质通过破坏6063铝合金表面氧化膜形成活化-钝化电池加速腐蚀反应的进行,从而使腐蚀电流密度随浸泡时间延长而逐渐增大。

