盐酸左氧氟沙星片在健康人体内的药代动力学和生物等效性研究
刘灵晔,李 娟,曹 蓓,杨元勋,钱 薇
南京大学医学院附属鼓楼医院I期临床试验研究室,南京 210008
盐酸左氧氟沙星片属于喹诺酮类抗菌药,为氧氟沙星的左旋体,其抗菌活性约为氧氟沙星的两倍[1],它的主要作用机制为抑制细菌DNA旋转酶(细菌拓扑异构酶Ⅱ)的活性,阻碍细菌DNA复制。左氧氟沙星具有抗菌谱广、抗菌作用强的特点,适用于敏感病原菌所致泌尿道感染、前列腺炎、淋病、呼吸道感染以及革兰阴性杆菌所致各种感染及骨、关节、软组织的感染。
食物可能通过影响胃肠道的生理功能,从而改变药物的生物利用度,影响参比制剂和受试制剂的生物等效性。通常情况下,高热量、高脂肪食物更容易导致药物的生物利用度发生较大的改变。药物临床试验中常采用预期最大影响胃肠道生理功能的高脂食物,使药物受到的影响最大化,从而考察最敏感饮食条件下两制剂生物等效性的差异。根据《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》,本研究以盐酸左氧氟沙星片(乐朗®)为受试制剂,以左氧氟沙星片为参比制剂,分别考察在空腹以及进食高脂餐条件下的生物等效性评价,为临床用药的有效性和安全性提供依据。
1 材料与方法
1.1 药品与试剂
受试制剂:盐酸左氧氟沙星片(该药于2015年国内批准上市,每片500 mg,批号:170925JN,江苏恒瑞医药股份有限公司生产);参比制剂:左氧氟沙星片(商品名:可乐必妥®,每片500 mg,批号:BS064G1,第一三共制药(北京)有限公司生产);左氧氟沙星标准品(纯度97.3%,中国食品药品检定研究院);内标左氧氟沙星-d8(含量95.05%,Toronto Research Chemicals)。
乙睛、甲醇为色谱纯(Merck KGaA);醋酸铵和甲酸为分析纯(Sigma-Aldrich);水为去离子水。
1.2 仪器
岛津高效液相色谱-串联质谱仪(包括LC-30AD液相泵、CTO-20AC柱温箱、SIL-30ACMP自动进样器和AB Sciex TQ5500质谱仪)。Sartorius BP211D型电子天平(梅特勒-托利多公司)。
1.3 研究对象
空腹试验:24名健康志愿受试者,其中男性18名,女性6名,年龄平均(26.4±6.6)岁。餐后试验:24名健康志愿受试者,其中男性21名,女性3名,年龄平均(26.5±6.1)岁。所有受试者体质量指数(BMI)均在18~28 kg·m-2范围内。
受试者完全知情并签署知情同意书后,进行包括问诊(药物过敏史、既往病史、毒品史、吸烟史、饮酒史、献血史、用药史等)、人口资料学及生命体征、体格检查、12导联心电图、胸片、实验室检测(血生化、血常规、尿常规、凝血功能、传染病四项检查、女性血清/尿妊娠)、药物筛查、酒精呼吸测试等。当受试者各项检查结果均符合试验方案要求后方可入选。
1.4 试验设计
本研究采用单中心、开放、随机、单剂量、两周期、两序列、交叉试验设计。将空腹组和餐后组的受试者随机分为两组,在空腹或进食高脂高热量早餐(总热量800~1000千卡,其中约50%的热量来自于脂肪)后,分别服用受试制剂或参比制剂500 mg,用240 mL温开水送服。服药前及服药后1 h内禁止饮水,给药后4 h内禁食,4 h后进食统一标准餐。空腹试验于给药0 h(给药前2 h内)以及给药后0.25、0.5、0.75、1、1.25、1.5、1.75、2、2.5、3.5、6、8、12、24、36、48 h分别取静脉血4 mL;餐后试验于给药0 h(给药前2 h内)以及给药后0.5、1、1.5、2、2.25、2.5、2.75、3、3.5、4.5、6、8、12、24、36、48 h分别取静脉血4 mL(肝素抗凝)。两组均在2~8 ℃、离心力为2000 g条件下离心10 min,分离血浆,于-70 ℃冰箱中保存待测。1周后两组受试者交叉重复上述试验。
1.5 血药浓度测定方法
1.5.1 色谱条件 色谱柱:Poroshell 120 SB-C18(50 mm×2.1 mm,2.7 μm);流动相:含10 mmol·L-1醋酸铵和0.5%甲酸的水溶液-乙腈;流速:0.4 mL·min-1;柱温:40 ℃。
1.5.2 质谱条件 电喷雾离子化,正离子模式检测,离子化电压为2500V,温度为650℃,检测离子对质荷比为362.1/261.1和370.3/326.2,驻留时间为280ms。
1.5.3 血浆样品处理 精密吸取离心后的血浆50 μL,加入30 μL内标左氧氟沙星-d8溶液(0.5 μg·mL-1),振荡混匀,加入300 μL纯甲醇,涡旋10 min,4000r·min-1离心10min,取上清液50μL,加入400μL流动相溶液稀释进样。
1.6 数据处理
用Phoenix WinNonlin 6.4统计软件处理血药浓度数据,并计算参数。AUC0-t用梯形法计算;t1/2用药-时曲线末端相计算(0.693 t1/2/λz);tmax、Cmax用实测数值。相对生物利用度用AUC0-t(受试制剂)/AUC0-t(参比制剂)×100%估算。对AUC0-t、AUC0-∞、Cmax对数转换值进行方差分析和双单侧t检验及90%置信区间估计。tmax进行非参数检验(秩和检验),对两种制剂作出生物等效性评价。P<0.05认为有统计学意义。
2 结果
2.1 伦理审查
本研究严格遵守《赫尔辛基宣言》人体医学研究的伦理准则、CFDA颁布的《药物临床试验质量管理规范》、ICH/GCP以及国内法律法规的相应要求,并通过南京大学医学院附属鼓楼医院医学伦理委员审查。
2.2 方法学评价
本试验建立了人血浆中左氧氟沙星的HPLCMS/MS测定方法,选择性良好,血浆中内源性物质不干扰样品的测定;以左氧氟沙星峰面积和内标峰面积的比值f对血药浓度C作回归计算,得回归方程f=0.286 1×C+0.000 165 3,r2=0.999 6,权重系数w=1/C2,在0.100~10.0 μg·mL-1范围内线性关系良好,高、中、低三个浓度(7.50、3.00、0.250 μg·mL-1)的质控样品批内、批间精密度均不大于5.7%。左氧氟沙星血浆样品在室温、长期冻存及反复冻融条件下稳定性良好。
2.3 药-时曲线
24名健康受试者空腹单次口服受试制剂与参比制剂500 mg后,平均血药浓度-时间曲线见图1。该曲线表明,空腹试验受试制剂与参比制剂血药浓度随时间变化趋势相近。
24名健康受试者餐后单次口服受试制剂与参比制剂500 mg后,平均血药浓度-时间曲线见图2。该曲线表明,餐后试验受试制剂与参比制剂血药浓度随时间变化趋势相近。
2.4 药动学参数
以测得的左氧氟沙星血药浓度-时间数据,计算主要药动学参数。健康受试者单次口服受试制剂与参比制剂后的主要药动学参数见表1。
表1 健康受试者口服受试制剂与参比制剂后的主要药动学参数()
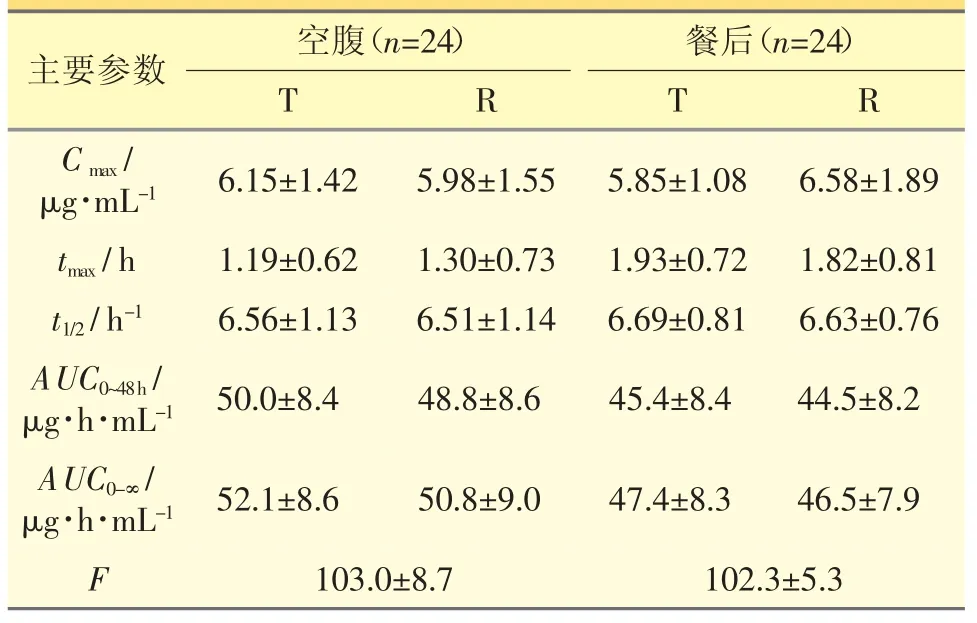
表1 健康受试者口服受试制剂与参比制剂后的主要药动学参数()
2.5 生物等效性评价
两制剂的AUC0~48h、AUC0-∞、Cmax经对数转换后,进行方差分析,结果显示,制剂间、周期间和个体间的差异无统计学意义;经双单侧t检验和90%置信区间分析,受试制剂的lnAUC0~48h、lnAUC0-∞和lnCmax均在参比制剂80%~125%范围内(表2),tmax进行非参数检验显示,制剂间差异无统计学意义(P>0.05),表明两种制剂具有生物等效性。

表2 双单侧t检验结果
2.6 安全性评价
在空腹试验研究中,24例受试者两周期间共有9例受试者发生10例次不良事件,其发生率为37.5%(9/24),其中与药物“很可能有关”4例次,“可能有关”1例次,“可能无关”5例次。发生的不良反应主要有丙氨酸氨基转移酶升高2例次、便尿胆原升高1例次、血胆红素升高1例次、贫血1例次。
在餐后试验研究中,24例受试者两周期间共有16例发生20例次不良事件,其发生率为66.67%(16/24)。其中与药物“很可能有关”3例次,与药物“可能有关”6例次,与药物“可能无关”11例次。发生的不良反应主要是尿中带血4例次、血尿2例次。
3 讨论
生物等效性试验是将仿制药的药学一致(质量)和治疗一致(有效和安全)与原研产品建立连接的关键[2]。在仿制生产已有国家标准药品时,可通过生物等效性研究来证明仿制产品与原研药是否具有生物等效性,是否可与原研药替换使用。左氧氟沙星由赛诺菲-安万特公司开发,商品名为“Tavanic”,国内无进口制剂、有进口本地化制剂上市,该剂为第一三共制药(北京)有限公司生产。该公司在亚洲的生产和销售权为原研公司赛诺菲授予,因此其左氧氟沙星片即是原研制剂,根据国家参比制剂遴选原则以及CFDA发布的仿制药参比制剂目录,可作为国内一致性评价的参比制剂。本研究考察了已上市盐酸左氧氟沙星片与左氧氟沙星片的相对生物利用度和生物等效性,表明江苏恒瑞医药股份有限公司生产的盐酸左氧氟沙星片与其参比制剂左氧氟沙星片具有治疗一致性,可为其临床用药的有效性和安全性提供参考。
目前在国内外针对盐酸左氧氟沙星的分析方法主要为高效液相色谱联合紫外检测器法[3-5],而本研究采用液相色谱串联质谱法(HPLC-MS/MS),具有更高的灵敏度、更好的选择性等优点。本方法采用稳定同位素标记的左氧氟沙星(左氧氟沙星-d8)作为内标,其与待测物左氧氟沙星有相似的理化性质,两者保留行为和离子化行为基本一致,可以避免基质效应、回收率等导致检测结果不可靠的情况出现。
通过对主要药动学参数比较,餐后组的tmax比空腹组的略长,AUC0~48h略低,但无统计学意义,主要药动学参数与文献报道一致[6-8]。
本研究入选的受试者全部纳入安全性评价,所有不良事件结果均为受试者痊愈或恢复至基线水平。试验中发生的不良事件与该药品说明书及既往研究报道的不良事件接近[9,10],且无严重不良事件发生、无因不良事件而退出试验的受试者。综上,本研究中所有受试者服用受试制剂与参比制剂后安全性和耐受性良好。

