IL-27通过STAT3信号通路改善脂多糖诱导的小鼠急性肺炎
巫霞,任妍,巫慧敏
(电子科技大学医学院附属妇女儿童医院成都市妇女儿童中心医院保健部,四川成都611731)
急性肺炎是一种常见的呼吸系统疾病,其发病机制复杂,具有发病迅速、发展速度快、不易治疗等特点,严重者可诱发心血管系统疾病,甚至危及生命[1]。急性肺损伤(acutelunginjury,ALI)是由多种原因引发的肺组织损伤,主要以肺组织炎症、氧化损伤、细胞凋亡等为病理特点。ALI是由全身炎症反应所导致的综合征,死亡率高达40%以上[2-3]。IL-27是近年发现的IL-12家族新成员,目前已经证明其在机体内具有双向免疫调节作用,既能促进某些疾病的发生、发展,又能抑制某些疾病的进展[4]。STAT3是在炎症和癌症中被激活的STAT蛋白家族的关键成员,其通过磷酸化从细胞质穿梭到核而被激活[5]。有研究发现,IL-27 可抑制博来霉素诱导肺纤维化的形成,提高小鼠的生存率[6]。然而,目前有关IL-27对脂多糖诱导的小鼠急性肺炎的影响研究甚少,因此,本研究探讨IL-27调控STAT3信号通路在脂多糖(lipopolysaccharide,LPS)诱导的小鼠急性肺炎中的作用及机制。
1 材料和方法
1.1 材料
1.1.1 实验动物:SPF级雄性小鼠共32只,6~8周,体质量18~22g,购自中国科学院昆明动物研究所,动物许可证号:SYXK(滇)2017-0009。
1.1.2 实验试剂:LPS(美国Sigma公司),IL-27重组蛋白注射剂、IL-27 蛋白重组抗体注射剂(美国Ebioscience公司),TRIzolReagent(美国Invitrogen公司),STAT3、SOCS3、GAPDH普通PCR上下游引物(上海生工公司),SYBRGreenPCRMasterMix(大连TaKaRa公司),RevertAidFirstStrandcDNASynthesisKit(美国ThermoScientific公司),RIPA裂解液(上海申能博彩生物科技有限公司),BCA蛋白浓度测定试剂盒(美国Thermo公司),STAT3兔抗鼠单抗、p-STAT3兔抗鼠单抗、SOCS3兔抗鼠单抗、TNF-α兔多克隆抗体、IL-1β兔多克隆抗体(美国Abcam公司),HRP标记山羊抗兔IgG(美国SantaCruzs公司),小鼠TNF-α、IL-1β、IL-10 和TGF-β1ELISA试剂盒(深圳欣博盛生物科技有限公司);其余试剂均为国产分析纯。
1.1.3 主要仪器:实时荧光定量PCR仪、电泳仪和转膜仪(美国Bio-Rad公司),Z216MK型冷冻离心机(德国HERMLE公司),摇床(TS-8)(上海精密仪器制造公司),化学发光成像系统(美国GE公司),脱水机、包埋机(武汉俊杰电子有限公司),石蜡切片机(上海徕卡仪器有限公司),正置光学显微镜、成像系统(日本尼康公司)。
1.2 方法
1.2.1 建立动物模型和分组:通过腹腔注射大肠杆菌LPS建立急性肺炎小鼠模型。32只小鼠随机分为4组,每组8只,分别为正常对照组、LPS组、LPS+IL-27组、LPS+IL-27抗体组。参考文献[7-8],LPS组:腹腔注射LPS(5mg/kg);正常对照组:腹腔注射与LPS等量的0.9%氯化钠溶液;LPS+IL-27组:在建模后腹腔注射IL-27(200mg/只);LPS+IL-27抗体组:在建模后腹腔注射IL-27抗体(200mg/只)。连续处理7d后麻醉处死观察。
1.2.2 HE染色法观察肺组织病理形态学:将肺组织用0.9%氯化钠溶液漂洗、滤纸吸干,放入4%多聚甲醛中固定48h,然后进行脱水、石蜡包埋、切片。将厚度为4μm的病理切片放置于65℃烘箱2h后,依次放入二甲苯10min,无水乙醇、95%乙醇、90%乙醇、85%乙醇、75%乙醇、50%乙醇各2min。苏木素、伊红染色。中性树脂封片,镜下观察。
1.2.3 Westernblot 法检测各组小鼠肺组织STAT3、p-STAT3、SOCS3的蛋白表达水平:取肺组织加入RIPA裂解液于冰上提取组织中总蛋白,采用BCA蛋白浓度测定试剂盒对蛋白进行定量。将蛋白样品与上样缓冲液混匀,沸水浴加热变性,取等量变性蛋白样品加入上样孔,SDS-PAGE凝胶电泳。待蛋白分离后转膜至PVDF膜上,在质量浓度为5%脱脂奶粉中封闭1h,TBST洗膜后加入一抗(1:2000稀释),4℃过夜杂交,TBST洗膜后再加入辣根过氧化物酶标记的二抗(1:3000稀释),室温杂交1h,TBST洗膜后以ECL化学发光,于暗室成像拍照,以GAPDH为内标蛋白,使用ImageJ分析软件计算各组STAT3、p-STAT3、SOCS3蛋白相对表达水平。
1.2.4 RT-PCR法检测各组小鼠肺组织和血清中STAT3、SOCS3mRNA表达水平:TRIzol法提取小鼠肺组织及血清中总RNA,反转录获得cDNA,以β-actin为内参,分别检测小鼠STAT3、SOCS3的mRNA表达水平。引物由深圳华大基因股份有限公司设计合成,引物序列:STAT3上游5’-CCAAGCGAGGACTGAGCATC-3’,下游5’-CCAGACCCAGAAGGAGAAGC-3’;SOCS3上游5’-CCAAGAACCTACGCATCAA-3’,下游5’-GCAGTCCAGGTGACCGTTG-3’;β-actin上游5’-TGGCACCCAGCACAATGAA-3’,下游5’-CTAAGTCATAGTCCGCCTAGAAGCA-3’。反应条件:95℃预变性5min;95℃变性10s,60℃退火30s,共40个循环。扩增完毕后进行熔解曲线分析,每个样本重复检测3次。各组STAT3、SOCS3基因的相对表达量按公式(2-△△Ct法)计算。
1.2.5 ELISA法分别检测肺组织及血清中TNF-α、IL-1β、IL-10、TGF-β1的表达水平:将肺组织置于玻璃匀浆器中,按体质量体积比1:9加入0.9%氯化钠溶液在冰浴中充分研磨,制成10%肺匀浆,然后10000r/min离心10min取上清液;采集小鼠外周血,2500r/min离心15min取上清液;采用ELISA法检测各组小鼠肺匀浆及血清中炎性细胞因子TNF-α、IL-1β和抗炎因子IL-10、TGF-β1的表达水平。
1.2.6 Westernblot法和免疫组织化学法检测肺组织中TNF-α、IL-1β表达水平:石蜡包埋,做厚度为5μm的切片。经二甲苯脱蜡、乙醇逐步水化后进行热抗原修复,3%过氧化氢灭活内源性过氧化物酶。滴加5%BSA封闭液,室温30min,用于去除内源性酶。滴加一抗,37℃孵育2h,弃去一抗后滴加二抗孵育30min。滴加DAB显色剂,5min,蒸馏水洗涤。脱水、透明、封片,切片至于显微镜下观察阳性细胞的表达。结果判定:TNF-α阳性染色为棕黄色或棕色;IL-1β阳性染色为深棕黄色。Westernblot法参照1.2.3。
1.3 统计学处理方法 采用SPSS24.0统计软件进行数据分析。正态分布计量资料以表示,采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠肺组织病理形态学比较 光镜下观察结果发现,正常对照组肺组织结构完整,肺泡腔清晰,肺间质内无炎性细胞浸润;LPS组肺泡结构被破坏,肺泡壁弥漫性增厚,有明显的炎性细胞浸润;LPS+IL-27组病理改变较LPS组明显减轻,炎性细胞浸润减少,而LPS+IL-27抗体组与LPS组比较肺组织病理改变没有明显改变,表明IL-27可改善LPS诱导的急性小鼠肺损伤。见图1。
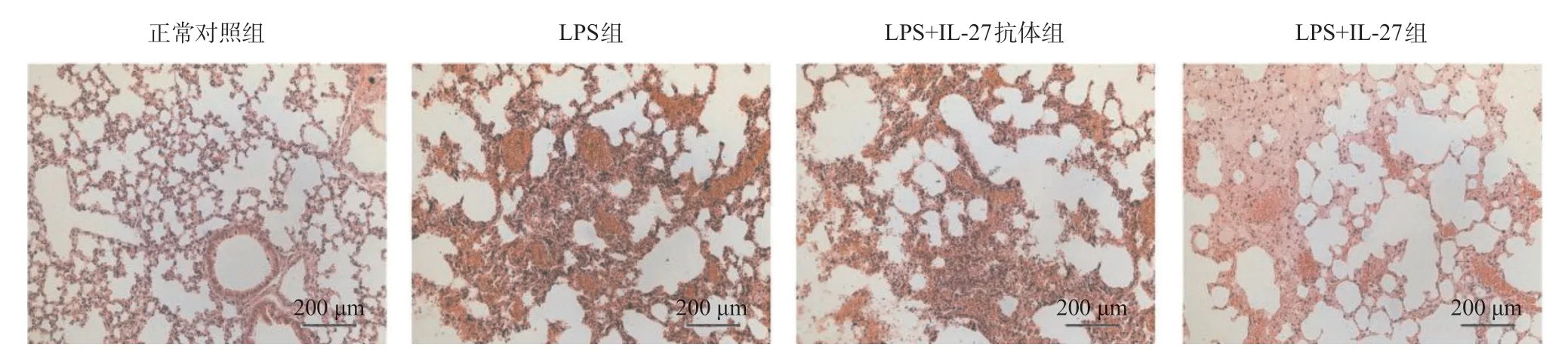
图1 各组小鼠肺组织病理形态学(HE染色)
2.2 各组小鼠肺组织STAT3、p-STAT3、SOCS3蛋白表达水平 与正常对照组相比,LPS组和LPS+IL-27抗体组小鼠肺组织STAT3、p-STAT3蛋白表达水平显著升高(P<0.05);LPS+IL-27组STAT3、p-STAT3蛋白表达水平较LPS组和LPS+IL-27抗体组显著降低(P<0.05);LPS组和LPS+IL-27抗体组SOCS3蛋白表达水平较正常对照组升高(P<0.05),而LPS+IL-27组SOCS3蛋白表达水平显著高于LPS组和LPS+IL-27抗体组(P<0.05)。见图2。

图2 各组小鼠肺组织STAT3、p-STAT3、SOCS3的蛋白表达水平
2.3 各组小鼠肺组织及血清中STAT3、SOCS3mRNA表达水平 与正常对照组相比,LPS组和LPS+IL-27抗体组小鼠肺组织及血清STAT3mRNA表达水平显著升高(P<0.05);LPS+IL-27组STAT3mRNA表达水平较LPS组和LPS+IL-27 抗体组显著降低(P <0.05);LPS组和LPS+IL-27抗体组SOCS3mRNA表达水平差异无统计学意义(P>0.05),而LPS+IL-27组SOCS3mRNA表达水平显著高于LPS+IL-27抗体组(P<0.05)。见图3。
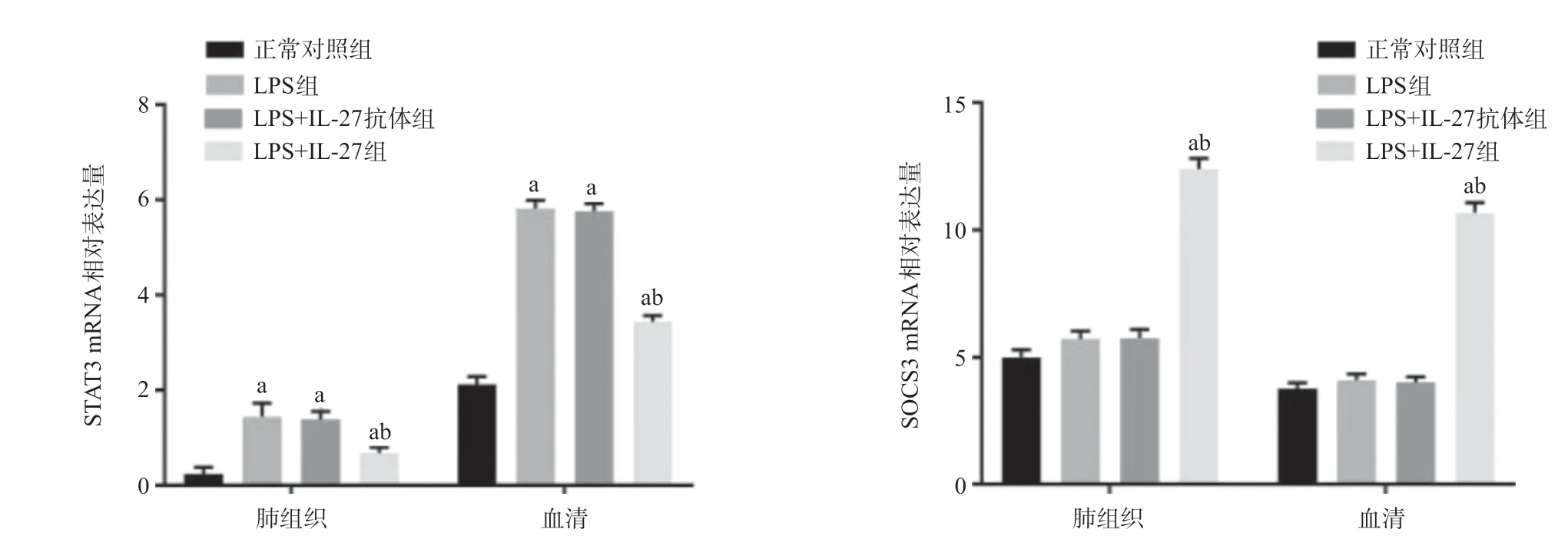
图3 各组小鼠肺组织与血清STAT3、SOCS3mRNA表达水平
2.4 各组小鼠肺组织及血清中TNF-α、IL-1β、IL-10、TGF-β1的表达水平 与正常对照组相比,LPS组、LPS+IL-27组和LPS+IL-27 抗体组小鼠肺组织及血清TNF-α、IL-1β表达水平均显著升高(P <0.05);LPS+IL-27组TNF-α、IL-1β表达水平较LPS组和LPS+IL-27抗体组显著降低(P<0.05);LPS组和LPS+IL-27抗体组IL-10表达水平均显著高于正常对照组(P<0.05),TGF-β1表达水平差异无统计学意义(P>0.05);而LPS+IL-27组IL-10、TGF-β1的表达水平均显著高于LPS+IL-27抗体组(P<0.05)。见图4。
2.5 各组小鼠肺组织中TNF-α、IL-1β蛋白表达水平 免疫组织化学结果显示,与正常对照组相比,LPS组和LPS+IL-27抗体组TNF-α阳性表达主要表达在细胞浆中,IL-1β阳性表达主要表达于细胞膜与细胞浆中,Westernblot结果发现TNF-α、IL-1β在肺组织中均呈高表达(P<0.05);LPS+IL-27组TNF-α、IL-1β的表达水平较LPS组和LPS+IL-27抗体组显著降低(P<0.05)。见图5-6。
3 讨论

图4 各组小鼠肺组织与血清TNF-α、IL-1β、IL-10、TGF-β1表达水平
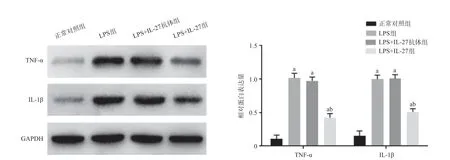
图6 各组小鼠肺组织TNF-α、IL-1β蛋白表达水平
ALI是由多种因素引起的肺泡毛细血管弥漫性与正常对照组比:aP <0.05;与LPS组和LPS+IL-27抗体组比:bP <0.05损伤,导致肺水肿和肺不张,临床表现为急性呼吸窘迫和难治性低氧血症,也是全身失控性炎症反应导致的多器官功能障碍综合征的肺部表现[9],常常由脓毒症、败血症等多种病因引起,是炎症自我放大及氧化损伤共同作用的结果[10]。LPS是引起ALI、脓毒症等重要致病因子,其促进大量炎症细胞因子产生,引起肺内中性粒细胞的聚集和激活,是LPS致ALI的主要机制[11]。本研究通过腹腔注射LPS诱导炎症反应模拟急性肺炎动物模型,是目前公认的研究急性肺炎的经典方法之一[1]。结果发现正常对照组肺组织结构完整、肺泡腔清晰,肺间质内无炎性细胞浸润;LPS组肺泡结构被破坏,肺泡壁弥漫性增厚,有明显的炎性细胞浸润。本研究还发现,LPS组小鼠肺组织及血清TNF-α、IL-1β、IL-10表达水平较正常对照组均显著升高,表明LPS可诱导急性肺炎小鼠组织及机体整体炎症水平升高。因此,抗炎治疗对LPS诱导的肺损伤具有保护作用[12]。
有研究报道,IL-27 可以明显减轻免疫炎症损伤和感染炎症损伤,从而减轻因各种损伤因子导致的肺部炎性反应[13]。GAN等[14]研究发现,过敏性鼻炎患者外周血中IL-27 表达的降低有助于Th2 炎症的上调,而且体外实验表明IL-27抑制PBMCs中的Th2炎症,IL-27可作为治疗过敏性鼻炎的潜在靶点。另有研究发现,IL-27 可能通过抑制STAT1 信号通路,下调GATA3的表达并上调T-bet的表达,从而促进Th1细胞分化,抑制Th2细胞分化,抑制机体的炎症反应,参与支气管哮喘的发生发展[15]。有研究证实IL-27可通过阻断TGF-β和IL-1诱导的Th17细胞分化,减少IL-17的分泌,抑制炎症反应[16]。本研究在急性肺炎小鼠模型基础上给予IL-27及IL-27抗体,结果发现,LPS+IL-27组病理改变较LPS组明显减轻,炎性细胞浸润减少,而LPS+IL-27抗体组较LPS组肺组织病理改变没有明显改变,表明IL-27 可改善LPS诱导的急性小鼠肺组织损伤。进一步研究发现,LPS+IL-27组TNF-α、IL-1β表达水平较LPS组和LPS+IL-27抗体组显著降低;而LPS+IL-27组IL-10、TGF-β1的表达水平均显著高于LPS+IL-27抗体组。提示IL-27 一方面可以抑制炎性细胞因子的分泌,另一方面又可以促进抗炎细胞因子的大量分泌,从正向和反向降低机体及组织中的炎症反应。
STAT3是一种原癌基因,存在于多种恶性肿瘤中,能够诱导多种炎症相关基因的产生,是介导炎症反应的关键分子,可被多种因素激活,进而在胞内编码一系列炎症相关蛋白,并促进这些蛋白的释放,扩大炎症反应[17-18]。研究报道,STAT3可能与哮喘所致支气管上皮细胞损伤有关,沉默STAT3抑制JAK/STAT3信号通路的激活,可抑制上皮细胞分泌炎性因子,保护气道损伤[19]。SOCS3属于细胞因子信号转导抑制蛋白家族,是重要的负反馈调节蛋白,可通过E3泛素化途径快速降解JAK2蛋白,也可通过抑制与磷酸化JAK的结合和/或促进JAK在细胞质中的泛素化来减弱STAT3活性[20-21]。本研究结果发现LPS组和LPS+IL-27抗体组小鼠肺组织p-STAT3及STAT3蛋白表达水平较正常对照组显著升高,SOCS3 表达水平较正常对照组虽有升高;LPS+IL-27组p-STAT3及STAT3蛋白表达水平较LPS组和LPS+IL-27抗体组显著降低,SOCS3表达水平显著升高。血清检测结果与肺组织检测结果一致,提示LPS可能诱导急性肺炎小鼠STAT3磷酸化,激活STAT3信号通路;而IL-27可促进SOCS3基因的表达从而抑制STAT3的磷酸化,对急性肺炎小鼠肺组织起到保护作用。
综上所述,IL-27可改善LPS诱导的小鼠急性肺炎,其机制可能与IL-27抑制STAT3信号通路相关蛋白磷酸化有关。

