利用重测序染色体片段代换系群体定位水稻籽粒长宽比QTL
卫纯洁 陶亚军 范方军
摘要:水稻籽粒长宽比是影响水稻品质和产量的重要农艺性状之一,是由多基因控制的数量性状。染色体片段代换系由于可以减少分离群体中个体间遗传背景的干扰,已成为定位和克隆复杂性状QTL的重要材料。本研究利用以籼稻品种9311为背景、以粳稻品种日本晴为代换片段构建的128个经过2代重测序的染色体片段代换系群体作为试验材料,利用多元回归,结合Bin-map图谱,定位到了4个控制水稻籽粒长宽比的QTL。其中,qLWR2.1被定位在第2染色体上的 812 145 bp 区间内,加性效应值为-0.04,加性效应百分率为-1.12%;qLWR2.2被定位在第2染色体上的324 166 bp区间内,加性效应值为0.17,加性效应百分率为4.14%;qLWR3.1被定位在第3染色体上的17 825 bp区间内,加性效应值为-0.25,加性效应百分率为-7.73%;qLWR11.1被定位在第11染色体上的945 168 bp区间内,加性效应值为0.21,加性效应百分率为5.15%。本研究结果为精细定位并克隆相应QTL,进而探明水稻籽粒长宽比QTL的分子调控机制奠定了基础。
关键词:水稻;染色体片段代换系;重测序;籽粒长宽比;QTL定位
中图分类号:S511.01 文献标志码: A 文章编号:1002-1302(2020)06-0036-05
水稻的粒形是一个与水稻产量和品质都存在密切关系的重要性状,由粒长、粒宽、粒厚以及长宽比构成。水稻粒形遗传机制十分复杂,是受多基因控制的数量性状[1-4]。目前,不同研究者利用各种分离群体,已经定位了400多个水稻粒形相关QTLs,这些QTLs分布在水稻12条染色体上。粒形的遗传调控网络也非常复杂[5-6],主要涉及植物激素、MAPK信号、泛素-蛋白酶体通路、表观修饰和G-蛋白信号等分子路径。油菜素内脂(BR)不仅可以调控水稻的生长发育,还可以控制水稻粒形。BR生物合成中的关键基因D11发生突变后,其突变体d11表现为植株矮化,谷粒小且圆[7-8],过量表达该基因可以增加粒长和粒宽,并通过增加种子中糖积累以提高粒质量[9]。D2/SMG11同样与BR合成有关,也可以调控水稻籽粒大小[10]。参与BR信号转导的基因也可以影响籽粒体积,如OsBRI1[11]、GS6[12]、BU1[13]、OsBZR1[14]、BAK1[15]等。除BR以外,参与调控生长素平衡的基因TGW6[16]、参与生长素响应的基因BG1[17]等也可以调节籽粒大小。水稻G蛋白由α、β、γ 3个亚基组成,调控多个信号转导过程。α亚基功能缺失突变体d-1表现为矮秆小粒[18];β亚基基因RGB1表达量降低也可以导致籽粒变小[19-20];GS3是第1个被克隆的负调控粒长的QTL,它编码G蛋白γ亚基[21-23]。最近,李云海课题组在MAPK信号如何影响粒形方面提出了多个调控模型[24-25]。
虽然目前已经定位和克隆了多个控制水稻籽粒大小的QTLs,但是至今没有控制水稻籽粒长宽比的QTL被精细定位和克隆。染色体片段代换系是通过连续回交结合分子标记辅助选择的方法,在受体亲本中导入供体亲本的染色体片段,因此,避免了分離群体内遗传背景的干扰,可以将复杂的QTL位点分解为几个甚至单一位点,已被广泛应用到复杂性状QTL精细定位与克隆研究中。但由于分子标记数量有限、在不同染色体上分布不均匀以及双交换等问题的存在,利用分子标记辅助选择构建的染色体片段代换系会存在小片段漏检从而使得QTL定位不准确的问题。笔者所在实验室在前期研究中,构建了以籼稻品种9311为背景、粳稻品种日本晴为代换片段的128个染色体单片段代换系群体,并通过2代高通量重测序技术对该套群体进行测序[26],导入片段的大小和位置准确可知。本研究利用这一套重测序的染色体片段代换系,定位了4个控制水稻籽粒长宽比的QTLs,为进一步精细定位并克隆相应的QTL和育种利用研究提供理论依据。
1 材料与方法
1.1 供试材料
试验材料包括:籼稻品种9311,粳稻品种日本晴,以9311为背景、日本晴为替换片段的128个代染色体片段代换系群体。利用全基因组2代高通量测序技术,参考Huang等的方法[27],对染色体片段代换系群体重测序,明确128个代换系的代换片段在染色体上的精确位置和代换片段带型,代换片段覆盖水稻全基因组的93.3%。
1.2 试验方法
2017年5月11日在江苏省南京市采用旱育秧的方式播种试验材料。秧龄30 d后移栽,按照 26.7 cm×13.3 cm的行、株距每个代换系栽4行,每行15株。采用粳稻常规大田肥水管理和病虫草害防治方法。成熟后,每个代换系挑选中间长势正常的5株混收,每个代换系随机选取成熟饱满的10粒种子,测定粒长、粒宽和粒厚,以平均值作为性状的表型值。
1.3 QTLs分析
参考Paran等的方法[28],根据染色体片段代换系群体的Bin信息绘制覆盖基因组的Bin-map。128个代换系共包括401个Bin,命名为X1~X401,其中最小Bin的片段长度为13 213 bp,最大Bin的片段长度为10 654 035 bp,平均长度为889 652 bp。参考Xu等的方法[26],采用多元回归的方法,进行QTL的精确定位,回归模型如下:
yi=b0+∑mk=1bkxik+ei。
式中:yi为第i系的性状平均值;b0为模型均值;m是Bin的总数;bk为第k个Bin的偏回归系数;xik为第i个体第k个Bin基因型的指示变量,依Bin的基因型来源不同而取值,来自供体的Bin取-1,来自受体亲本的Bin取1;ei为随机误差。
1.4 QTLs效应分析
QTL加性效应值的计算,参照Eshed等的方法[29]估算各个QTL的加性效应值及加性效应贡献率。
加性效应值=(片段代换系的表型值-9311的表型值)/2;
加性效应百分率=(加性效应值/9311的表型值)×100%。
QTL的命名依照McCouch制定的原则[30]。
2 结果与分析
2.1 亲本及128个染色体片段代换系籽粒的长宽比
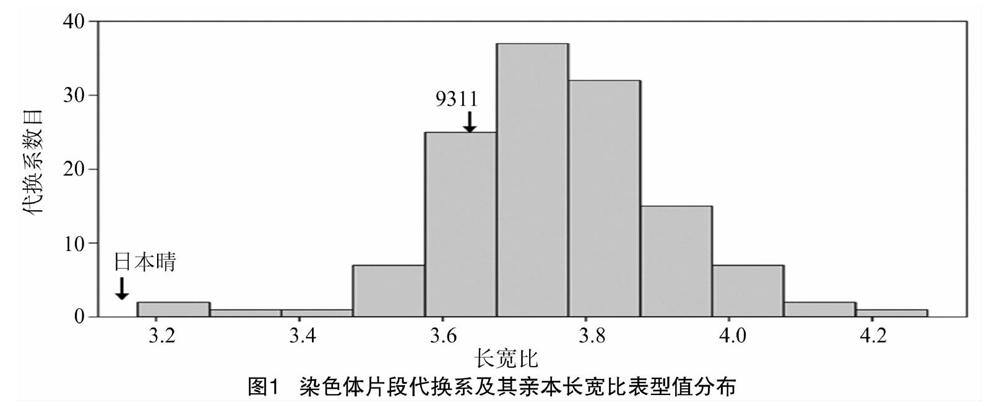
128个染色体片段代换系的长宽比为3.17~4.28,受体亲本9311的长宽比为3.66±0.11,供体亲本日本晴的长宽比为2.37±0.09(图1),亲本间长宽比差异达到极显著水平(P<0.01)。
2.2 籽粒长宽比QTL分析
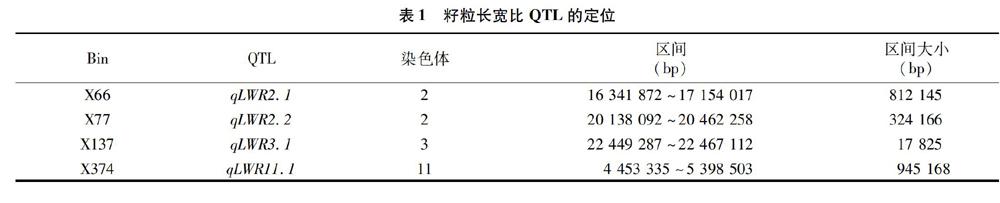
利用128个染色体片段代换系和受体亲本9311籽粒长宽比的表型数据,通过Bin-map进行QTL定位的方法,在Bin X66、X77、X137、X374上定位到4个籽粒长宽比的QTLs(表1),分别位于水稻的第2、2、3和11号染色体上。其中,qLWR2.1被定位在812 145 bp区段上;qLWR2.2被定位在 324 166 bp 区段上;qLWR 3.1被定位在17 825 bp区段上;qLWR11.1被定位在945 168 bp區段上。
2.3 籽粒长宽比QTL效应分析
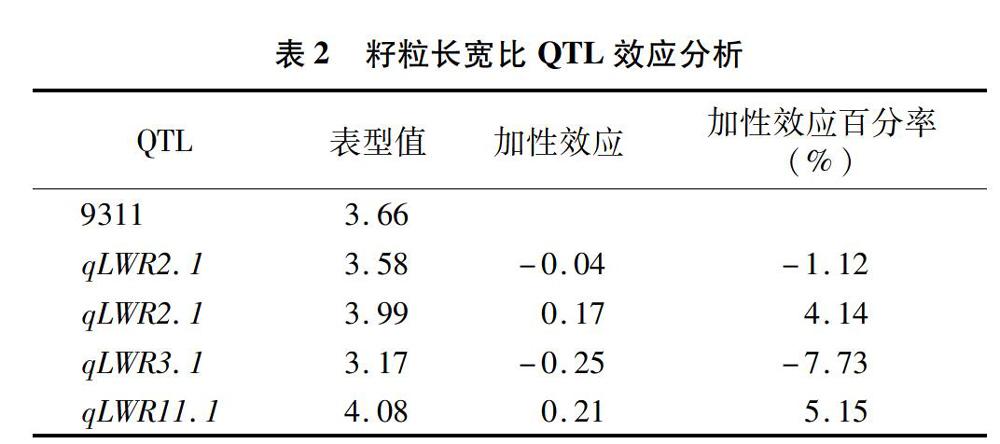
对128个重测序片段进行分析,获得了4个长宽比QTLs的单片段代换系。利用这个4个染色体单片段代换系对QTL效应进行分析,结果(表2)表明,qLWR2.1表现为减效作用,加性效应为-0.04,加性效应百分率为-1.12%;qLWR2.2表现为增效作用,加性效应为0.17,加性效应百分率为4.14%;qLWR 3.1表现为减效作用,加性效应为-0.25,加性效应百分率为-7.73%;qLWR11.1表现为增效作用,加性效应为0.21,加性效应百分率为5.15%。
3 讨论与结论
随着人们对稻米品质要求的提高,品质改良已经成为水稻最重要的育种目标之一。稻米的品质主要包括外观品质、加工品质、蒸煮食味品质和营养品质。水稻粒形是与外观品质、加工品质、蒸煮食味品质都存在着密切的关系的重要性状[31-32]。水稻粒形遗传机制复杂,是受多基因控制的数量性状。在籽粒长宽比相关QTL定位研究方面,邢永忠等利用珍汕97与明恢63的重组自交系群体检测到了5个长宽比相关的QTLs,分别位于水稻第1、1、3、5、6号染色体,这5个QTLs共解释长宽比变异的57.47%[2]。严长杰等利用Balilla为轮回亲本、NTH为供体亲本的回交群体为材料,结合其遗传图谱定位了qLW-2、qLW-6和qLW-7 3个长宽比相关位点,3个QTLs的贡献率分别为12.7%、11.5%和18.3%[33]。张光恒等以窄叶青和京系17构建的DH群体,在北京、杭州、海南等3种环境下定位了6个控制长宽比的QTLs,分别位于水稻第1、2、3、4和6号染色体,贡献率为9.7%~22.7%,其中5个QTLs能够在2个及以上环境被检测到[34]。陈冰嬬等利用蜀恢527为轮回亲本、Milagrosa为供体亲本构建的BC2F2高代回交群体定位了2个长宽比QTLs,均位于水稻第3号染色体上,分别解释了 5.05% 和26.15%的表型变异[35]。通过这些传统的次级遗传群体对目标QTL进行鉴定之后,由于定位群体本身遗传背景的干扰、QTL之间的互作加上环境条件的影响,造成QTL定位结果不准确,年际间重复性差,因此很难再进行QTL的精细定位和克隆工作。
染色体单片段代换系是通过受体亲本和供体亲本杂交并不断回交而选育的一套遗传背景单一、供体信息丰富的高级遗传群体,染色体单片段代换系与受体亲本之间表型的差异,有可能就是供体片段的基因型所致,因此排除了遗传噪音干扰的染色体单片段代换系已经成为作物复杂农艺性状QTL定位和克隆的理想群体。前人利用染色体片段代换系对粒形长宽比QTL定位开展了部分工作。万向元等利用短宽粒粳稻品种Asominori为受体亲本、长窄粒籼稻品种IR24为供体品种构建了一套染色体片段代换系,多年多点对代换系的粒长、粒宽和长宽比进行了QTL定位,共定位到5个长宽比相关QTLs,其中qLWR-3、qLWR-5a和qLWR-5b在2年4点的环境中被重复检测到,表明这3个QTLs遗传较为稳定,可以进一步研究利用[36]。李生强等利用籼稻品种广陆矮4号为轮回亲本、粳稻品种日本晴为供体亲本构建了一套染色体片段代换系为材料,利用多重比较的方法共定位到5个影响籽粒长宽比的QTLs[37]。
利用染色体片段代换系为材料,对水稻复杂农艺性状进行QTL定位,不仅提高了定位结果的准确性,而且可以直接配制分离群体进行精细定位。但是,父母本之间的遗传多样性以及分子标记数目的局限性,导致基于分子标记检测代换系的遗传背景以及供体信息往往不够准确,容易造成QTL定位的偏差。随着高通量测序技术的发展,对每个代换系进行全基因组重测序,可以准确获知代换系的遗传背景以及替换片段的遗传信息,有目的地选择替换片段,对于构建覆盖全基因组的染色体片段代换系具有重要意义。同时基于测序信息绘制覆盖基因组的Bin-map图谱,可以通过多元回归的方法实现QTL的精细定位。本研究利用9311和日本晴构建的128个重测序的染色体片段代换系为试验材料进行粒形QTL分析,定位了4个水稻籽粒长宽比相关的QTLs,每一个QTL都被界定在具体的染色体区段上。根据之前构建的物理图谱,对本研究定位到的籽粒长宽比QTLs与前人研究结果进行比较,发现qLWR2.1与李生强等定位的长宽比QTL qLWR-2[37]在相同的染色体区段上;qLWR2.2与Bai等定位的长宽比QTL qLWR2[38]在相同的染色体区段上;qLWR3.1与陈冰嬬等定位的长宽比QTL qlw3b[35]、万向元等定位的长宽比QTL qLWR3[36]、李生强等定位的长宽比QTL qLWR-3[37]、马孟莉等定位的长宽比QTL qLWR-3[39]、Tan等定位的长宽比QTL[40]、李泽福等定位的长宽比QTL[41]在相同或者相邻的染色体区段上,该主效QTL的效应较大,在多个群体中均能被检测和定位到,且与第3染色体短臂上已克隆的粒形基因GS3[21]的距离较远。本研究中的4个籽粒长宽比QTLs被定位在17.8~945.2 kb的区段内,其中qLWR3.1被定位在第3染色体上约17.8 kb区间内,可以直接利用带有目标QTL的代换系与受体亲本9311杂交,构建F2及其衍生分离群体,有望快速实现qLWR3.1的精细定位和克隆,为进一步探明该主效QTL的调控机制奠定基础。本研究也进一步证明了重测序染色体片段代换系群体在QTL鉴定和定位方面的优势。
參考文献:
[1]林鸿宣,闵绍楷,熊振民,等. 应用RFLP图谱定位分析籼稻粒形数量性状基因座位[J]. 中国农业科学,1995,28(4):1-7.
[2]邢永忠,谈移芳,徐才国,等. 利用水稻重组自交系群体定位谷粒外观性状的数量性状基因[J]. 植物学报,2001,43(8):840-845.
[3]张光恒,张国平,钱 前,等. 不同环境条件下稻谷粒形数量性状的QTL分析[J]. 中国水稻科学,2004,18(1):16-22.
[4]黎毛毛,徐 磊,任军芳,等. 粳稻粒形性状的数量性状基因座检测[J]. 中国农业科学,2009,42(7):2255-2261.
[5]Kesavan M,Song J T,Seo H S. Seed size:a priority trait in cereal crops[J]. Physiol Plantarum,2013,147(2):113-120.
[6]Lin N,Li Y H. Signaling pathways of seed size control in plants[J]. Curr Opin Plant Biol,2016,33:23-32.
[7]Tanabe S,Ashikari M,Fujioka S,et al. A novel cytochrome P450 is implicated in brassinosteroid biosynthesis via the characterization of a rice dwarf mutant,dwarf11,with reduced seed length[J]. Plant Cell,2005,17(3):776-790.
[8]Zhou Y,Tao Y J,Zhu J Y,et al. GNS4,a novel allele of DWARF11,regulates grain number and grain size in a high-yield rice variety[J]. Rice,2017,10:34.
[9]Zhu X L,Liang W Q,Cui X,et al. Brassinosteroids promote development of rice pollen grains and seeds by triggering expression of carbon starved anther,a MYB domain protein[J]. Plant J,2015,82(4):570-581.
[10]Hong Z,Ueguchi-Tanaka M,Umemura K,et al. A rice brassinosteroid-deficient mutant,ebisu dwarf (d2),is caused by a loss of function of a new member of cytochrome P450[J]. Plant Cell,2003,15(12):2900-2910.
[11]Yamamuro C,Ihara Y,Wu X,et al. Loss of function of a rice brassinosteroid insensitive1 homolog prevents internode elongation and bending of the lamina joint[J]. Plant Cell,2000,12(9):1591-1606.
[12]Tao H,Lin L,Jin Y,et al. DWARF AND LOW-TILLERING acts as a direct downstream target of a GSK3/SHAGGY-like kinase to mediate brassinosteroid responses in rice[J]. Plant Cell,2012,24(6):2562-2577.
[13]Atsunori T,Hitoshi N,Chikako T,et al. BRASSINOSTEROID UPREGULATED1,encoding a helix-loop-helix protein,is a novel gene involved in brassinosteroid signaling and controls bending of the lamina joint in rice[J]. Plant Physiol,2009,151(2):669-680.
[14]Bai M Y,Zhang L Y,Gampala S S,et al. Functions of OsBZR1 and 14-3-3 proteins in brassinosteroid signaling in rice[J]. Proc Natl Acad Sci USA,2007,104(34):13839-13844.
[15]Li D,Wang L,Wang M,et al. Engineering OsBAK1 gene as a molecular tool to improve rice architecture for high yield[J]. Plant Biotech J,2010,7(8):791-806.
[16]Ishimaru K,Hirotsu N,Madoka Y,et al. Loss of function of the IAA-glucose hydrolase gene TGW6 enhances rice grain weight and increases yield[J]. Nature Genet,2013,45(6):707-711.
[17]Liu L,Tong H,Xiao Y,et al. Activation of Big Grain1 significantly improves grain size by regulating auxin transport in rice[J]. Proc Natl Acad Sci USA,2015,112(35):11102-11107.
[18]Miura K,Agetsuma M,Kitano H,et al. A metastable DWARF1 epigenetic mutant affecting plant stature in rice[J]. Proc Natl Acad Sci USA,2009,106(27):11218-11223.
[19]Zhang D P,Zhou Y,Yin J F,et al. Rice G-protein subunits qPE9-1 and RGB1 play distinct roles in abscisic acid responses and drought adaptation[J]. J Exp Bot,2015,66(20):6371-6384.
[20]Utsunomiya Y,Samejima C,Takayanagi Y,et al. Suppression of the rice heterotrimeric G protein beta-subunit gene,RGB1,causes dwarfism and browning of internodes and lamina joint regions[J]. Plant J,2011,67(5):907-916.
[21]Fan C,XingY,Mao H,et al. GS3,a major QTL for grain length and weight and minor QTL for grain width and thickness in rice,encodes a putative transmembrane protein[J]. Theor Appl Genet,2006,112(6):1164-1171.
[22]Mao H,Sun S,Yao J,et al. Linking differential domain functions of the GS3 protein to natural variation of grain size in rice[J]. Proc Natl Acad Sci USA,2010,107(45):19579-19584.
[23]Liu Q,Han R X,Wu K,et al. G-protein beta gamma subunits determine grain size through interaction with MADS-domain transcription factors in rice[J]. Nat Commun,2018,9:852.
[24]Xu R,Duan P,Yu H,et al. Control of grain size and weight by the OsMKKK10-OsMKK4-OsMAPK6 signaling pathway in rice[J]. Mol Plant,2018,11:860-873.
[25]Xu R,Yu H,Wang J,et al. A Mitogen-activated protein kinase phosphatase influences grain size and weight in rice[J]. Plant J,2018,95:937-946.
[26]Xu J,Zhao Q,Du P,et al. Developing high throughput genotyped chromosome segment substitution lines based on population whole-genome resequencing in rice (Oryza sativa L.)[J]. BMC Genomics,2010,11:656-669.
[27]Huang X,Feng Q,Qian Q,et al. High-throughput genotyping by whole-genome resequencing[J]. Genome Res,2009,19(6):1068-1076.
[28]Paran I,Zamirc D. Quantitative traits in plants:beyond the QTL[J]. Trends Genet,2003,19(6):303-306.
[29]Eshed Y,Zamir D. An introgression line population of Lycopersicon pennellii in the cultivated tomato enables the identification and fine mapping of yield-associated QTL[J]. Genetics,1995,141(3):1147-1162.
[30]McCouch S R. Gene nomenclature system for rice[J]. Rice,2008,1(1):72-84.
[31]徐正進,陈温福,马殿荣,等. 稻谷粒形与稻米主要品质性状的关系[J]. 作物学报,2004,30(9):49-55.
[32]楊联松,白一松,许传万,等. 水稻粒形与稻米品质间相关性研究进展[J]. 安徽农业科学,2001,29(3):312-316.
[33]严长杰,梁国华,陈 峰,等. 利用籼粳回交群体分析水稻粒形性状相关QTLs[J]. 遗传学报,2003,30(8):711-716.
[34]张光恒,张国平,钱 前,等. 不同环境条件下稻谷粒形数量性状的QTL分析[J]. 中国水稻科学,2004,18(1):16-22.
[35]陈冰嬬,石英尧,崔金腾,等. 利用BC2F2高代回交群体定位水稻籽粒大小和形状QTL[J]. 作物学报,2008,34(8):1299-1307.
[36]万向元,刘世家,王春明,等. 利用CSSLs群体研究稻米粒型QTL的表达稳定性[J]. 遗传学报,2004,31(11):1275-1283.
[37]李生强,崔国昆,关成冉,等. 基于水稻单片段代换系的粒形QTL定位[J]. 中国水稻科学,2011,25(2):163-168.
[38]Bai X F,Luo L J,Yan W H,et al. Genetic dissection of rice grain shape using a recombinant inbred line population derived from two contrasting parents and fine mapping a pleiotropic quantitative trait locus qGL7[J]. BMC Genetics,2010,11:16-26.
[39]马孟莉,刘艳红,江 玲,等. 利用F2群体定位水稻谷粒长宽比QTL[J]. 江西农业大学学报,2015(2):260-263.
[40]Tan Y F,Xing Y Z,Li J X,et al. Genetic bases of appearance quality of rice grains in Shanyou 63,an elite rice hybrid[J]. Theor Appl Genet,2000,101(6):823-829.
[41]李泽福,万建民,夏加发,等. 水稻外观品质的数量性状基因位点分析[J]. 遗传学报,2003,30(3):251-259.练冬梅,赖正锋,姚运法,等. 玫瑰茄转录组测序及花青素合成相关基因表达分析[J]. 江苏农业科学,2020,48(6):41-45.

