菲律宾蛤仔5个地理群体形态差异分析
祁剑飞,宁 岳,巫旗生,郭 香,郑雅友,曾志南,江泽贵
(福建省水产研究所、福建省海洋生物增养殖与高值化利用重点实验室,福建 厦门 361013)
菲律宾蛤仔(Ruditapesphilippinarum)是一种广温、广盐、广分布的海洋经济贝类,2017年全国蛤类产量达417.79万吨,占全国海水养殖产量的20.88%[1],其中菲律宾蛤仔产量超过300万吨,是我国单品种养殖产量最高的海洋生物物种,其总产量在所有贝类物种中也居世界第二[2]。遍及全国沿海,特别是辽宁和山东的大规模菲律宾蛤仔养殖活动得益于福建省大规模的苗种供应[3],据业内估计,其苗种产量占全国的90%以上。但是这种长期的异地苗种底播养殖方式会对当地野生种群的遗传结构产生一定影响[4]。因此对菲律宾蛤仔野生种群资源的调查和评估很有必要,既有利于保护野生种群资源,也可为杂交育种提供参考。而外部形态差异则是不同野生地理群体基于形态测量学的判定条件。
关于菲律宾蛤仔遗传差异的报道[5-9]较多,而关于其不同地理群体形态差异的研究,除邹琰(2010)和牛泓博等(2015)分别研究了山东和辽宁沿海菲律宾蛤仔形态差异[10-11]外,鲜有报道。本研究测定了采自不同海域的5个菲律宾蛤仔野生群体的形态参数,分析了其形态差异,可为今后的种质资源保护和遗传选育提供参考。
1 材料与方法
1.1 样品采集
样品于2018年9—12月,采自海州(HZ: 37°59′26.7″N,125°44′45.8″E)、南浦(NP: 39°27′49.5″N,125°12′40.2″E )、莱州(LZ: 37°21′24.2″N,119°50′18.9″E)、莆田(PT: 25°10′29.3″N,119°15′43.8″E)和汕尾(SW: 22°40′31.7″N,115°28′17.2″E)自然海区。通过低温保活分多批次运至厦门小嶝水产科技有限公司实验基地,流水充气暂养。样本信息见表1。

表1 菲律宾蛤仔5个群体样本信息Tab.1 Information of 5 populations of Manila clam
1.2 形态指标及测定
每个群体测定50个样本,外部形态测量指标参考刘建勇等(2010)[12],采用游标卡尺(精确到0.01 mm)测量了壳长(AB)、壳宽(GH)、壳高(OC)、韧带长(OD)、楯面长(OE)、楯面宽(MN)、小月面长(OF)、前端到腹缘(BC)、后端到腹缘(AC)9个形态性状(图1),共获取了2 250个数据。

图1 菲律宾蛤仔形态测量位点Fig.1 Landmark points for morphological measurement of Manila clam
1.3 数据分析
为消除不同群体规格大小对数据的影响,每个个体的数据除以壳长进行校正。应用SPSS 17.0以校正后的数据对5个群体形态差异进行单因素方差分析、聚类分析、主成分分析和判别分析。
1.3.1 单因素方差分析 采用Tukey s-b(K)法进行多重比较,并划分出同类子集,其显著性水平设置为0.05。
1.3.2 聚类分析 利用各参数校正值的均值,采用平方欧氏距离法进行系统聚类分析。
1.3.3 主成分分析 以校正后的8个参数值为变量,250个个体数据整体进行主成分分析,选取特征值大于1的主成分进行结果分析。
1.3.4 判别分析 采用逐步判别分析法,判别准确率公式如下:
P1=n/N×100
(1)
P2=n/Nd×100
(2)
式(1~3)中:P1、P2为判别准确率(%),P为综合判别率(%),n为判别正确的菲律宾蛤仔数(个),N为实测菲律宾蛤仔数(个); Nd为判别菲律宾蛤仔数(个); Ai为第i个群体判别正确的菲律宾蛤仔数(个),Bi为第i个群体实际判别的菲律宾蛤仔数(个),k为群体数(个)。
2 结果与讨论
2.1 单因素方差分析
菲律宾蛤仔HZ组GH/AB、OC/AB、OD/AB和MN/AB显著大于其他组(p<0.05,表2),这表明HZ群体壳宽较厚,壳高较高,壳形接近球形,与其他组形态差异明显。其他组之间各指标互有差异,整体壳形差别不明显。
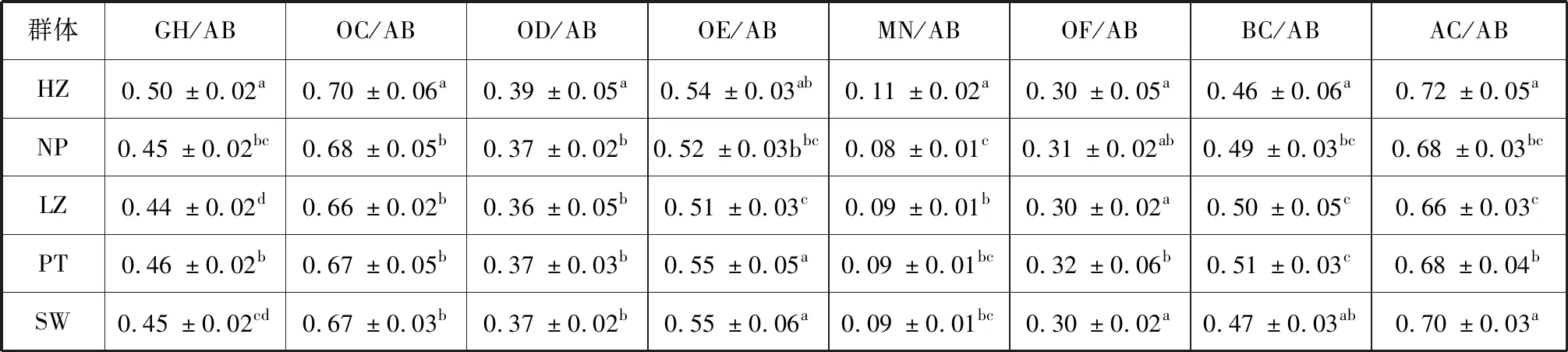
表2 菲律宾蛤仔5个群体形态的方差分析Tab.2 ANOVA analysis of morphological parameters on 5 populations of Manila clam
注:同列数据上标字母“a、b、c”完全不同表示有显著差异(p<0.05)。
2.2 聚类分析
5个群体形态性状的聚类分析(图2)可以看出NP、LZ和PT等3组形态差异不大,而NP与LZ群体形态尤其接近;整体来看除HZ外的4组之间差异较小,而其整体与HZ差异很大,这说明HZ组形态与其它4组差异明显。
2.3 主成分分析
按照特征值大于1,共提取2个主成分(表3)。主成分1解释的总方差贡献率为28.28%,主成分2为20.77%,累计贡献率为49.05%,即2个主成分可解释5个群体间形态差异的49.05%。在主成分1中GH/AB影响最大,其负荷值为0.802,其次为MN/AB,负荷值为0.751,这说明主成分1代表了“宽度”对壳型的影响;在主成分2中前端到BC/AB影响最大,其负荷值为0.794,其次为OF/AB,负荷值为0.618,这说明主成分2代表了“长度”对壳型的影响。

图2 菲律宾蛤仔5个群体形态性状聚类分析Fig.2 Clustering dendrogram by morphological traits of 5 populations of Manila clam
表3 菲律宾蛤仔5个群体形态的2个主成分矩阵负荷值和贡献率
Tab.3 Contribution ratios and loading of 2 principal components for morphological parameters of 5 populations of Manila clam

形态性状主成分1主成分2GH/AB0.8020.239OC/AB0.520.406OD/AB0.4850.156OE/AB0.3720.275MN/AB0.751-0.012OF/AB0.050.618BC/AB-0.3340.794AC/AB0.591-0.572贡献率28.28%20.77%
从图3可见看出,除HZ群体外,其它4组混杂在一起,难以区分,这和聚类分析的结果较一致。

图3 菲律宾蛤仔5个群体形态主成分散布图Fig.3 Scattering diagram of the principal components for morphological parameters of 5 populations of Manila clam
2.4 判别分析
采用逐步判别分析,筛选出X1(GH/AB)、X2(OE/AB)、X3(MN/AB)和X4(AC/AB)共4个性状特征值建立了5个群体的判别函数:
YHZ=814.485X1+220.653X2+331.141X3+
472.528X4-451.783
YNP=745.604X1+222.846X2+150.492X3+
448.072X4-386.301
YLZ=714.053X1+214.790X2+219.063X3+
438.213X4-367.209
YPT=755.939X1+235.811X2+179.968X3+
451.513X4-402.781
YSW=727.249X1+237.870X2+192.687X3+
466.209X4-402.165
表4为5个判别函数的各项系数和常数,表5为判别分析结果,判别准确率P1和P2均在36.0%~80.0%之间;5个群体的综合判别率为53.6%。HZ群体的判别率最高,为80.0%,这说明该群体特征明显,易于判别。

表4 5个菲律宾蛤仔群体的Fisher线性判别式的各项系数及常数Tab.4 Coefficients and constants of Fisher discriminant functions for 5 populations of Manila clam

表5 5个菲律宾蛤仔群体判别分析结果Tab.5 Fisher discriminant results of 5 populations of Manila clam
2.5 讨论
2.5.1 菲律宾蛤仔的形态差异 贝类形态变异受遗传因子和环境因子共同影响,是对栖息环境长期适应的结果。本研究通过几种多元分析方法对菲律宾蛤仔8个形态校正参数比较分析,结果表明HZ群体与NP、LZ、PT和SW群体在外部形态上差异显著。虽然聚类分析将NP、LZ、PT和SW聚在一起,显示出从北到南差异逐渐增大的趋势,但是HZ与其它组的差异显然不是地理隔离造成的,因为距离相近的NP与之差异巨大而与另外3个群体相似。其他研究中也存在类似的结果,牛泓博等认为辽宁沿海菲律宾蛤仔不同群体间的形态变异程度与地理距离有一定关系,但主要受栖息地环境影响[11]。宋菲菲等(2012)认为毛蚶(Scapharcasubcrenata)群体变异程度可能与地理距离有一定关系,同时受到栖息地环境的影响[13]。贝类均具有较强的表型环境可塑性,其表型变异并不总是由遗传导致,更多是受栖息地环境影响[14-15]。Kwon等(1999)将韩国沿海外壳形态差异明显的3组菲律宾蛤仔转移到同一养殖区域,13个月后发现它们外形差异变得不显著,证明栖息地环境是其外壳形态的主要影响因素[16]。Watanabe等(2010)对日本4个海湾菲律宾蛤仔形态学研究发现,栖息于贫营养环境中的个体较营养条件良好的个体壳宽更大[17];Caill-Milly等(2012)研究表明,群体密度较低及褐色肌肉病会导致菲律宾蛤仔个体呈现更高的GH/AB比值,使外形接近于球形[18]。然而HZ组壳宽较大的形态差异是否由海州呈贫营养化海区环境和较低种群密度造成,尚需对采样地生态条件开展进一步研究。
2.5.2 蛤类形态差异判别方法 传统贝类分类鉴定依据是壳长、壳高、壳宽、壳色和纹理等几个指标,主观性较强,误判率较高。因此基于形态测量学的聚类分析、主成分分析、判别分析等多元分析方法在蛤类不同地理群体的形态差异分析中广泛应用[19-21],这些方法虽然基于测量数据,依靠数学统计分析得出区分结果,消除了人的主观影响,但是由于测量的形态学指标较少,在分析形态相似的地理群体间差异时仍是差强人意。也有学者应用广义线性模型和传统形态测量学结合的方法对菲律宾蛤仔地理群体进行判别分析[22],但该方法筛选后采用的预测变量组合只有1种,没有突破传统形态测量学方法的短板,且由于要求响应变量Y服从二项分布,导致研究群体只能为2个,更加局限了该方法的应用。为消除形态学指标少的缺陷,近年来基于椭圆傅里叶分析的轮廓线法[23]和基于空间坐标系的地标点法[24]等几何形态测量学方法得到一定应用,这两种方法依靠计算机图形处理技术采集更多更精确的形态几何数据并做更准确的定量分析。但几何测量学方法需要专门的图像采集硬件和专业的图形处理软件,成本较高,操作繁琐,限制了它们的应用。
在贝类地理群体差异分析中,形态差异分析是一个重要方面,然而大多数双壳类尤其是蛤类外壳近似圆形,形态差异分析具有局限性,将其与生理生化、分子生物学指标结合将会使结果更加准确。
2.5.3 菲律宾蛤仔种质资源保护和遗传育种 我国是世界上进行菲律宾蛤仔人工育苗规模最大、数量最多的国家。仅在福建省垦区育苗生产中,面积为86.6 hm2的池塘就可培育2 mm的稚贝604.9亿粒[25]。大规模的育苗生产需要大规模的亲贝供应,但业者在选择菲律宾蛤仔亲贝时仅考虑性腺成熟度,而忽略其他性状,使用一龄性腺饱满的亲贝育苗已是普遍现象。从育种学的角度看,这些菲律宾蛤仔亲贝大多是未经系统选育或改良的人工养殖群体,经过多年反复养殖再育苗,存在近亲繁殖的风险,商品蛤经济性状日趋退化。因此,保护原始的优良品种,并利用这些优良的种质资源培育新品种、新品系,已成为贝类养殖业亟待解决的重要课题[26]。本研究测量了多个形态性状参数,通过形态性状的多元分析评估了5个地理群体菲律宾蛤仔的种质资源状况,可为其种质资源保护和遗传育种工作提供依据。
3 结论
应用多元分析方法对不同海域的5个菲律宾蛤仔野生群体形态数据进行比较分析。结果表明HZ群体与其它4组形态差异显著,GH/AB明显较大,但这种差异是由遗传差异还是环境差异造成,需进一步研究。本研究可为菲律宾蛤仔种质资源保护和遗传育种提供基础资料。

