荷叶离褶伞多糖提取工艺优化及抗氧化活性研究
,*
(1.江苏省农业科学院农产品加工研究所,江苏南京 210014; 2.南京农业大学食品科技学院,江苏南京 210095)
食用菌味道鲜美,不仅是一种受欢迎的蔬菜,也是一种功能性食品,我国有食用菌350多种,具有广阔的消费市场。食用菌中含有多种氨基酸、微量元素以及多糖,早在明朝时期它们的营养以及药用价值就受到了人们的关注[1]。食用菌的一些代谢产物具有抗氧化、抗菌、抗炎、抗过敏的作用[2]。自1968年第一次报道食用菌子实体水提物中具有抗肿瘤的活性物质后,科学家们开始对食用菌中的抗肿瘤物质产生了兴趣,后来研究发现该水提取物中大部分物质为食用菌多糖[3]。食用菌多糖广泛存在于食用菌细胞膜中,是食用菌中最丰富的生物聚合物,也是最主要的活性物质,具有多种生物学功能[4-5]。众多报道表明食用菌多糖能有效预防肿瘤的发生,在降低血糖、血脂、抗血栓等方面同样起着重要作用,且不产生毒副作用,被称为“生物反应调节剂”[6-7]。食品及医学界研究人员发现,自由基以及氧化剂会分解细胞,干扰人体正常的代谢途径而威胁到人体健康,食用菌多糖具有较好的抗氧化活性,可以通过抗氧化作用减缓运动性疲劳,有助于机体的快速恢复[8]。目前天然抗氧化剂的开发以及应用受到了极大的关注,也是国内外研究的热点[9],作为一种天然抗氧化剂,食用菌多糖在健康安全性方面远高于人工合成抗氧化剂。
荷叶离褶伞又称鹿茸菇、泥窝、荷叶蘑,属于伞菌目、口蘑科、离褶伞属,是一种非常珍贵的药食两用的食用真菌,主要分布在我国中南部等地,研究者在荷叶离褶伞中分离得到11种多糖[10]。目前对荷叶离褶伞的研究大都集中在人工培育方面,对于其生物活性物质的研究并不多见[11],仅甘肃河西学院团队对荷叶离褶伞多糖发酵以及抗肿瘤方面进行了相关研究。本文采用水提醇沉法来提取荷叶离褶伞多糖,并且优化该提取工艺,为制定科学、经济的荷叶离褶伞多糖制备工艺提供实验依据。同时对提取出来的多糖进行抗氧化活性研究,为将来研发有关荷叶离褶伞的保健以及药用产品提供理论依据。
1 材料与方法
1.1 材料与仪器
荷叶离褶伞 江苏江南生物科技公司;1,1-二苯基-2-三硝基苯肼(DPPH) 梯希爱化成工业发展有限公司;2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS) 上海麦克林生化科技有限公司;过硫酸钾(K2S2O8) 国药集团化学试剂有限公司;乙醇(分析纯)、十二水合磷酸氢钠、二水合磷酸二氢钠、抗坏血酸(VC)、葡萄糖、浓硫酸、苯酚 南京化学试剂股份有限公司。
TG16-WS台式高速离心机 长沙湘仪离心机仪器有限公司;SCIENTZ-10N冷冻干燥机 宁波新芝生物科技股份有限公司;RE-2000A旋转蒸发仪 上海亚荣生化仪器厂;HH系列数显恒温水浴锅 上海江星仪器有限公司;DNM-9602G酶标仪 上海闪谱生物科技有限公司。
1.2 实验方法
1.2.1 荷叶离褶伞预处理 将荷叶离褶伞切成段后于55 ℃烘箱中干燥至恒重,用粉碎机粉碎成粉末过60目筛,按1∶20料液比加入85%乙醇(w/v),在70 ℃条件下封口水浴8 h,重复处理至溶液无颜色,将浸泡过的样品粉末于50 ℃烘箱中烘干至恒重备用[12]。
1.2.2 多糖提取 取上述乙醇浸泡过后的荷叶离褶伞干粉,按一定的温度、时间、液料比、提取次数进行热水浸提,浸提结束后6500 r/min离心10 min,收集并合并上清液。将上清液按体积比1∶3加入80%乙醇进行醇沉,封口后4 ℃放置过夜,6500 r/min离心10 min得沉淀物。加入一定体积超纯水使多糖复溶,进一步去除其他杂质,上清液冷冻干燥得到荷叶离褶伞粗多糖。采用苯酚-硫酸法[13]对荷叶离褶伞多糖含量进行测定,根据所测得的标准曲线方程计算多糖得率。
粗多糖得率计算公式如下:
式中,Y为荷叶离褶伞多糖得率,%;c为多糖浓度,g/mL;V为多糖溶液体积,mL;D为稀释倍数;m为荷叶离褶伞多糖干粉质量,g。
1.2.3 单因素实验
1.2.3.1 提取温度对多糖得率的影响 将液料比固定为30∶1 (mL/g)分别提取2次、每次提取时间为3 h,研究不同温度(80、85、90、95、100 ℃)对多糖得率的影响。
1.2.3.2 提取时间对多糖得率的影响 将在液料比固定为30∶1 (mL/g)、分别提取2次、每次提取温度90 ℃,研究不同提取时间(1、2、3、4、5 h)对多糖得率的影响。
1.2.3.3 提取液料比对多糖得率的影响 将提取温度固定为90 ℃、分别提取2次、每次提取时间3 h,研究不同液料比(10∶1、20∶1、30∶1、40∶1、50∶1 mL/g)对多糖得率的影响。
1.2.3.4 提取次数对多糖得率的影响 将液料比固定为30∶1 (mL/g)、每次提取时间3 h、提取温度90 ℃,研究不同提取次数(1、2、3、4次)对多糖得率的影响。
1.2.4 响应曲面法试验设计 在单因素实验基础上,以多糖得率为响应值,初步确定几个提取因素的范围。再选取提取温度(X1)、时间(X2)、液料比(X3)这三个对荷叶离褶伞多糖得率影响较大的因素进行Box-Behnken试验设计,其因素水平设计见表1。

表1 Box-Behnken试验设计因素水平Table 1 Factors and levels of Box-Behnken design
1.2.5 荷叶离褶伞抗氧化活性测定
1.2.5.1 DPPH自由基清除活性测定 DPPH自由基清除活性参照文献[14],使用比色法进行测定,分别配制质量浓度为0、0.2、0.4、0.6、0.8、1.0 mg/mL多糖溶液,吸取50 μL不同质量浓度多糖溶液于96孔板中,再依次加入25 μL 0.4 mmol/L DPPH无水乙醇溶液,100 μL超纯水,振荡96孔板使得整个体系均匀,30 ℃在暗处反应30 min,于酶标仪571 nm处测定吸光值。VC作为阳性对照组。自由基清除率按照下面公式计算:
清除率(%)=[1-(A1-A2)/A0]×100
式中:A0为对照试验(水代替样品)吸光值;A1为样品试验吸光值;A2为样品干扰试验(无水乙醇代替DPPH溶液)吸光值。
1.2.5.2 ABTS自由基清除活性测定 ABTS自由基清除率参照文献[15]方法进行修改测定。将7 mmol/L ABTS溶液与4.95 mmol/L K2S2O8溶液按1∶1 (v/v)混合配制成ABTS+工作液,放置在室温暗处12 h后使用。ABTS+工作液用PBS(0.2 mol/L,pH7.4)稀释至734 nm下的吸光值在0.70±0.02左右。分别配制质量浓度为0、0.2、0.4、0.6、0.8、1.0 mg/mL多糖溶液,吸取200 μL ABTS+工作液于96孔板中,再加入20 μL不同浓度多糖溶液,混合均匀后于室温放置6 min,于酶标仪测定734 nm处的吸光度。以VC作为阳性对照组。自由基清除率按照下面公式计算:
清除率(%)=[1-(A1-A2)/A0]×100
式中:A0为对照试验(水代替样品)吸光值;A1为样品试验吸光值;A2样品干扰试验(PBS代替ABTS+工作液)吸光值。
1.3 数据处理
每组试验均重复3次。用SPSS 22.0软件对试验结果进行单因素及组间差异统计分析,数据以MEAN±SD表示,根据Design-Expert 10进行响应面试验设计,用Origin 8.5软件作图。
2 结果与分析
2.1 单因素实验结果
2.1.1 提取温度对荷叶离褶伞多糖得率的影响 由图1可知,在温度80~90 ℃之间,随着温度升高荷叶离褶伞多糖得率显著增加(P<0.05),温度在90 ℃时多糖得率最大,为5.32%,温度增加到95~100 ℃之间,多糖得率下降,与90 ℃相比有显著差异(P<0.05)。分析原因可能是80~90 ℃之间随着温度升高,分子之间运动加快,碰撞的几率增大,导致溶质溶出的速率增大以至于多糖得率增加[16]。95~100 ℃之间由于温度过高,多糖糖苷键遭到破坏,导致得率下降[17]。多糖得率随着温度上升先增大后减小的结论与崔凤杰等[18]灰树花多糖提取温度优化结果一致,同时温度过高还会使多糖部分功能活性丧失。因此选取90 ℃作为响应面试验的中心点。
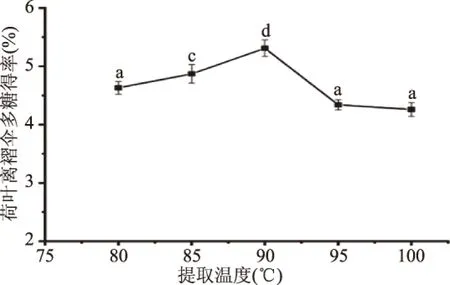
图1 提取温度对荷叶离褶伞多糖得率的影响Fig.1 Effect of extraction temperature on the extractionyield of Lyophyllum decastes(Fr.)Singer polysaccharides注:字母不同表示组间差异显著(P<0.05);图2~图4、图6~图7同。
2.1.2 提取时间对荷叶离褶伞多糖得率的影响 由图2可知,提取时间1~2 h内,多糖得率无显著差异(P>0.05),可能是由于提取时间较短多糖没有充分溶出[19]。与提取时间2 h相比,3 h多糖得率显著升高(P<0.05),达到最大值为5.29%,之后随着提取时间增加(3~4 h),多糖得率显著下降(P<0.05),在4~5 h趋于平稳。由于在荷叶离褶伞多糖不断溶出的同时,长时间的高温环境容易导致多糖结构被破坏,因而长时间提取会使多糖得率显著下降(P<0.05)[20]。在响应面优化试验设计中,选择提取时间为3 h作为中心点。
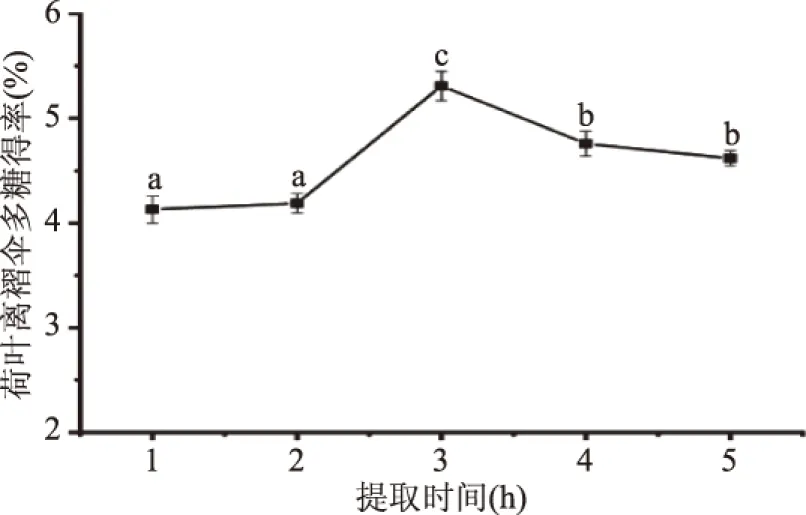
图2 提取时间对荷叶离褶伞多糖得率的影响Fig.2 Effect of extraction time on the extraction yield ofLyophyllum decastes(Fr.)Singer polysaccharides
2.1.3 提取液料比对荷叶离褶伞多糖得率的影响 由图3可知,当提取液料比在10∶1~30∶1 (mL/g)之间,随着液料比增大多糖得率显著增加(P<0.05),在液料比为30∶1 (mL/g)时多糖得率最大,为5.30%,之后增加液料比多糖得率无显著差异(P>0.05)。增加溶剂量有助于多糖溶出,但是考虑到经济成本以及试验工作量,选取30∶1 (mL/g)液料比作为最后优化试验的中心点。

图3 提取液料比对荷叶离褶伞多糖得率的影响Fig.3 Effect of ratio of water to material on the extractionyield of Lyophyllum decastes(Fr.)Singer polysaccharides
2.1.4 提取次数对荷叶离褶伞多糖得率的影响 由图4可知,与提取次数为1次相比,提取2次后多糖得率显著增加(P<0.05),随后增加提取次数多糖得率有所上升但是差异不显著(P>0.05),说明经过2次提取多糖已经充分溶于水中。因此将提取次数设定为2次作为后续响应面试验的参数。

图4 提取次数对荷叶离褶伞多糖提取得率的影响Fig.4 Effect of extraction times on the extraction yield ofLyophyllum decastes(Fr.)Singer polysaccharides
2.2 响应面试验
2.2.1 响因面试验结果与分析 以提取温度(X1)、提取时间(X2)、液料比(X3)作为自变量,荷叶离褶伞多糖得率(Y)为因变量,试验方案设计及响应值见表2,由结果分析得出响应变量和响应值之间的多元二次回归方程如下:
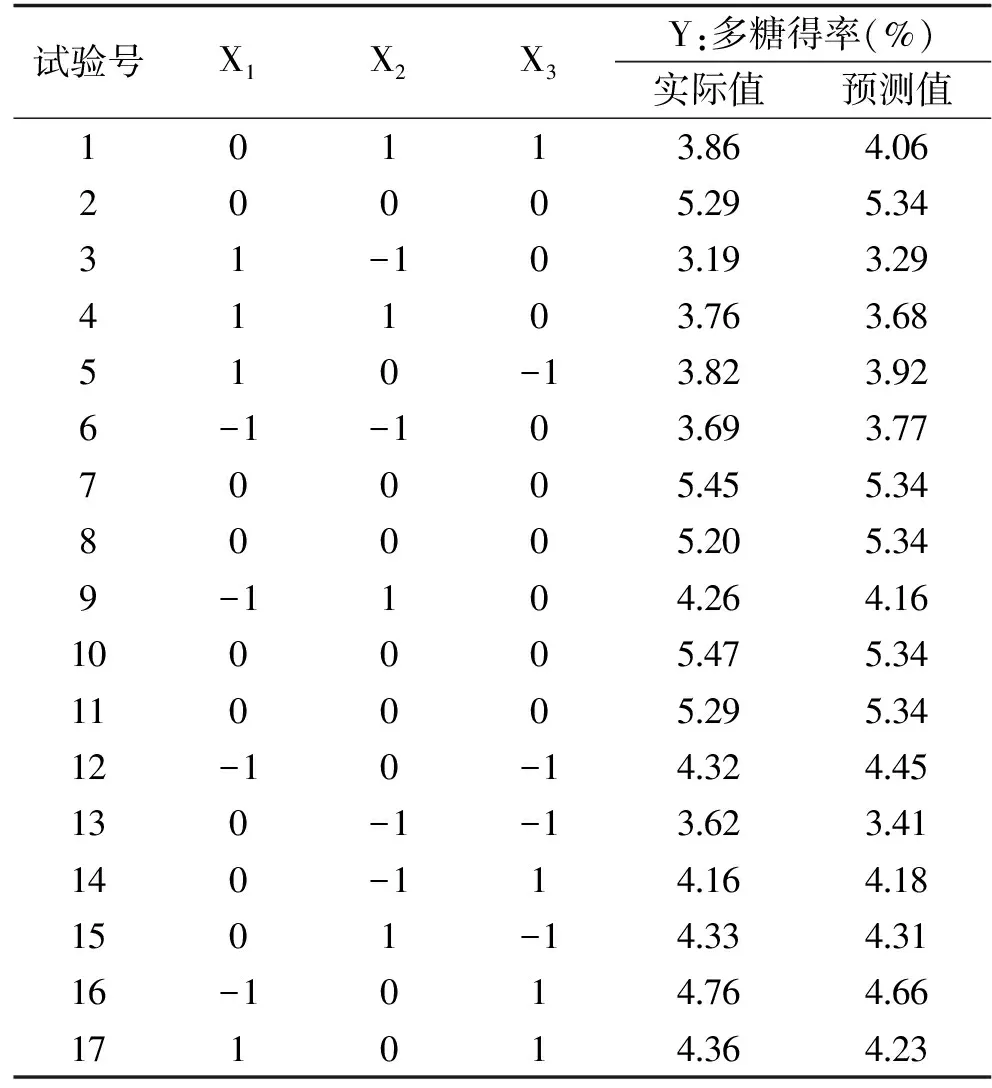
表2 响应面试验设计及结果Table 2 Design and results of response surface experiment
Y=-213.79500+4.59050X1+6.76375X2+0.27113X3+4.468×10-15X1X2+5×10-4X1X3-0.02520X2X3-0.025850X1X1-0.96875X2X2-0.00378750X3X3


表3 多元回归模型方差分析表Table 3 ANOVA for the quadratic polynomial model
2.2.2 响应面图与等高线图结果分析 等高线图呈现圆形代表两因素的交互作用对多糖得率没有显著性影响,呈现椭圆形则代表有显著影响,响应曲面坡度越陡峭,说明相应的两因素的交互作用对多糖得率影响就越大[22]。从图5的等高线图可以看出,提取时间与液料比两两交互对多糖的得率有显著影响。从响应曲面图看出,图5B、图5C比图5A的曲面要陡峭一点,说明X1提取温度和X3提取液料比交互作用、X2提取时间和X3液料比交互作用对多糖得率影响较大,与表3的结果相对应。

图5 提取温度、提取时间、液料比交互作用对荷叶离褶伞多糖得率影响的响应面图和等高线图Fig.5 Response surface plots and contour plots of the mutual effects of extraction temperature,extraction time and ratio ofwater to material on the extraction yield of Lyophyllum decastes(Fr.)Singer polysaccharides注:A:提取温度与提取时间,B:提取温度与提取液料比,C:提取时间与提取液料比。
根据 Design-Expert 10对试验结果分析得出对应的最佳工艺为:提取温度89.10 ℃、提取时间3.08 h、液料比31.41∶1 (mL/g),预测的最高得率为5.38%。考虑到实际操作过程方面,最后将条件设定为:提取温度89 ℃、提取3 h、液料比30∶1 (mL/g),在此提取条件下进行三次重复验证,得出荷叶离褶伞的最后的率为5.35%±0.12%,该得率与预测得率相差不大,说明该模型可用。
2.3 抗氧化活性
2.3.1 荷叶离褶伞多糖DPPH自由基清除能力测定 由图6可知,在质量浓度范围内,荷叶离褶伞多糖DPPH自由基清除率随浓度增大而增加,呈剂量依赖关系[23],在质量浓度为1.0 mg/mL时,DPPH清除率达到最大值,为45.87%±2.12%。由结果可知,荷叶离褶伞多糖对DPPH自由基的半抑制浓度IC50大于1.0 mg/mL,根据软件计算其IC50为1.40 mg/mL,说明荷叶离褶伞多糖对DPPH自由基有一定清除能力,冮洁等[24]等研究的羊肚菌菌丝体锌多糖抗氧化性试验中,也表明DPPH自由基清除能力与多糖质量浓度有关。因荷叶离褶伞多糖为酸性多糖且含有硫酸基,所以表现出较好的抗氧化能力。在Chen等[25]研究的苦瓜多糖结果也表明,苦瓜多糖中硫酸基可以提高抗氧化能力。图中对照组VC浓度在1.0 mg/mL时,清除率达到最大为100%,在试验的质量浓度范围内,样品组的DPPH自由基清除能力小于VC。
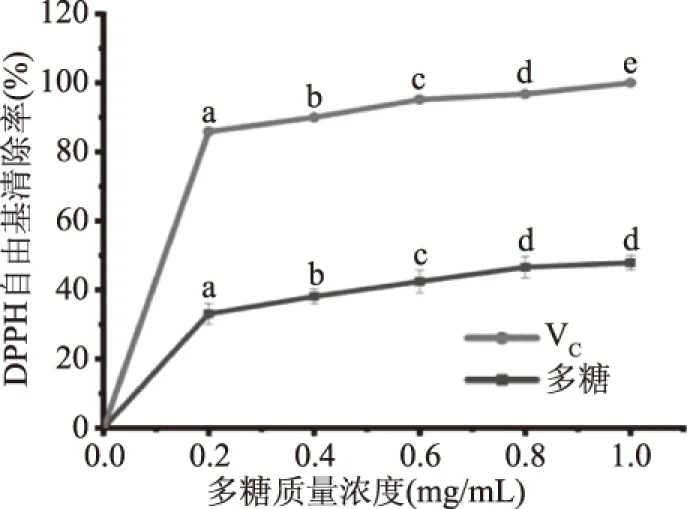
图6 荷叶离褶伞多糖对DPPH自由基清除能力Fig.6 DPPH radical scavenging capacity ofLyophyllum decastes(Fr.)Singer polysaccharides
2.3.2 荷叶离褶伞多糖ABTS自由基清除能力测定 由图7可知,在质量浓度为0~1.0 mg/mL范围内,荷叶离褶伞多糖ABTS自由基清除率随浓度增大而增加,同时量-效关系明显,在质量浓度为1.0 mg/mL时,ABTS自由基清除率达到最大值为76.49%±1.56%。由结果可知,荷叶离褶伞多糖对ABTS自由基的半抑制浓度IC50为0.44 mg/mL。与其他食用菌相比荷叶离褶伞多糖对ABTS自由基清除能力远高于真姬菇多糖[26]、香菇多糖[27]。VC对照组浓度在1.0 mg/mL时,清除率达到最大值,为100%。不同质量浓度多糖对ABTS自由基清除能力差异明显,但均小于VC对照组,这与Solomon等[28]研究的黄羽扇豆多糖对ABTS自由基清除能力的结论一致。与图6相比,多糖在相同质量浓度下对ABTS自由基清除率要大于DPPH。原因是ABTS自由基适合评价亲水性抗氧化剂,而DPPH自由基适合评价亲脂性抗氧化剂[29]。

图7 荷叶离褶伞多糖对ABTS自由基清除能力Fig.7 ABTS radical scavenging capacity ofLyophyllum decastes(Fr.)Singer polysaccharides
3 结论
在单因素实验的基础上,通过响应面试验优化得到荷叶离褶伞提取温度在89 ℃,提取时间为3 h,液料比为30∶1 (mL/g)时,多糖得率最大为5.35%±0.12%。抗氧化活性研究发现荷叶离褶伞多糖的抗氧化性随多糖浓度增加而增大,对DPPH、ABTS自由基的半抑制浓度IC50分别为1.40、0.44 mg/mL。具有较好的抗氧化能力,为天然抗氧化剂的开发提供了新的路径。荷叶离褶伞多糖作为一种应用前景广泛的生物活性物质,可以应用于更多领域。

