猕猴桃糖蛋白及其去糖链蛋白功能特性的研究
,*
(1.河南工业大学粮油食品学院,河南郑州 450001; 2.郑州大学农学院,河南郑州 450001)
猕猴桃,隶属于猕猴桃科(Actinidiaceae)、猕猴桃属(ActinidiachinensisPlanch)[1],具有较高营养价值,除了含有丰富的维生素C和多酚类物质外,还含有蛋白质、碳水化合物、矿物质和不饱和脂肪酸,被誉为“水果金矿”,具有降血脂、抑制肿瘤细胞、提高人体免疫等功能[2]。
糖蛋白是生物体内重要的生物活性物质,具有一定的抗肿瘤、抗氧化、降血糖等作用[3-4]。糖蛋白分子上的糖链不仅影响其功能特性,也同样影响其分子的高级结构和细胞间识别等生命活动[5],对细胞生物学[6]、蛋白质化学、生物技术及药物开发都具有重要意义[7-8]。目前,蛋白质性质受糖基影响的研究主要涉及蛋白质的糖基化和糖蛋白的去糖基两个方向。经糖基化反应,可提高绿豆蛋白清除DPPH自由基和羟自由基的能力[9],对于蛋白质维持啤酒泡沫稳定性方面起重要作用[10]。糖蛋白去糖基的方法主要有化学法、酶法和物理辅助法,去除糖基会改变糖蛋白的理化性质[11]和生物活性[12],目前的研究多集中于去糖基对酶活性的影响[13],而去糖基对糖蛋白功能特性的研究尚少。
本文通过比较在25~60 ℃范围内温度对猕猴桃糖蛋白(CGP)及其去糖链蛋白(GPP)吸油性、溶解性、起泡性和乳化性的影响,以及CGP、GPP的浓度及其溶液pH3~7.5和0~5 g/100 mL范围的NaCl离子强度对CGP和GPP溶解性、起泡性和乳化性的影响的研究,揭示去糖链前后猕猴桃糖蛋白功能特性的变化,以期初步解析糖蛋白和去糖链蛋白功能特性的差异。
1 材料与方法
1.1 材料与仪器
中华猕猴桃 市售;大豆油 益海嘉里集团;考马斯亮蓝G250 分析纯,上海沃凯化学试剂有限公司;牛血清白蛋白 纯度≥98%,北京奥博星生物科技有限公司;KBr、HCl 分析纯,科密欧化学试剂有限公司。
RE2000旋转蒸发器 上海亚荣生化仪器厂;SHB-B95循环水式真空泵 河南巩义予华仪器厂;DT5-4B型低速台式离心机 北京时代北利离心机有限公司;FD-1A-50真空冷冻干燥机 北京博医康;MS-H280-Pro磁力搅拌器 SciLogex Co.,Ltd.;DFD-700恒温水浴锅 天津市泰斯特仪器有限公司;PHS-3CpH计 仪电科学仪器有限公司。
1.2 实验方法
1.2.1 CGP、GPP的制备 CGP为本实验室制备猕猴桃糖蛋白(粗蛋白),CGP经β-消除反应后,浓缩,冷冻干燥,得到去糖链蛋白(GPP,糖含量未检出)[14]。
1.2.2 温度对CGP和GPP吸油性的影响 分别称取CGP和GPP 0.6 g,置于离心管中,加入10 mL大豆油,混匀后分别置于室温25、40、45、50、55、60 ℃水浴锅中30 min,4000 r/min离心10 min,测量上清液体积,原始大豆油体积减去上清液体积,即为蛋白质样品的吸油性[15],见式(1):
式(1)
其中,V为离心后上清液体积,mL。
1.2.3 温度、pH、离子强度对CGP、GPP溶解性的影响
1.2.3.1 温度对CGP和GPP溶解性的影响 CGP、GPP溶液分别置于温度分别为25、40、45、50、55、60 ℃水浴中60 min后,4000 r/min离心10 min。测定上清液中蛋白质含量,用所得含量占样品蛋白质含量的百分比来表示溶解度[16]。
1.2.3.2 pH对CGP和GPP溶解性的影响 CGP、GPP溶液分别用0.5 mol/L HCl调节pH为3、4、4.5、5、5.5、6、7.5后,4000 r/min离心10 min。测定上清液中蛋白质含量,溶解度表示方法同1.2.3.1。
1.2.3.3 离子强度对CGP和GPP溶解性的影响 CGP和GPP分别用0、0.25、0.5、1、2、3、4、5 g/100 mL的NaCl溶液溶解后,4000 r/min离心10 min。测定上清液中蛋白质含量,溶解度表示方法同1.2.3.1。
1.2.4 浓度、温度、pH、离子强度对CGP和GPP起泡性和泡沫稳定性的影响
1.2.4.1 CGP和GPP浓度对其起泡性和泡沫稳定性的影响 参考涂宗财等的方法[17],并加以调整,分别称0.5 g CGP、GPP,溶于50 mL蒸馏水中,分别制备浓度为0.2、0.4、0.6、0.8、1.0 mg/mL的溶液。分别使用磁力搅拌器混合均匀,测定泡沫高度并根据式(2)算出泡沫起泡性,稳定30 min后,再次测定泡沫高度,代入式(3)得泡沫稳定性。

式(2)
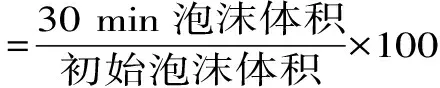
式(3)
1.2.4.2 温度对CGP和GPP起泡性和泡沫稳定性的影响 将CGP和GPP溶液分别置于温度分别为25、40、45、50、55、60 ℃水浴锅中30 min后,分别使用磁力搅拌器混合均匀,测定泡沫高度,同1.2.4.1计算起泡性及泡沫稳定性。
1.2.4.3 pH对CGP和GPP起泡性和泡沫稳定性的影响 将CGP和GPP溶液分别用0.5 mol/L HCl调节pH分别为3、4、4.5、5、5.5、6、7.5后,分别使用磁力搅拌器混合均匀,测定泡沫高度,同1.2.4.1计算起泡性及泡沫稳定性。
1.2.4.4 离子强度对CGP和GPP起泡性和泡沫稳定性的影响 将CGP和GPP溶液离子强度分别调为0、0.25、0.5、1、2、3、4、5 g/100 mL。分别使用磁力搅拌器混合均匀,测定泡沫高度,同1.2.4.1计算起泡性及泡沫稳定性。
1.2.5 浓度、温度、pH、离子强度对CGP和GPP乳化性及乳化稳定性的影响
1.2.5.1 浓度对CGP和GPP乳化性及乳化稳定性的影响 参考张根生等的方法[18],并加以调整,分别称取0.5 g CGP、GPP,溶于50 mL蒸馏水中,分别制备浓度为0.2、0.4、0.6、0.8、1.0 mg/mL溶液。分别取5 mL CGP、GPP溶液,加入5 mL大豆油,均质2 min,2000 r/min离心5 min,记录初始乳化层体积以及液体总体积,根据式(4)得出蛋白质乳化性,30 min后再以相同的转速离心5 min,记录乳化层体积以及液体总体积,并根据式(5)得出蛋白质乳化稳定性。

式(4)

式(5)
1.2.5.2 温度对CGP和GPP乳化性及乳化稳定性的影响 将 CGP和GPP溶液分别置于温度分别为25、40、45、50、55、60 ℃水浴锅中30 min后,加入5 mL大豆油,均质2 min,2000 r/min离心5 min,记录初始乳化层体积以及液体总体积,同1.2.5.1计算蛋白质乳化性及乳化稳定性。
1.2.5.3 pH对CGP和GPP乳化性及乳化稳定性的影响 将CGP和GPP溶液分别用0.5 mol/L HCl调节pH分别为3、4、4.5、5、5.5、6、7.5后,加入5 mL大豆油,均质2 min,2000 r/min离心5 min,记录初始乳化层体积以及液体总体积,同1.2.5.1计算蛋白质乳化性及乳化稳定性。
1.2.5.4 离子强度对CGP和GPP乳化性及乳化稳定性的影响 将CGP和GPP溶液离子强度分别调为0、0.25、0.5、1、2、3、4、5 g/100 mL,加入5 mL大豆油,均质2 min,2000 r/min离心5 min,记录初始乳化层体积以及液体总体积,同1.2.5.1计算蛋白质乳化性及乳化稳定性。
1.3 数据处理
本文中所有实验均平行测定三次,结果表示为平均值±标准偏差。并采用Origin 9.0处理数据、绘图。
2 结果与分析
2.1 温度对CGP、GPP吸油性的影响
CGP和GPP在不同温度下吸油性的变化如图1所示。由图1可知,在25~60 ℃范围内,CGP与GPP吸油性的变化趋势相近,均为先升高再降低再升高的趋势,不同温度下的CGP吸油性始终高于GPP。CGP在60 ℃时吸油率达到最高,吸油率为3.1 mL/g,25 ℃时吸油率最低,吸油率为1.63 mL/g;GPP在45 ℃时吸油率达到峰值,吸油率为2.08 mL/g,分别在25、55 ℃吸油率最低,吸油率为0.65 mL/g。

图1 CGP、GPP吸油性随温度变化Fig.1 The changes of CGP andGPP oil absorption with temperature
GPP为CGP去糖链的蛋白质,两者分子上氨基酸的排列顺序相同,由于CGP分子上糖链的存在,导致两者在相同体系中空间结构的不同,CGP吸油性高于GPP的结果暗示CGP的空间结构会暴露更多的疏水性基团[19-20]。在25~45 ℃范围内,随温度升高,两者的吸油性均升高,表明在此温度范围,温度升高使CGP与GPP的疏水基团暴露更多;在45~60 ℃范围内,CGP吸油性于50 ℃达到最低值,再于60 ℃达到最高值,GPP于55 ℃达到最低值后吸油性又增加。这意味着此温度范围内,CGP和GPP分子的空间结构均有一个疏水性降低又升高的过程,由于糖链的存在,CGP更容易在较低温度下发生疏水性的降低,疏水性升高的幅度大于GPP。
2.2 温度、pH、离子强度对CGP、GPP溶解性的影响
2.2.1 温度对CGP、GPP溶解性的影响 蛋白质的溶解度影响其界面性质,并对蛋白质在食品体系中的分子行为具有着重要的影响[21]。图2为CGP、GPP溶解度随温度、pH、离子强度的变化。结果表明,随温度的增高(25~60 ℃),CGP和GPP的溶解度均下降,且CGP溶解度高于GPP的溶解度,这与CGP分子上具有亲水性的糖链有关[22]。

图2 CGP、GPP溶解性随温度、pH、离子强度的变化Fig.2 The changes of CGP and GPP solubilitywith temperature,pH,and ionic strength注:a:温度;b:pH;c:离子强度。
2.2.2 pH对CGP、GPP溶解性的影响 随着pH的增高(pH3~7.5),CGP的溶解度始终高于GPP,CGP、GPP两种蛋白的溶解度出现先下降后上升的趋势,CGP的溶解度最低点出现在pH4时,溶解度40.4%,GPP溶解度最低点出现在pH4.5,溶解度26.6%,这主要由于缺乏静电推斥作用,疏水相互作用导致CGP和GPP的聚集[23]。
2.2.3 离子强度对CGP、GPP溶解性的影响 CGP、GPP的溶解度随着离子强度增高而平缓下降,离子强度高于0.5 g/100 mL时,CGP和GPP的溶解度变化缓慢,这表明,在0~0.5 g/100 mL的离子强度范围内,离子强度的增加改变了两者的空间结构,导致两者亲水性的降低,离子强度高于0.5 g/100 mL之后,对于两者分子空间结构的影响降低[24]。
2.3 浓度、温度、pH、离子强度对CGP和GPP起泡性及泡沫稳定性的影响
2.3.1 浓度对CGP和GPP起泡性和泡沫稳定性的影响 图3为CGP和GPP浓度对其起泡性和泡沫稳定性的影响。随CGP、GPP浓度升高,两者的起泡性均增高,且CGP起泡性高于GPP。浓度为0.4 mg/mL时,CGP和GPP的泡沫稳定性相同,高于和低于0.4 mg/mL时,GPP的泡沫稳定性高于CGP。这表明糖链的存在提高了CGP的起泡能力,使CGP分子更易于吸附至界面并在界面上重排;与GPP相比,浓度为0.4 mg/mL时糖链对泡沫稳定性没有影响,在实验范围的其它浓度条件下,糖链的存在反而降低了泡沫稳定性。

图3 蛋白质起泡性、泡沫稳定性随浓度变化Fig.3 The changes of protein foaming and foam stability with concentration注:a:起泡性;b:泡沫稳定性;图4~图6同。

图6 蛋白质起泡性、泡沫稳定性随离子强度变化Fig.6 The changes of protein foamability,foam stability with solution ionic strength
2.3.2 温度对CGP和GPP起泡性和泡沫稳定性的影响 图4为温度对对CGP和GPP起泡性和泡沫稳定性的影响。随着温度的增高,CGP、GPP的起泡性先降低后升高,均于25 ℃时具有最高的起泡能力,起泡性分别为54.1%和37.6%,40 ℃时具有最低的起泡能力,起泡性分别为18.1%和15.1%;CGP和GPP的泡沫稳定性在25 ℃时最高,50 ℃时均具有最低的泡沫稳定性,泡沫稳定性分别为51.8%和18.4%。这与温度升高导致两者亲水性降低与温度升高导致的疏水基团的暴露有关,分子上亲水性与疏水性的变化影响CGP和GPP吸附至界面的能力和界面重排的能力,从而影响了两者的起泡能力[25]。

图4 蛋白质起泡性、泡沫稳定性随温度变化Fig.4 The changes of protein foaming,foam stability with temperature
2.3.3 pH对CGP和GPP起泡性和泡沫稳定性的影响 图5为CGP、GPP起泡性和泡沫稳定性随pH变化情况。随着pH的升高,CGP、GPP的起泡性先下降后上升,且CGP的起泡性始终高于GPP,两者均于pH4时起泡性最低,起泡性分别为26.8%和2.4%,pH7.5时起泡性最高,起泡性分别为53.8%和37.4%。CGP、GPP泡沫稳定性大体呈先降低后升高的趋势,CGP在pH3时泡沫稳定性最高,泡沫稳定性分别为78.8%,pH5时泡沫稳定性最低,泡沫稳定性分别为17.4%;pH4时GPP泡沫稳定性最低,泡沫稳定性为17.4%,pH7.5时GPP泡沫稳定性最高,泡沫稳定性分别为73.8%。这表明不同pH条件下,CGP、GPP分子上电荷分布的变化影响两者的疏水性,从而影响两者的起泡性和泡沫稳定性[26]。

图5 蛋白质起泡性、泡沫稳定性随pH变化Fig.5 The changes of protein foaming,foam stability with pH
2.3.4 离子强度对CGP和GPP起泡性和泡沫稳定性的影响 图6为CGP、GPP起泡性和泡沫稳定性随离子强度的变化。CGP、GPP的起泡性随着离子强度变化趋势有较大差异,其中CGP的起泡性随着离子强度增高呈下降趋势;GPP起泡性随着离子强度的逐渐升高,呈现先下降后升高的趋势,NaCl浓度为2 g/100 mL时,GPP起泡性最低,起泡性为9.8%。CGP、GPP的泡沫稳定性随着离子强度变化趋势有较大差异,随着离子强度增高CGP的泡沫稳定性呈大幅度的先急剧增高后急剧降低再升高又下降增高的波动变化的趋势,在NaCl浓度为1 g/100 mL时,CPP的泡沫稳定性最低为38.4%;GPP的泡沫稳定性随着离子强度增高总体下降趋势,泡沫稳定性在NaCl浓度为5 g/100 mL时,GPP的泡沫稳定性最低为48.4%。
2.4 浓度、温度、pH、离子强度对CGP和GPP乳化性及乳化稳定性的影响
2.4.1 浓度对CGP和GPP乳化性及乳化稳定性的影响 CGP、GPP乳化性和乳化稳定性随浓度变化见图7。由图7可知,随着浓度的增高,CGP、GPP的乳化性均增高,两者均在1.0 mg/mL时乳化性最高,乳化性分别为32.4%和82.5% 0.2 mg/mL时乳化性最低,乳化性分别为12.4%和6.5%;CGP、GPP的乳化稳定性大体呈上升趋势,两者均在1.0 mg/mL时乳化稳定性最高,乳化稳定性分别为72.5%和73.4%、0.2 mg/mL时乳化稳定性最低,乳化稳定性分别为32.5%和50.4%;浓度高于0.8 mg/mL时,两者的乳化稳定性相近,表明此浓度之上,糖链对溶液体系中分子构象的影响较小。
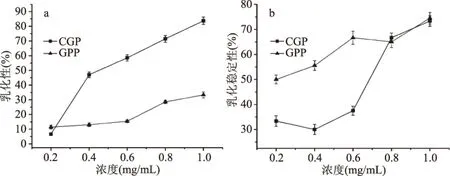
图7 蛋白质乳化性、乳化稳定性随浓度变化Fig.7 The charges of protein emulsification,emulsion stability with concentration注:a:乳化性;b:乳化稳定性;图8~图10同。

图8 蛋白质乳化稳定性随温度变化Fig.8 The changes of protein emulsification,emulsion stability with temperature

图10 蛋白质乳化性、乳化稳定性随离子强度变化Fig.10 The changes of protein emulsification and emulsion stability changes with ionic strength
2.4.2 温度对CGP和GPP乳化性及乳化稳定性的影响 图8为CGP、GPP乳化性和乳化稳定性随温度的变化。随温度的增高,CGP乳化性先降低后升高,GPP乳化性先升高后降低,40 ℃时,CGP乳化性最低,乳化性为46.5%,而GPP的乳化性最高,乳化性为41.4%;CGP和GPP的乳化稳定性随温度升高先升高后降低,50 ℃时CGP乳化稳定性最高,乳化稳定性为88.5%,45 ℃时GPP乳化稳定性最高,乳化稳定性为78.4%,60 ℃时CGP和GPP的乳化稳定性均最低,乳化稳定性分别为16.5%和47.4%。表明不同温度时,糖链的存在主要影响乳化性,在25~60 ℃范围内可提高乳化性和乳化稳定性,这主要由于糖链的存在提高了CGP的亲水性,提高了分子的柔性,利于CGP分子吸附于界面并在界面上的重排[27]。
2.4.3 pH对CGP和GPP乳化性及乳化稳定性的影响 图9为CGP、GPP乳化性和乳化稳定性随pH的变化。随pH的增高,CGP、GPP的乳化性为先下降后上升的趋势,且CGP的乳化性始终高于GPP,CGP、GPP乳化性最低点均出现在pH4.5,乳化性分别为14.5%和3.4%,pH的变化对CGP乳化性的影响高于对GPP的影响,表明在低于和高于pH4.5条件下,糖链的存在促进了蛋白质的乳化性。随pH的增高,CGP、GPP的乳化稳定性均先降低再升高,pH3时CGP的乳化稳定性最高,乳化稳定性为88.5%,pH4.5时CGP的乳化稳定性最低,乳化稳定性为56.5%;pH4时GPP的乳化稳定性最低,乳化稳定性为33.5%,pH7.5时GPP的乳化稳定性最高,乳化稳定性为60.5%;pH7.5时CGP和GPP的乳化稳定性相同,表明pH7.5时,糖链对乳化稳定性的影响较小[28]。

图9 蛋白质乳化性、乳化稳定性随pH变化Fig.9 The changes of protein emulsification,emulsion stability with pH
2.4.4 离子强度对CGP和GPP乳化性及乳化稳定性的影响 图10为CGP、GPP乳化性和乳化稳定性随离子强度的变化。CGP、GPP乳化性随着离子强度增高变化趋势差别较大,其中CGP的乳化性随着离子强度增高而逐渐降低,NaCl浓度在0~1 g/100 mL范围内,CGP的乳化性快速下降,1~5 g/100 mL范围内,CGP的乳化性缓慢下降;GPP的乳化性随着离子强度增高先增高后下降,NaCl浓度为2 g/100 mL时,GPP的乳化性最高,NaCl浓度5 g/100 mL时,CGP和GPP乳化性均最低;NaCl浓度为0~2 g/100 mL时,CGP与GPP的乳化性呈相反趋势,超过2 g/100 mL时,两者均呈下降趋势,这表明在此范围内,随离子强度的增加,糖链的存在会降低分子在界面的吸附能力,导致乳化性的降低[21]。NaCl浓度0~0.25 g/100 mL,CGP乳化稳定性急剧降低,糖链存在条件下,离子强度的变化对分子亲水性和疏水性的影响较大,从而影响界面的吸附膜的稳定性[21];0.25~2 g/100 mL主要在15%附近波动,表明此条件下,糖链的存在对分子在界面上形成吸附膜的影响较小[23];2~5 g/100 mL范围内,乳化稳定性先增高后下降,峰值位于NaCl浓度为3 g/100 mL处。NaCl浓度0~2 g/100 mL范围内,GPP的乳化稳定性为快速下降趋势;3~5 g/100 mL时,GPP乳化稳定性呈现先升高后降低趋势,峰值位于4 g/100 mL。
3 结论
在25~60 ℃的范围内,CGP吸油性明显高于GPP,去糖链处理降低了猕猴桃糖蛋白的吸油率。随温度的升高,CGP、GPP溶解度均下降,随pH增高(pH=3~6),CGP、GPP溶解度先下降后上升,随着离子强度增高,CGP、GPP溶解度平缓下降,GPP的溶解度始终低于CGP,去糖链处理明显降低了猕猴桃糖蛋白的溶解性。
CGP、GPP起泡性、泡沫稳定性、乳化性、乳化稳定性等性能明显受温度、pH、离子强度等条件的影响;去糖链处理对猕猴桃糖蛋白的起泡性、泡沫稳定性、乳化性和乳化稳定性等性能产生明显影响,但在不同的温度、pH、离子强度环境条件中去糖链处理影响猕猴桃糖蛋白质的趋势并不相同。

