表皮松解掌跖角化症一家系KRT9基因突变的分子遗传学研究
唐斌 潘小英 钟燕芳
(广东省妇幼保健院 医学遗传中心,广东 广州 511400)
表皮松解性掌跖角化症 (epidermolytic palmoplantar keratoderma,EPPK) 为常染色体显性遗传性皮肤病,其临床特征表现为掌跖角质层过度增厚。组织学特点为角质形成细胞空泡变性,大量裂解[1]。该病有并发乳腺癌或卵巢癌的风险。EPPK主要由位于17q12-q21上的KRT9基因突变所致[2]。KRT9基因的缺陷破坏了中间纤维的形成,导致细胞的结构及功能发生改变。国内EPPK病例从分子遗传学层面的研究并不多见。本研究在一个广东EPPK家系中检出KRT9基因 c.470T>C杂合突变(即p.Mer157Thr),现报道如下。
1 对象与方法
1.1 研究对象 本研究的表皮松解掌趾角化症家系来自广东梅州,家系成员5代60人(图1)。受累人数11人,男性9人,女性2人。获得家系成员知情同意后,采集7名患者及4名正常成员的5 ml静脉血于抗凝管中。随机抽取20例无血缘关系的正常人作为对照。未对患者掌跖病变的皮肤组织进行采样。
先证者(Ⅳ-9),女性,32岁。出生2个月开始发病,掌跖出现黄色弥漫性界限清楚的角化过度的皮损,头发、牙齿、指甲未见异常。先证者儿子(Ⅴ-5)同样也为EPPK患者,病变主要集中在掌跖。家系中首发者为先证者祖父(Ⅱ-4)。家族中Ⅲ-7和Ⅲ-8为近亲婚配,为先证者的双亲。Ⅲ-7和Ⅲ-8之间的亲缘系数为1/8,为堂兄妹婚配,属于三级亲属关系,其3名后代均健康长至成年。家系患者的发病年龄约为出生后两个月内,掌跖角化过度导致表皮干燥、皴裂,角化斑块似蛇皮状。通过表型观察,即使在同一个家系,表皮增厚的程度不同,表现度存在着差异(图2)。

图2 家系患者掌跖临床表征A、B:两手掌呈对称性弥漫角质化,黄色,有清晰的红斑边缘;C、D:双足与手掌相比,角质化程度更为严重
1.2 方法 通过美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI) 网站检索系统检索KRT9的mRNA序列。K9含8个外显子和7个内含子,只有1~7外显子编码蛋白。经过检索人类中间纤维突变库(http:∥www. interfil.org)得知,KRT9基因突变热区为外显子1。应用Primer 5和DNA star软件针对KRT9-350位点至内含子1之间的序列设计一对引物。正向引物:5’ -GGG CCA GCC AGA GAC CAG A-3’;反向引物:5’ -GAT CCC CAG AAA CCA AAC ACA AG-3’,扩增片段长度为1162 bp。配制PCR反应体系: 0.6 μl 的MgCl2(25 mM),1 μl的10×Buffer (10 mM),正反Primer(10 μM)各0.25 μl,0.2 μl 的dNTP Mixture(10 mM),0.25 μl 的Taq polymerase(5 U/μl),H2O定容至50 μl。PCR按以下条件扩增:变性:96 ℃变性5 min,然后95 ℃ 30 s、57 ℃ 30 s、72 ℃ 45 s,35个循环,然后72 ℃ 5 min延伸1个循环,4 ℃保温。琼脂糖电泳检测扩增效果。3100型自动基因分析仪(ABI公司)进行DNA测序。
2 结果
DNA测序结果显示在患者、家系成员和正常对照组中KRT9基因-99出现纯和(A/A)或杂合(G/A)的现象,作为一种多态性存在。此外,家系中的患者(IV-9、IV-20、IV-21、IV-22、IV-23、V-5、V-13)KRT9 基因第1外显子的第467位碱基发生T>C杂合突变,导致第156位甲硫氨酸被苏氨酸取代(p.Mer157Thr)。正常家系成员(IV-10、IV-11、V-4、V-6)和正常对照组中该位点未见突变。
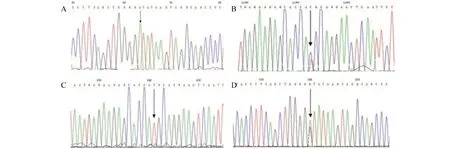
图3 KRT9基因测序结果
3 讨论
EPPK存在着遗传异质性,不同EPPK家系的临床表型存在差异。例如,有些伴发有指节垫,有些伴发有甲病变。本研究家系的患者掌跖角质化表现度不同,表皮增厚程度存在差异。国内关于EPPK的病例报道并不少见,但从基因水平上进行诊断的并不多。本研究应用聚合酶链式反应及DNA测序的方法,确诊到中国人群中的7例表皮松解掌跖角化症。该家系中7例患者的KRT9 基因第1外显子的第467位碱基发生T>C杂合突变,导致第156位甲硫氨酸被苏氨酸取代(p.Met157Thr)。且在非编码区检测到KRT9基因-99位点存在多态性。目前已在85个EPPK家系中检测到了29种不同的KRT9基因突变(http:∥www.interfil.org)。与本文检出为同一突变类型的4个家系在1998年和2009年有报道,检出地来自北爱尔兰、巴基斯坦和中国[3,4,5]。
角蛋白9分子(keratin 9,K9)属于Ⅰ型角蛋白,K9结构模式从氨基端到羧基端被分为头、杆、尾3个区域。其中杆区含有4个α螺旋结构的亚区(1A、lB、2A和2B)[6]。KRT9基因突变热区位于杆状功能域1A区前端的15个氨基酸和2B区末端的10~11个氨基酸,即螺旋起始基序(helix initiation motif,HIM)和螺旋终末基序(helix termination motif,HTM)[7]。在Fuchs-Telem等[8]报道一例KRT9基因突变为 p.[Leu11Val; Leu11_Gln172del]的类型以前,检出EPPK家系突变位点通常局限在HIM和HTM。该病例的突变区域包含了1A及K9非螺旋区的头部,打破了以往KRT9基因突变位点通常只在1A和2B区域检出的观念。本研究病例的突变区域位于杆状结构域的1A, K9分子第156位的甲硫氨酸被苏氨酸取代,导致疏水性氨基酸被极性氨基酸所替代。氨基酸理化性质的改变,引起螺旋构象的高度破坏,造成角蛋白亚单位受损,从而影响角蛋白中间丝的聚集,产生相应的临床表现。
人类K9第156位密码子编码的是甲硫氨酸,为杆状功能域1A区的第一个氨基酸。该家系KRT9第156位密码子发生突变也是EPPK家系中发生突变的热区,如p.Met157Val、p.Met157Lys、p.Met157Arg[9-12]。将以下5种不同物种角蛋白与人类K9序列进行ClustalW多序列比对:类人猿(Pan troglodytes,蛋白序列号XP511488.2)、家犬(Canis familiaris,蛋白序列号NP001014307.1)、小鼠(Mus musculus,蛋白序列号NP957707.1)、沟鼠(Rattus norvegicus,蛋白序列号NP703206.1)和原鸡(Gallus gallus,蛋白序列号XP418163.2)。生物信息学分析结果显示位于杆状功能域1Aα-螺旋区的第一位甲硫氨酸在进化上是高度保守的(图4)。与此同时,将K9与Ⅰ型角蛋白超家族成员序列进行ClusatlW多序列比对,在12种Ⅰ型角蛋白中相对应的位置上全为甲硫氨酸,显示K9第157位氨基酸具有高度同源性(图5)。经过在不同物种和超家族中进行多序列比对,显示突变的位点具有高度保守性和同源性。KRT9在高度保守和同源性的位点发生突变,破坏了中间纤维构成正常的细胞骨架,这是导致掌跖角质化临床表现的主要原因。

图4 KRT9氨基酸序列比对
综上所述,该家系检出KRT9基因 c.470T>C杂合突变是导致EPPK主要原因。与已经国内外报道的种族或民族相似,突变位点位于热区HIM,进一步丰富了KRT9基因突变图谱。

图5 Ⅰ型角蛋白同源性分析结果

