濒危植物大花黄牡丹根际土壤中一株青霉菌的分离与鉴定
禄亚洲 张二豪 尹秀
摘要 [目的]从西藏林芝县米瑞乡大花黄牡丹根际土壤中分离耐盐青霉菌菌株,并对其分类地位进行鉴定。[方法]采用高盐察氏培养基从大花黄牡丹根际土壤中分离青霉菌菌株,通过形态学观察和rDNA转录间隔序列ITS测序的方法进行鉴定。[结果] ZP-01菌株菌落无特定形态,镜下可见扫帚状结构,属于青霉菌(MF942929.1),同源性达99%。[结论]耐盐青霉菌ZP-01在濒危植物大花黄牡丹根际土壤微生物群落组成结构研究中具有重要意义。
关键词 根际土壤;青霉菌;分离;鉴定
Abstract [Objective] To isolate Penicillium strain from the rhizosphere soil of Paeonia ludlowii in Mirui Township, Tibet, and identify its taxonomic status. [Method] The high salt Czapek s medium were used to isolate Penicillium strain from the rhizosphere soil of Paeonia ludlowii and identified by morphology and ITS sequencing. [Result] ZP01 formed membranous colony, the typical broom shaped penicillus was found under the microscope, after ITS sequencing, the homology of the Penicillium (MF942929.1) was 99%. [Conclusion] Salttolerant Penicillium ZP01 plays an important role in the study of soil microbial community structure in the rhizosphere of endangered plant Paeonia ludlowii.
Key words Rhizosphere soil;Penicillium;Isolation;Identification
青霉菌(Penicillium)属于半知菌门丝孢菌纲的微生物[1]。因肉眼可观其孢子颜色为蓝绿色而得名。但并非所有青霉属的霉菌都为蓝绿色,也有白色或绿色[2]。常见于腐烂的水果、蔬菜、肉食及衣履上。笔者从大花黄牡丹根际土壤中分离得到一株青霉菌,并对其进行鉴定,旨在为大花黄牡丹根际土壤微生物种群及其多样性研究提供理论依据。
1 材料与方法
1.1 材料
大花黄牡丹植物根际土壤采集于西藏林芝市林芝县米瑞乡(94°38′33.03″ E,29°32′43.96″N),所有样品均随机采取并混匀,每组3个重复,将采集的样品放置无菌袋中低温保存带回实验室,12 h内处理。
1.2 方法
菌种分离所用培养基为高盐察氏培养基。采用土壤稀释涂布法从大花黄牡丹土壤中分离微生物,将涂布好的高盐察氏培养基平板倒置放于28 ℃的恒温箱中培养5~7 d。 待培养皿上生长出不同菌落时,采用平板划线法纯化菌种,获得纯培养后制片镜检,并保存菌种。
利用ITS1和ITS4引物对真菌rDNA的ITS区域进行PCR扩增。PCR扩增采用20 μL反应体系:10×PCR Buffer 2.0 μL,5 mmol/L dNTPs 1.0 μL,5 μmol/L IST1-F引物1.0 μL,5 μmol/L IST4-R引物1.0 μL,rTaq Polymerase 0.2 μL,Template DNA 1.0 μL,补ddH2O至20 μL。PCR扩增条件:94 ℃ 5 min,30个循环(95 ℃ 30 s,56 ℃ 30 s,72 ℃ 1 min),72 ℃ 10 min,4 ℃保存。PCR产物用1%琼脂糖凝胶电泳检测,并纯化PCR产物,将纯化后的PCR产物送至上海美吉测序。
2 结果与分析
2.1 菌种的分离
通过稀释涂布法从大花黄牡丹根际土壤中分离出一株霉菌,将其编为ZP-01,选定ZP-01作为进一步研究对象。
2.2 霉菌ZP-01的鉴定
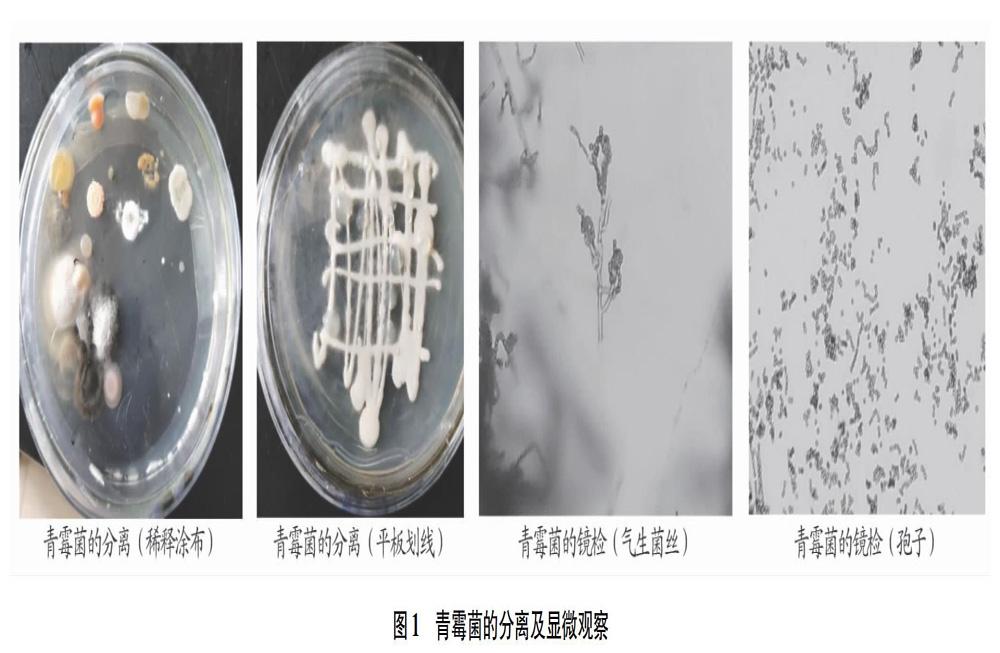
2.2.1 形態学观察。菌丝在培养基内外能广泛蔓延,无假根或匍匐菌丝,不产生定形菌落。菌丝生长直立的多细胞分生孢子梗。梗的顶端不膨大,但具有可继续再分的指状分枝,每枝顶端有2~3个瓶状细胞,其上各生一串灰色分生孢子(图1)。
2.2.2 真菌ITS序列的PCR扩增、测序及系统发育分析。
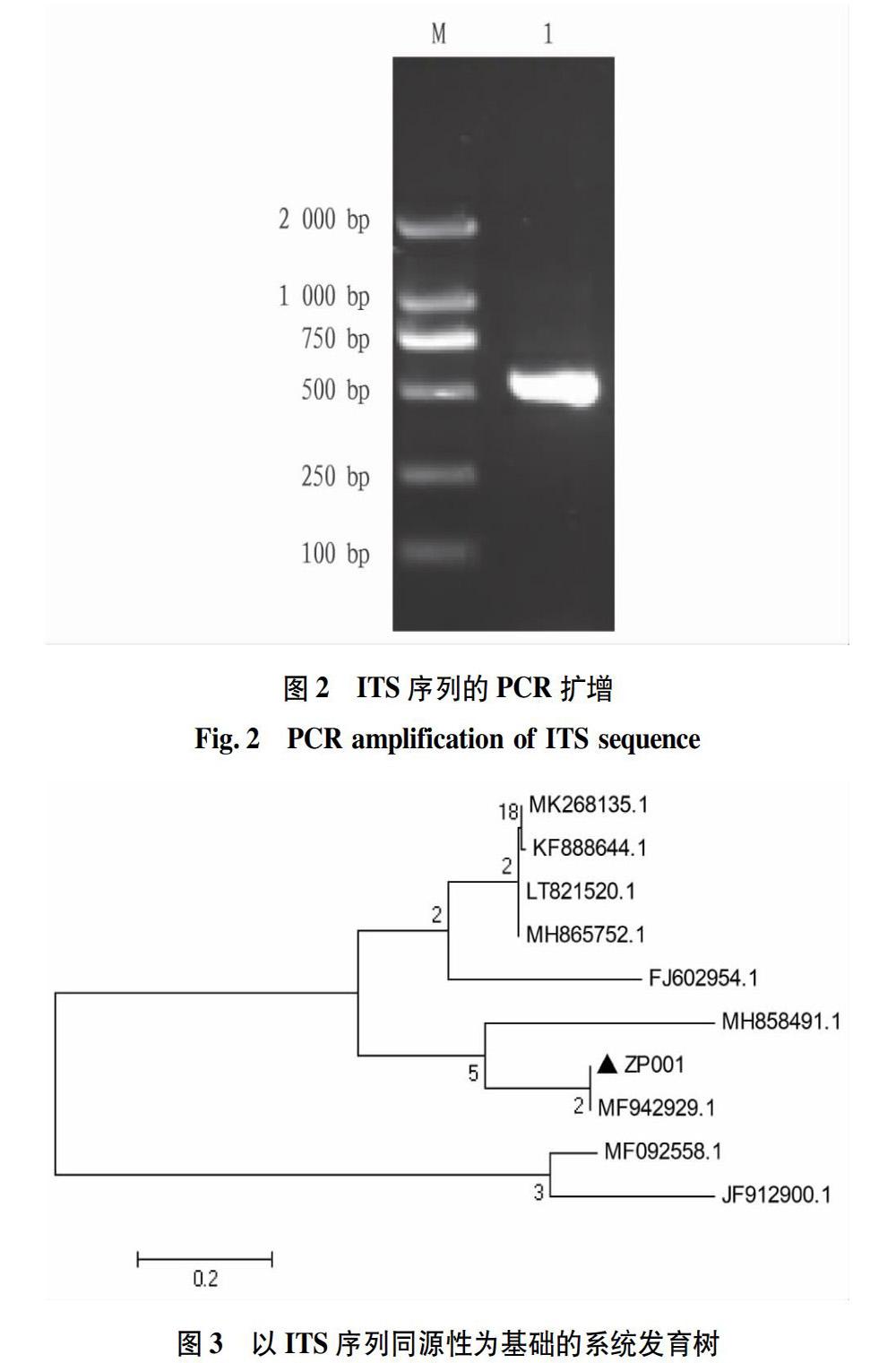
以菌株ZP-01总 DNA 为模板,ITS1、ITS4为引物,进行PCR扩增,得到约500 bp 的特异性扩增条带(图2),图2中2号条带为菌株ZP-01 PCR产物目标条带,PCR结果表明该菌为真核微生物,然后将纯菌种穿刺送至上海美吉测序。
将测序结果,经过Blast比对,结果表明该菌属于青霉属。根据同源性比对结果,通过 Mega 5.0软件构建系统发育树(图3)。结果表明ZP-01与青霉属(Penicillium sp.)真菌聚在一群,其同源性均在 97%~99%,其中,ZP-01菌与Penicillium halotolerans(MF942929.1)的同源性最高,达99%,根据形态学观察及系统发育分析,鉴定该菌为耐盐青霉菌(Penicillium halotolerans)。
3 结论与讨论
从大花黄牡丹根际土壤中分离得到的菌株ZP-01,通过显微观察和分子鉴定为真核微生物,ZP-01与青霉属(Penicillium sp.)真菌聚在一群,其同源性均在 97%~99%,其中,ZP-01菌与Penicillium halotolerans(MF942929.1)的同源性最高,达99%,根据系统发育分析,鉴定该菌为耐盐青霉菌(Penicillium halotolerans)。
淡紫拟青霉菌能产生类植物生长素,对植物具有防病促生作用[3]。任文彬[4]研究表明,淡紫拟青霉E2-4野生型菌株的孢子悬浮液对线虫卵囊的孵化有抑制作用,用此菌制备的固体菌剂对番茄根结线虫有较好的防治效果。肖马云[5]研究发现淡紫拟青霉菌对香蕉枯萎病菌有显著的抑制作用,有较好的防治效果,该菌及其生物肥药在香蕉根系土壤和根围还有较强的定殖能力。研究表明淡紫拟青霉菌剂对不同时期烟草生长均具有促生效果,在一定程度上提高烟草品质,并显著增加烟草产量[6]。
部分青霉菌株在土壤中有较好的溶解磷作用。何迪等[7]、龚明波等[8]研究发现草酸青霉菌HB1具有分解纤维素和溶解土壤中固定态磷的双重功能,还发现不仅对单子叶植物还是双子叶植物都具有促进植物生长的作用。青霉菌与生物炭复合修复可以降低有效砷含量,并使砷污染土壤中的微生物环境有所改善,对砷污染土壤显示出较好的修复性能[9]。
根系土壤是微生物的重要栖息地。不同来源的土样中,微生物的种类和数目有很大差异[10]。根际是植物生长过程中微生物、植物和土壤互相作用,同时也是微生物生长的特殊生态环境[11-14]。
参考文献
[1] 张和平,张列兵.现代乳品工业手册[M].北京:中国轻工业出版社,2005:322-323.
[2] 张先富.一株青霉菌的分离、鉴定及对减轻苹果连作障碍的效果[D].泰安:山东农业大学,2016.
[3] 夏汉祥,廖美德,周靖,等.淡紫拟青霉产类植物生长素的研究[J].西北农林科技大学学报(自然科学版),2011,39(3):97-102.
[4] 任文彬.淡紫拟青霉E2-4生防效果分析及其根癌农杆菌介导的遗传转化[D].儋州:华南热带农业大学,2007.
[5] 肖马云.淡紫拟青霉菌剂研发及其生物肥药对香蕉枯萎病防治效果研究[D].福州:福建农林大学,2012.
[6] 胡晓云,周思,贺玉广,等.淡紫拟青霉菌剂对烟叶生长的促进作用及其在生产中的应用[J].西南农业学报,2018,31(5):973-979.
[7] 何迪,赵全利,耿丽平,等.草酸青霉菌HB1活化土壤磷及改善土壤生物学性状研究[J].华北农学报,2019,34(1):172-180.
[8] 龚明波,范丙全,王洪媛.一株新的溶磷棘孢青霉菌Z32的分离、鉴定及其土壤定殖与溶磷特性[J].微生物学报,2010,50(5):580-585.
[9] 段靖禹,李华,马学文,等.青霉菌与生物炭复合修复土壤砷污染的研究[J].环境科学学报,2019,39(6):1999-2005.
[10] 楊利珍.一株青霉菌的分离鉴定及次级代谢成分研究[D].杨凌:西北农林科技大学,2009.
[11] 牛四坤.不同作物伴生对连作黄连产量和根际土壤微生物群落的影响[J].河南农业科学,2020,49(1):52-60.
[12] 刘秉儒,牛宋芳,张文文.荒漠草原区土壤粒径组成对柠条根际土壤微生物数量及酶活性的影响[J].生态学报,2019,39(24):9171-9178.
[13] 郭潇潇,王雪莱,梁海芸,等.盐碱胁迫对芸豆根际土壤微生物数量及酶活性的影响[J].华北农学报,2019,34(4):148-157.
[14] 张迎春,颉建明,李静,等.生物有机肥部分替代化肥对莴笋及土壤理化性质和微生物的影响[J].水土保持学报,2019,33(4):196-205.

