文蛤和菲律宾蛤仔血细胞的图像流式分类分析
任星潮 李荣 张宁

摘要 [目的]探討新型图像流式细胞仪在贝类血细胞分类中的应用。[方法]建立了一种基于血细胞侧向散射强度和面积测量的自动化方法,并与显微观察对比其在文蛤和菲律宾蛤仔血细胞分类中的效果。[结果]参考显微镜下可辨识的胞内颗粒结构,2种贝类的血细胞均可分为无颗粒、小颗粒及大颗粒3类,但基于人工辨识的统计结果缺乏量化标准,因此波动较大。图像流式细胞仪通过定量分析可以获得更精细、准确的测量结果。根据侧向散射强度和面积差异,将文蛤和菲律宾蛤仔的血细胞分成无颗粒、小颗粒、中颗粒及大颗粒4类,占比分别为(6.59±1.11)%和(30.03±1.87)%、(34.85±2.95)%和(58.50±5.73)%、(21.95±0.75)%和(6.03±1.44)%、(36.75±4.75)% 和(5.36±2.38)%。2种贝类血细胞都呈现出由无颗粒细胞到大颗粒细胞逐渐增大的趋势。[结论] 2种方法的分析结果既有联系又不完全一致。相较于显微观察,图像流式细胞仪利用精确的量化标准可辨识出更多的细胞类群,提示综合利用不同的特征差异还可以获得更精细的分类结果。此外,自动化的定量测量准确性好、通量高,是今后贝类血细胞分析的重要方法。
关键词 文蛤;菲律宾蛤仔;血细胞;分类;流式细胞仪
Abstract [Objective] To discuss the application of a new kind of imaging flow cytometer in the classificatioin of shellfish hemocyte. [Method] An automated method based on the measurement of blood cell lateral scattering intensity and area was established,and its effect on hemocyte classification of Meretrix meretrix and Ruditapes philippinarum was compared with microscopic observation. [Result] Both of the hemocytes from the above shellfishes could be divided into 3 hemocyte populations of nongranular, smallgranular and largegranular hemocyte by microscopic observation according to the differences of distinguishable intracellular particles, but the proportions fluctuated due to lacking of quantitative criteria. More accurate results could be acquired by using a quantitative measurement of imaging flow cytometer. According to the difference of the side scattering intensity and area, the hemocytes of M. meretrix and R. philippinarum were divided into four types: nongranular, smallgranular, intermediategranular and largegranular hemocytes, and their populations in M. meretrix and R. philippinarum were (6.59±1.11)% and (30.03±1.87)%, (34.85±2.95)% and (58.50±5.73)%, (21.95±0.75)% and (6.03±1.44)%, (36.75±4.75)% and (5.36±2.38)% respectively. The cell size increased gradually from R1 to R4 for each shellfish.[Conclusion] Although there are differences between the consistencies between two methods still could be found. Compared with microscopic observation, the image flow cytometer can identify more cell groups by using precise quantification standards, suggesting that more refined classification results could be obtained by using comprehensive use of different feature differences. In addition, automated quantitative measurement had good accuracy and high throughput,it is an important analysis method for blood cells of shellfish in the future.
Key words Meretrix meretrix;Ruditapes philippinarum;Hemocyte;Classification;Flow cytometer
文蛤(Meretrix meretrix)和菲律宾蛤仔(Ruditapes philippinarum)同属软体动物门双壳纲帘蛤目帘蛤科,是我国重要的经济贝种[1]。随着养殖规模的不断扩大,养殖环境跟不上发展的矛盾越来越突出,病害也日趋严重,给贝类养殖业造成了巨大的经济损失。文蛤、菲律宾蛤仔以及其他贝类都具有开放式循环系统,免疫防御基于血细胞为基础的细胞和体液系统。一方面,血细胞通过吞噬各种有机和无机等颗粒和异物,清除异物、病原以及自身损伤或死亡细胞;另一方面,血细胞还可以持续或应激产生各种必要的体液因子来调节免疫水平,调动防御系统参与宿主的免疫应答过程[2-4],因此血细胞是免疫系统研究的核心,既参与了细胞免疫又是体液免疫的物质基础。分类是功能研究的基础,长期以来关于贝类血细胞的分类一直存在不同的看法,长期缺乏统一的命名及量化标准[5-6]。有人将其分为无颗粒细胞、小颗粒细胞及大颗粒细胞3类,也有人认为还应划分出浆细胞作为第4类血细胞。人工辨识和常规流式细胞仪通常可以将贝类血细胞划分为2~3种。为了更准确地开展贝类血细胞功能解析,笔者尝试采用新型图像流式细胞仪开展贝类血细胞分析,以期清晰地区分出各个血细胞类群。
1 材料與方法
1.1 试验材料与试剂
1.1.1
试验材料。试验用文蛤和菲律宾蛤仔购自天津市王顶堤水产批发市场。文蛤壳长(48.6±5.4)mm,菲律宾蛤仔壳长(35.2±4.6)mm,置于实验室循环养殖系统暂养,盐度为(20±1)‰,水温为(20±1)℃。暂养5 d后,选择活力旺盛、体表无明显伤残的个体用于试验。
1.1.2 试剂。
多聚甲醛购自生工生物工程(上海)股份有限公司,其他试剂均为国产分析纯。
1.2 试验方法
1.2.1 细胞悬液的制备。
用一次性注射器,按抗凝剂与血淋巴体积1∶1从文蛤或菲律宾蛤仔后闭壳肌处分别抽取血淋巴,迅速混匀后转入1.5 mL离心管中,加入等体积的4%甲醛溶液分散重悬,冰浴固定5 min,经PBS洗涤后用吸头小心吹散,4 ℃下保存备用。
1.2.2 显微镜观察。
将上述2种贝类血细胞细胞悬液分别制备滴片,用Leica DM5000型显微镜观察、照相,根据胞内可辨颗粒的大小和含量差异对细胞归类,并进行相关的统计和分析。
1.2.3 图像流式细胞仪测量。
试验所用的图像流式细胞仪为Merck Millipore公司的FlowSight型,具有全新设计的管路系统,适宜各种混合样品的快速分析,不易堵柱,同时可以采集每个样品在明场及暗场各通道的实时图像,便于比对印证,省去了回收检测的操作。将前述固定、洗涤处理的细胞悬液经70 μm细胞筛过滤,去除黏连细胞团,上机检测,每个样品采集30 000个样点的测量数据和图像,使用IDEAS Application软件进行数据处理和分析。
2 结果与分析
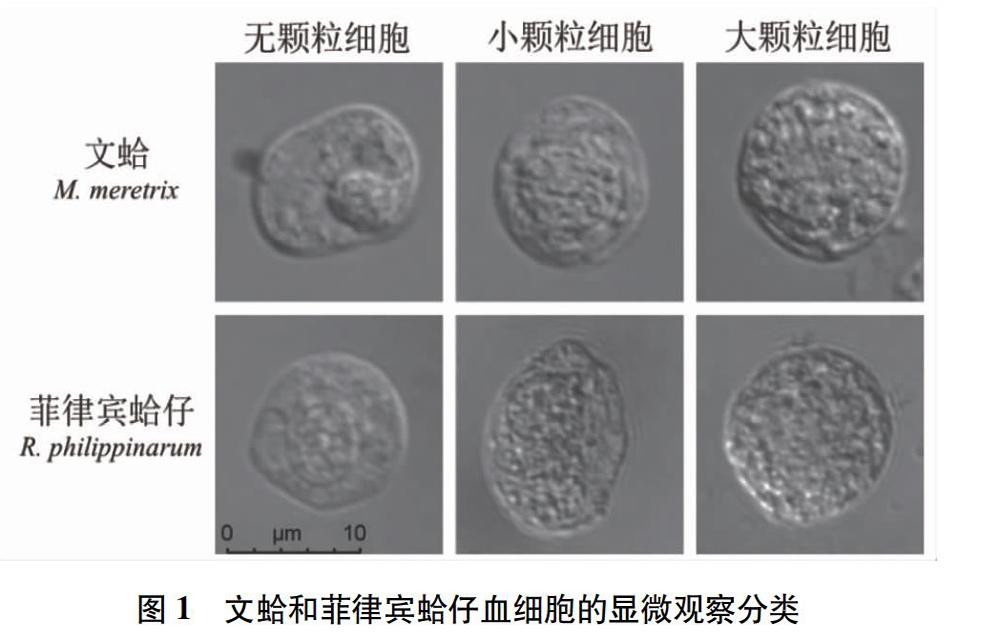
2.1 文蛤和菲律宾蛤仔血细胞的显微观察和分类
文蛤和菲律宾蛤仔血细胞的形态在显微镜下很相似,主要为椭圆形或近圆形,大小也较接近,部分细胞内可见明显的颗粒结构,可以根据颗粒大小和数量将2种贝类血细胞分为无颗粒细胞、小颗粒细胞和大颗粒细胞3种。无颗粒细胞以胞内没有明显可辨的颗粒为特征,细胞核清晰易辨。小颗粒细胞内含有数量不等的细小的颗粒,粒径约占细胞直径的5%~10%,颗粒数量范围变化较大,部分细胞核被颗粒遮挡。大颗粒细胞内则多充满大型颗粒,粒径通常较均匀,约为细胞直径的10%左右,细胞核多被颗粒完全遮挡(图1)。分类统计结果显示,2种贝类的无颗粒细胞占比统计较为接近,含有颗粒的血细胞在2种贝类血液中的占比均较大,其中文蛤的大颗粒细胞及菲律宾蛤仔的小颗粒细胞含量在各自全部血细胞中的占比均超过50%(表1)。
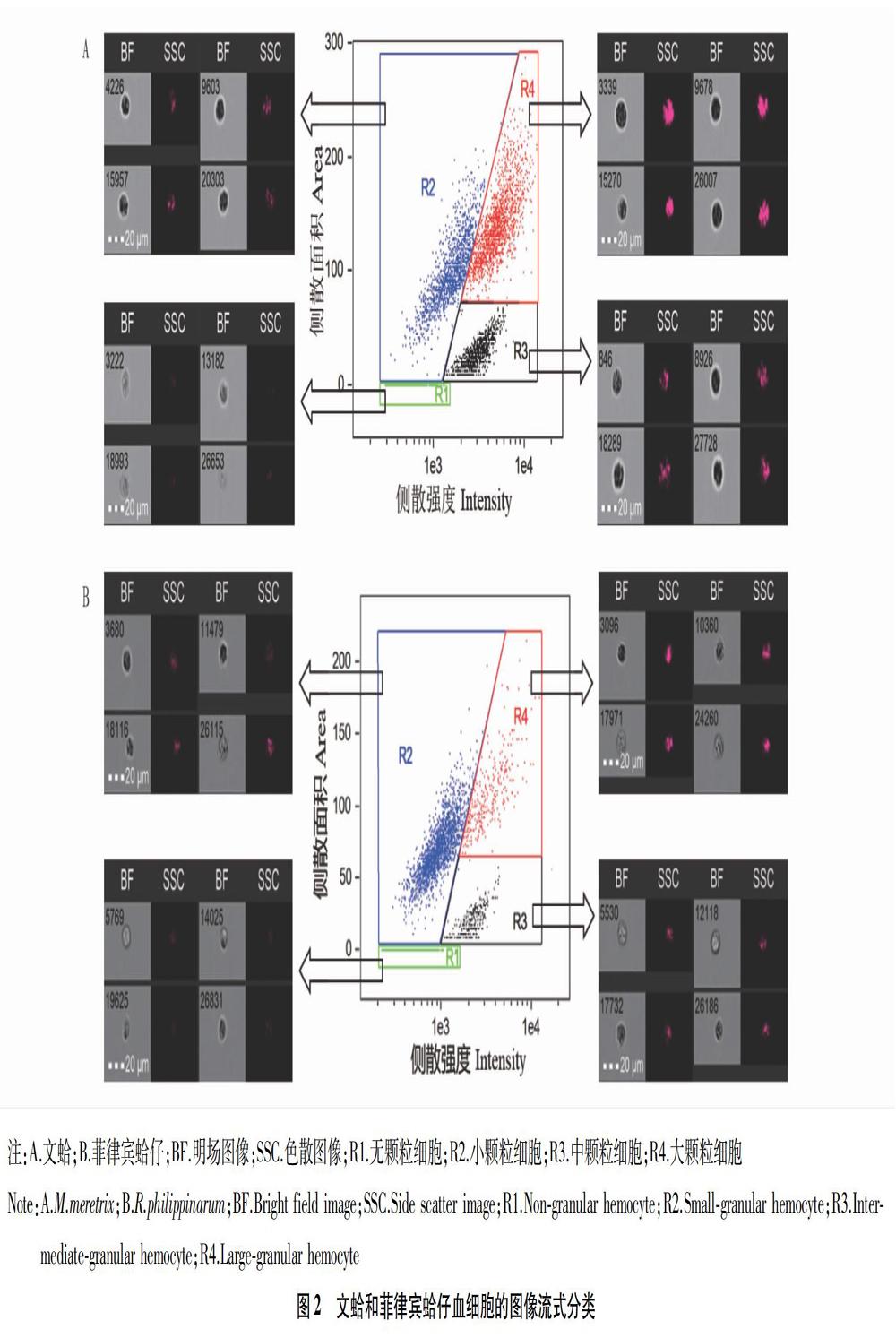
2.2 文蛤和菲律宾蛤仔血细胞的图像流式测量和分类
采用图像流式细胞仪测量文蛤和菲律宾蛤仔的血细胞及颗粒特征,所反映的是贝类血细胞内全部颗粒及其结构的综合差异。通过对比各项测量参数和分析策略,确定优化方案如下:以侧向散射强度和面积为横坐标、纵坐标绘图,根据单细胞样点聚集情况划定各类群设门边界,并结合同步采集的图像进行比较分析。2种贝类血细胞类群分布具有明显的一致性,均可聚集为4个类群,且边界清晰。综合量化分析获得的颗粒特征及辅助图像,将2种贝类的血细胞划定为无颗粒细胞、小颗粒细胞、中颗粒细胞和大颗粒细胞4种,分别用R1、R2、R3和R4表示(图2)。R1类群位于散点图底部,散射面积极小,说明几乎不含颗粒结构,属于无颗粒细胞。同步采集的图像显示胞内缺乏折光物质。R2类群的侧向散射面积较大,但强度相对略低,表明其中含有较多颗粒,但颗粒结构总体不够复杂,属于小颗粒细胞;辅助图像表明胞内具有较明显的折光组分。R3类群侧向散射面积不大,但具有较大的侧散强度表明其胞内的颗粒占比不大,但结构较为复杂,归为中颗粒细胞;同步获得的图像提示其中可见颗粒不显著,但折光性很强,与侧向散射的测量提示吻合。R4类群位于散点图右上方,表明胞内富含颗粒且颗粒结构最复杂,属于大颗粒细胞,其侧向散射通道的图像也可见胞内充满高折光物质。以无颗粒细胞的平均大小为基准,分别测量、对比各类细胞发现,2种贝类中的4种血细胞都呈现出从R1到R4类型逐渐增大的趋势。另外,文蛤和菲律宾蛤仔的各类群细胞比例存在较大差异,前者无颗粒细胞占比很小,其他3类细胞比例较为接近,后者血淋巴中以无颗粒和小颗粒细胞占比较大(表2)。
3 结论与讨论
由于分析方法差异,贝类的血细胞分类一直存在不同的观点,同一种贝类的细胞种类和比例在不同研究中也有差异,其中一个主要原因就是缺乏一致认同的量化标准。对于以功能研究为目标的血细胞分类分析来说,基于细胞表面抗原特征的检测方法是较为通用的,但无脊椎动物血液研究方面缺乏特定的分类抗体,因此严重制约了其细分功能的深入分析。
流式测量是目前较为有效的定量方法,但常规流式受限于其测量参数和测量范围,对无脊椎动物血细胞分析尚在摸索阶段。该研究比较了常规显微观察与新型流式细胞仪对文蛤及菲律宾蛤仔血细胞的分类情况。2种方法都能够根據细胞内颗粒状况将血细胞分为不同的类群,但分类结果不尽相同。显微观察是最为常用的分类手段,通过对血细胞内可见颗粒的大小及含量的人工辨识来区分细胞类别,2种贝类的血细胞都可据此分为无颗粒细胞,小颗粒细胞及大颗粒细胞3种,其中含有颗粒的细胞总数占比很大,与Chang等[7]和刘东武等[8]对文蛤和菲律宾蛤仔的观察结果相近,但Zhang等[9]和王文琪等[10]对上述2种贝类血细胞的观察均显示不含颗粒的细胞占比较大。产生这种差异的原因与目前尚缺乏统一的显微观察判定标准有关,因此此次检测的结果受主观判断波动的影响较大,这也提示需要用更准确的量化标准来分析血细胞类群。
与显微观察对比,该研究首次将一种新型图像流式细胞仪用于贝类血细胞的测量和分析。针对颗粒特征,该仪器除了能分析前向散射及侧向散射的高、宽、面积外,还能测量强度等重要参数,因此与常规流式细胞仪相比更适合开展探究性工作。通过综合比较各种分析策略,确定了依据侧向散射强度及面积的综合差异区分细胞类型的优化方案,能够将含有颗粒的细胞更清晰地分为小颗粒细胞、中颗粒细胞及大颗粒细胞3种。精确测量也进一步印证了显微观察结果,即2种贝类的血淋巴中含有颗粒的细胞占比较大。大量研究[11-14]表明,甲壳动物细胞内也具有类似的颗粒,有些还有膜结构包裹,因此其侧向散射信号应该来源于这些颗粒中所包含的物质。由于侧向散射是对胞内全部折光结构的测量,既包括前述可见颗粒中的,又包括胞质内难以辨识的细小结构,所以能更客观地反映细胞内的颗粒的总体差异。晋伟等[15]提出应将新型检测手段用于水生动物血细胞自动化“验血”分析。常规流式细胞仪可用于多种贝类的血细胞分析[16-22],但受限于测量模块,大多仅能将血细胞分为2~3类,占比各不相同,类群边界也不够清晰;胡锦丽等[23-24]利用图像流式细胞仪首次以精确的定量标准将甲壳动物血细胞清晰分为4类,各类细胞的体积呈现出与该研究一致的由R1类型向R4类型逐渐增大的变化趋势。微球吞噬试验结果显示,各类细胞均具有吞噬功能,而以无颗粒及小颗粒细胞为主要吞噬类群。该研究首次将新型流式细胞仪引入贝类血细胞分析,用侧向散射强度和面积差异区分出了4种血细胞,边界清晰。对比甲壳动物的血细胞图像流式分析可见,基于血蓝蛋白携氧的多种无脊椎动物的血细胞都能够以侧向散射强度和面积差异分为4个类群,而且散点图的设门模式十分接近,提示不同进化阶段的物种之间在血细胞功能方面也应具有一定的相似性。此外,就某一动物而言,其血细胞的4个类群之间普遍缺乏过渡样点,也进一步提示细胞类群之没有相互转化,至少在外周血中彼此独立,每种细胞具有明确的功能。例如,无颗粒细胞以其较为疏松的胞质空间承载吞噬的异物,而各种颗粒细胞则生成特定的功能分子,储存于颗粒结构中,或以量化的方式分泌到循环系统,调节各类血细胞和机体的功能。
目前,针对多种贝类的血细胞分类的研究结果存在一些差异,一方面是各种血细胞的比例在不同贝类中不同;另一方面是因为针对同一种贝类的血细胞类群组成,采用不同分析方法所获得的结果也不尽相同。前者体现了物种差异及动物与所在环境的适应关系等,而后者则提示各种方法依据不同的特征差异都可对血细胞进行区分,但以更精准的量化标准作为分类依据才能让各项研究具有可比性,从而挖掘出更准确的规律。这一点在医学血液学分类研究中最为明显,从早期仅能简单区分红细胞与白细胞,到现今依靠各种细胞分化抗原辨识更为精细的细胞类群,经历了长时间的发展完善,并推动了免疫细胞功能研究的持续深入,为疾病的检测、预防和治疗提供了基础性的支撑。因此,随着新技术与新方法的不断完善,贝类血细胞会有更多类群被鉴定出来,该研究在自动化定量分类方面提供了一种新的策略,有助于推动该目标的实现。
参考文献
[1] 韩冷.五种帘蛤科贝类的核糖体基因簇比较与系统发育研究[D].济南:山东大学,2019.
[2] 孙敬锋,吴信忠.贝类血细胞及其免疫功能研究进展[J].水生生物学报,2006,30(5):101-107.
[3] TISCAR P G,MOSCA F.Defense mechanisms in farmed marine molluscs[J].Veterinary research communications,2004,28:57-62.
[4] 吴宁,陈梦玫,王素芳.贝类免疫机制的研究进展[J].药物生物技术,2017,24(1):68-71.
[5] 石安静,邱安东,唐敏,等.圆背角无齿蚌血细胞培养[J].水生生物学报,2001,25(2):116-122.
[6] 吴刚,张志江,黄亚冬,等.贝类血细胞分类及其功能研究进展[J].河北渔业,2018(4):52-55.
[7] CHANG S J,TSENG S M,CHOU H Y.Morphological characterization via light and electron microscopy of the hemocytes of two cultured bivalves:A comparison study between the hard clam(Meretrix lusoria)and Pacific oyster(Crassostrea gigas)[J].Zoological studies,2005,44(1):144-152
[8] 刘东武,王宜艳,孙虎山.菲律宾蛤仔、中国蛤蜊、文蛤和紫石房蛤血细胞的分类研究[J].水产科学,2005,24(10):5-7.
[9] ZHANG Y Y,REN S L,WANG D X,et al.Structure and classification of haemocytes in the bivalve mollusc Meretrix meretrix[J].Journal of Ocean University of China,2006,5(2):132-136.
[10] 王文琪,徐申波,张玉娜,等.菲律宾蛤仔(Ruditapes philippinarum)血细胞分类及其功能初探[J].莱阳农学院学报(自然科学版),2006,23(3):165-169.
[11] 叶燕玲,陈宽智.中国对虾(PENAEUS CHINENSIS)血细胞超微结构、分类及计数[J.青岛海洋大学学报,1993,23(2):35-42.
[12] DING Z F,DU J,OU J T,et al.Classification of circulating hemocytes from the red swamp crayfish Procambarus clarkii and their susceptibility to the novel pathogen Spiroplasma eriocheiris in vitro[J].Aquaculture,2012,356/357:371-380.
[13] GIULIANINI P G,BIERTI M,LORENZON S,et al.Ultrastructural and functional characterization of circulating hemocytes from the freshwater crayfish Astacus leptodactylus:Cell types and their role after in vivo artificial nonself challenge[J].Micron,2007,38(1):49-57.
[14] LV S J,XU J H,ZHAO J,et al.Classification and phagocytosis of circulating haemocytes in Chinese mitten crab(Eriocheir sinensis)and the effect of extrinsic stimulation on circulating haemocytes in vivo[J].Fish & shellfish immunology,2014,39(2):415-422.
[15] 晉伟,刘逸尘,张树花,等.鱼类血细胞研究进展[J].安徽农业科学,2018,46(12):27-30.
[16] 潘辉,高如承,吴丽云,等.利用流式细胞术研究3种贝类的血细胞分类[J].福建师范大学学报(自然科学版),2011,27(4):127-130.
[17] 谢彦海,胡宝庆,文春根.利用相差显微镜和流式细胞术分析褶纹冠蚌血细胞类型[J].南昌大学学报(理科版),2010,34(2):180-184.
[18] ALLAM B,ASHTONALCOX K A,FORD S E.Flow cytometric comparison of haemocytes from three species of bivalve molluscs[J].Fish & shellfish immunology,2002,13(2):141-158.
[19] 许秀芹,王宜艳,孙虎山.流式细胞术比较研究4种双壳贝类血细胞的分群[J].海洋湖沼通报,2006(1):46-50.
[20] YANG H S,HONG H K,DONAGHY L,et al.Morphology and Immunerelated activities of hemocytes of the mussel Mytilus coruscus(Gould,1861)from East Sea of Korea[J].Ocean science journal,2015,50(1):77-85.
[21] HONG H K,DONAGHY L,CHOI K S.Flow cytometric studies on the morphology and immunological functions of hemocytes in the Iwagaki oyster Crassostrea nippona[J].Fisheries science,2014,80(5):969-976.
[22] GOEDKEN M,DE GUISE S.Flow cytometry as a tool to quantify oyster defence mechanisms[J].Fish & shellfish immunology,2004,16(4):539-552.
[23] 胡锦丽,刘逸尘,任星潮,等.图像辅助流式细胞仪在中华绒螯蟹血细胞分析中的应用[J].安徽农业科学,2018,46(24):145-148,204.
[24] 胡锦丽,任星潮,刘逸尘,等.图像流式细胞仪在中华绒螯蟹血细胞分群及吞噬功能研究中的应用[J].水产学报,2019,43(3):563-572.

