麻疯树花粉管荧光染色及生长过程的研究
吴 军, 马 影, 张俊辉
(1.四川大学生命科学学院生物资源与生态环境教育部重点实验室, 成都 610065;2.清华大学医院管理研究院, 北京 518055)
麻疯树(JatrophacurcasL.)属大戟科(Euphorbiaceae)麻疯树属落叶小乔木或灌木,高2~7 m,耐干旱贫瘠,在热带、亚热带及干热河谷区有分布[1-2]。麻疯树种子含油率高,在生物燃油、新药开发、洗涤用品、饲料及荒山治理等方面有着重要的应用前景[3-5]。
麻疯树雌雄同株,花单性[2,6],主要靠蚂蚁、蜜蜂及苍蝇等昆虫传粉[7-8],通过改善麻疯树发育和传粉可提高果实数量[9-11]。有研究显示,麻疯树雌花约有50%结果[12],通过自然杂交试验、人工自交和人工杂交测定的结实率依次为76.42%、87.93%和86.66%,说明麻疯树是自交可育并偏向于异交[13]。麻疯树存在胚珠败育的现象,胚珠和种子的比例为3∶(2~2.8)[12-13],进而导致结实率下降,影响种子产量。这些情况与受精过程密切有关,花粉粒的萌发与花粉管的伸长是正常受精的重要环节,而目前有关麻疯树受精过程及花粉管生长发育等方面的报道较少。
植物授粉时,落在柱头上的花粉粒经过粘附、识别、水合、萌发形成花粉管,然后花粉管在花柱和子房内伸长,进而完成受精作用。有研究表明,花粉管的生长集中在花粉管尖端[19]。此外,花粉管通道转化法是国内外利用生物技术育种的重要手段,已在棉花、玉米、小麦等植物上获得成功[14-16]。本研究通过探索麻疯树花粉管萌发的过程,为了解麻疯树结实情况和建立花粉管通道介导的麻疯树转基因技术体系奠定基础。
花粉管经水溶性苯胺蓝染色后,花粉管产生的胼胝质在紫外光激发下产生荧光,可利用荧光显微镜对花粉管的有关性状进行观察[17]。该方法已用于水稻、拟南芥等植物花粉管生长过程的观察[18-19]。本研究采用苯胺蓝染色法观察麻疯树受精后花粉管的萌发及生长过程,探索NaOH溶液和冬青油对麻疯树雌蕊组织的软化透明效果。
1 材料和方法
1.1 材 料
实验材料为2013年种植于四川大学生命科学学院温室的麻疯树,温度25~28 ℃,光照5 000~8 000 lx。
1.2 取材及固定
麻疯树雌花临近开放时进行套袋隔离,09:00时左右,选取已开放的雌花进行人工授粉。分别在授粉1,1.5,2,2.5,3,4,5,6,7,8,9,10,11,12,13,14,15 h后(共17个时间段)取样并编号,每个时间段取3个样本;另外,设计并采集授粉5 h后的雌花30份,用于确定较好的软化透明方法。样本用FAA固定液固定,放入4 ℃冰箱中备用。
1.3 组织软化方法
1.3.1NaOH软化
将备好的材料从FAA固定液中取出,经50%,30%,15%乙醇和蒸馏水逐级覆水,每次30 min;再将材料置入不同浓度的NaOH溶液,放入50 ℃恒温箱内进行软化处理。NaOH浓度分别设1,2,3,4 mol·L-1等4个浓度,每个浓度设1,2,3,4 h 4个软化时间以确定较优的软化方法。
1.3.2冬青油软化
将固定液处理的雌蕊取出,依次放入70%,85%,90%,100%,100%的乙醇中,每次2 h;再依次放入1/2乙醇+1/2冬青油、冬青油中,每次2 h;再将冬青油处理后的花柱采取以下3种处理方法: 1) 冬青油处理后不复水直接用苯胺蓝染色; 2) 冬青油处理后经梯度酒精到蒸馏水复水后再用苯胺蓝染色; 3) 冬青油处理后经梯度酒精到蒸馏水,再经2 mol·L-1NaOH处理4 h后,再用苯胺蓝染色。
1.4 花粉管生长过程的观察
在解剖镜下分离花柱和子房,并对子房徒手切片,之后采用NaOH溶液软化、透明。NaOH处理后的材料用蒸馏水冲洗3次,每次5 min,再用pH为8.2磷酸盐缓冲液预处理1 h,最后根据Kho等[17]的方法以0.1%苯胺蓝进行染色。在Olympus荧光显微镜下(紫外激发,阻挡滤光片为475 nm)对染色后的材料进行观察和拍照,通过花粉管的清晰程度确定较好的处理方式和时间,并分析不同材料中花粉管的分布状态以确定花粉管的生长情况。
2 结果与分析
2.1 花的相关形态结构
为了便于研究花组织的软化透明和观察花粉管的生长,本研究对麻疯树花相关形态结构进行了分析。结果显示,麻疯树单性花,雌雄同株(图1 A,B,D),花的结构便于进行昆虫传粉,花粉粒表面具有齿轮形凸起(图1 C),可以牢固附着在柱头上(图1 E),柱头3个,2裂,花柱较短(图1 D),子房三室,每室着生1个胚珠,自然环境下部分胚珠不能正常发育(图1 F)。
2.2 NaOH软化浓度和时间的确定
将授粉5 h的麻疯树柱头放入不同浓度NaOH进行不同时长的软化处理。结果表明,没经过NaOH软化的材料透明度不够,经0.1%的苯胺蓝染色,紫外激发后,基本看不见荧光,不利于花粉管萌发的观察(图2 A 1,A 2)。本研究中,使用1 mol·L-1NaOH 软化处理时长为4 h和5 h的2个处理(图2 B 1,B 2;C 1,C 2),或者用2 mol·L-1NaOH 软化时长为3 h和4 h的2个处理(图2 D 1,D 2;E 1,E 2),或者用3 mol·L-1NaOH软化1 h(图2 F 1,F 2),再用苯胺蓝染色,在紫外光激发下可观察到荧光;其中采用2 mol·L-1NaOH处理3 h或4 h效果较好。用1 mol·L-1NaOH软化1 h或3 h的处理,紫外光激发后荧光几乎不可见。而使用3 mol·L-1NaOH软化2 h或4 h的处理和4 mol·L-1NaOH软化1 h或4 h的处理,由于NaOH浓度高,导致软化过度,材料基本解离,不便于观察,且不易掌控。
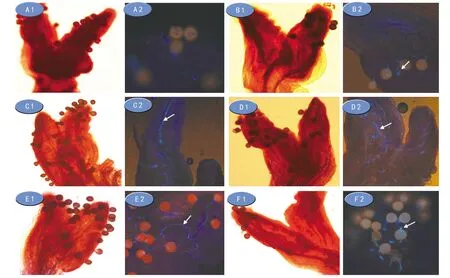
注:A 1,A 2为同一样本;B 1,B 2及F 1,F 2为同一样本;A 1,B 1,C 1,D 1,E 1,F 1为10×10倍白光观察,A 2,B 2,C 2,D 2,E 2,F 2为10×40倍紫外光激发观察;A 1,A 2没经过NaOH溶液软化处理,B 1,B 2使用1 mol·L-1 NaOH处理4 h;C 1,C 2使用1 mol·L-1 NaOH处理4 h;D 1,D 2使用2 mol·L-1 NaOH处理3 h;E 1,E 2经2 mol·L-1 NaOH处理4 h;F 1,F 2经3 mol·L-1 NaOH处理1 h。图2 NaOH溶液处理和苯胺蓝染色的麻疯树花柱观察
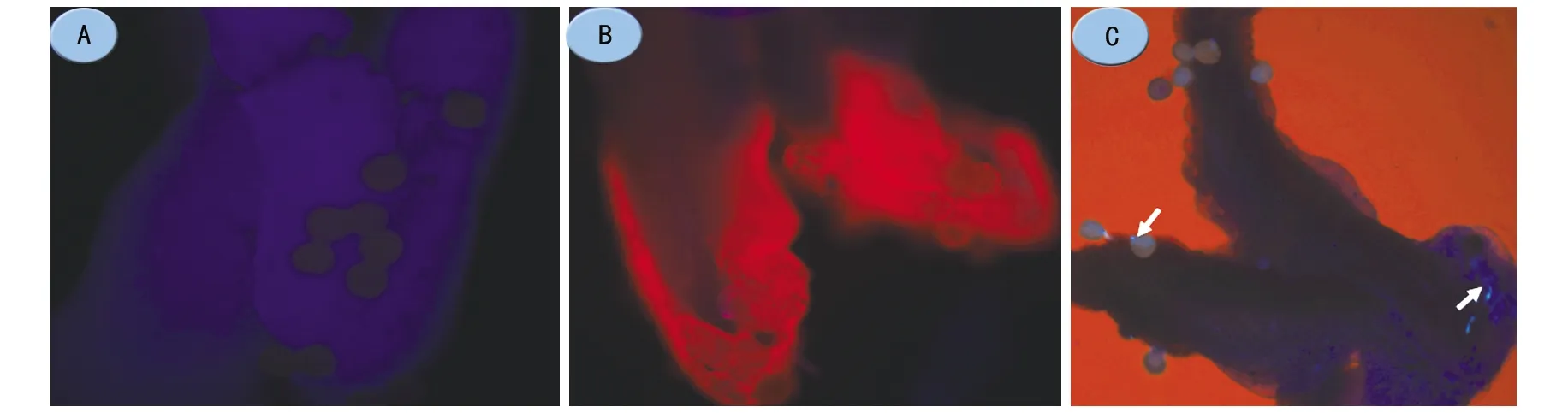
注:A为冬青油处理后不复水直接用苯胺蓝染色的麻疯树花柱;B为冬青油处理后经梯度酒精到蒸馏水复水后再用苯胺蓝染色的麻疯树花柱;C为冬青油处理后经梯度酒精到蒸馏水,再经2 mol·L-1NaOH处理3 h后,再用苯胺蓝染色的麻疯树花柱,箭头示荧光;A,B 10×40倍镜,C 10×10倍镜。图3 冬青油处理麻疯树雌蕊组织的透明效果
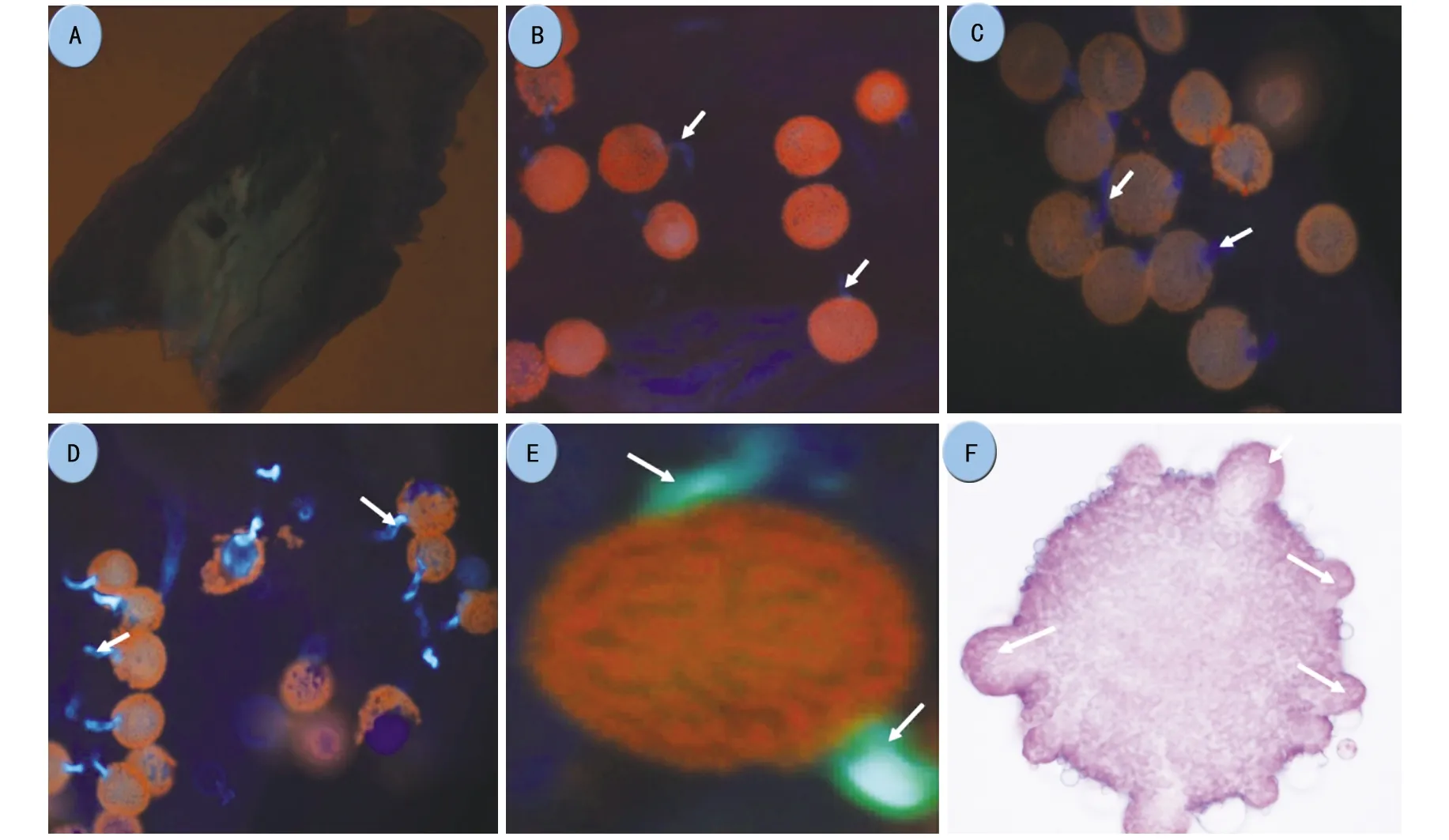
注:A为经过NaOH软化、苯胺蓝染色的未受精的花柱(紫外光激发后无荧光);B为授粉2 h后的柱头;C为授粉3 h后花粉管生长情况;D为授粉4 h后花粉管生长情况;E为柱头上具有2个荧光点的花粉粒;F为在生理盐水萌发30 min后,用稀醋酸洋红溶液染色的麻疯树花粉粒(箭头示荧光或存在多个萌发管;A 10×10倍镜,B,C,D 10×40倍镜,E,F 10×100倍镜。图4 麻疯树花粉的萌发
2.3 冬青油软化结果
授粉5 h后的麻疯树花柱,经过冬青油处理不复水直接染色,被染成了蓝色,没有观察到发射荧光的花粉管(图3 A);经过冬青油处理后复水再染色,花柱被染成了红色,也没有观察到发荧光的花粉管(图3 B);冬青油处理后经梯度酒精到蒸馏水,再使用2 mol·L-1NaOH处理3 h后进行苯胺蓝染色,可观察到发荧光的花粉管(图3 C),但效果与只用NaOH溶液软化类似。因此,在本研究中冬青油既不能代替NaOH软化透明麻疯树雌蕊组织,也不能增加透明效果。
2.4 柱头上花粉管萌发情况的观察
受精后的麻疯树柱头经过2 mol·L-1NaOH软化3 h,0.1%的苯胺蓝染色,再利用荧光显微镜紫外激发观察。结果表明,柱头上的花粉在授粉2 h后开始萌发(图4 A,B),萌发的花粉随着时间的延长而增多,4 h后柱头上的花粉已全部萌发(图4 C,D)。研究中观察到有些麻疯树花粉粒长出2条或者多条花粉管,这有可能跟麻疯树有多个萌发孔有关(图4 E,F),但最终1个花粉粒上只能有1根花粉管能够伸长并通过花柱。
2.5 花柱中花粉管生长观察
麻疯树花柱经过2 mol·L-1NaOH软化3 h,0.1%的苯胺蓝染色后,再使用荧光显微镜紫外光激发观察,可以清楚看到花粉管的生长路径。麻疯树花粉管在花柱中呈曲线生长(图5 A);授粉10 h后,花粉管已经生长到花柱的基部(图5 B,C),此时观察到柱头上一些花粉的花粉管顶端膨大而停止生长或者花粉管保持短小状态而停止生长(图6 A);授粉第11 h,子房内开始出现带有荧光的花粉管(图5 D);11 h后,子房内的花粉管逐渐增多(图5 E);15 h后子房内充满了大量的花粉管,少数花粉管通向胚珠(图5 F)。
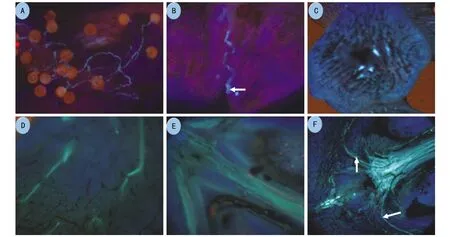
注:A为授粉5~9 h的萌发情况;B为授粉第10小时花柱纵切;C为授粉第10小时花柱基部横切;D为授粉第11~12小时,子房内开始出现少量带有荧光的花粉管;E为授粉第13小时子房出现的带有荧光的花粉管;F为授粉第14小时,子房内开始出现大量带有荧光的花粉管,箭头表示通向胚珠花粉管;A,C,F 10×10倍镜,B,D,E 10×40倍镜。图5 麻疯树花粉管的伸长
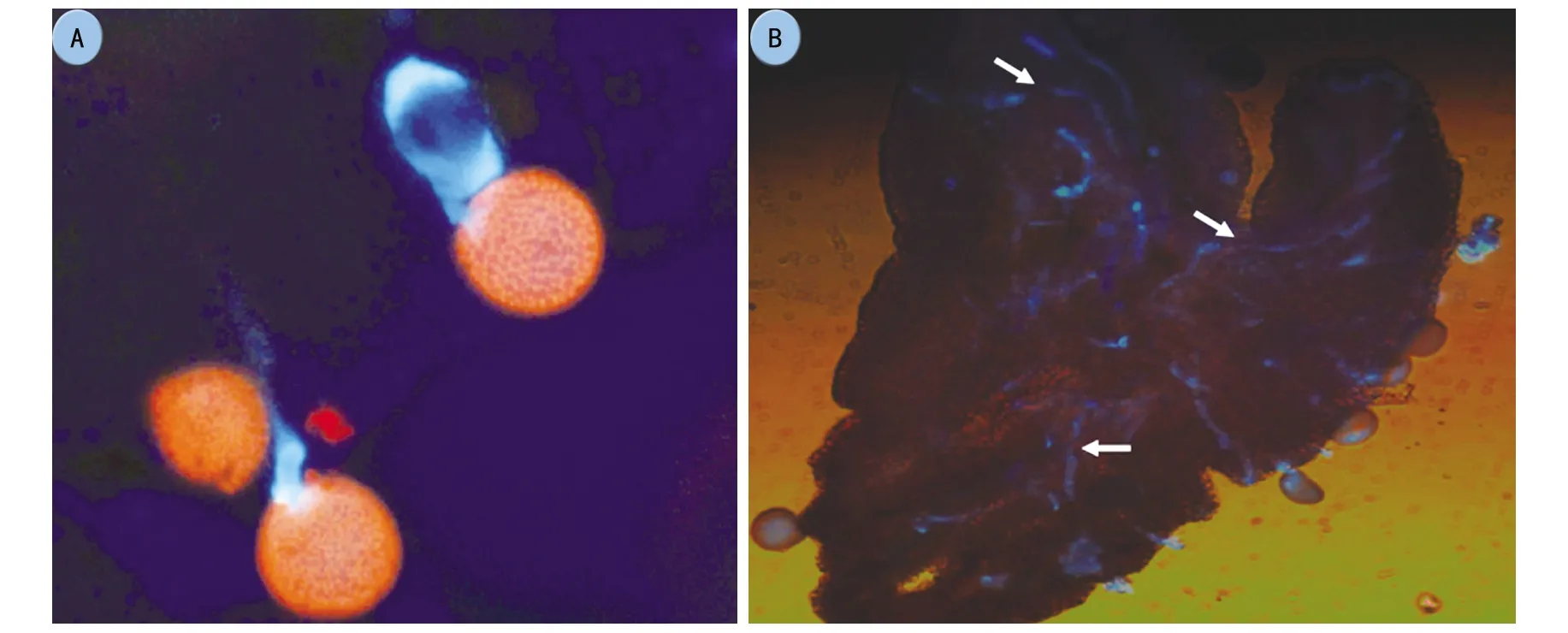
注:A为示生长受抑制的花粉管,10×40倍;B为花柱中花粉管荧光开始减弱;箭头表示胼胝质塞的出现,10×10倍。
从授粉后10 h开始,观察发现花柱中花粉管荧光开始减弱,花粉管中可见到大量的均匀分布、间断出现的荧光胼胝质塞(图6 B),胼胝质塞将花粉管内腔堵死,它的存在使花粉管腔成为一个不连续的系统,可以阻止花粉管内的物质倒流。
3 讨 论
对麻疯树雌蕊进行透明处理时,采用NaOH溶液较冬青油效果好。NaOH溶液浓度越高,所需软化处理时间越短,但使用3 mol·L-1以上NaOH溶液时,麻疯树雌蕊材料容易被过度软化而不便观察,是否可以通过缩短处理时间获得较好的软化透明效果有待进一步研究;使用1 mol·L-1NaOH溶液却需要较长处理时间。因此,采用2 mol·L-1NaOH溶液对麻疯树雌蕊组织进行透明处理比较适宜。
研究发现,授粉后出现花粉管尖端膨大而生长受阻的现象,推测是大量花粉管生长竞争的结果[20];花柱上存在一种能够降解自身花粉管RNA的特异性核糖核酸酶,从而抑制花粉管的生长[21];先发育花粉管在生长过程中消耗营养物质,引起后生长花粉活力下降,导致生长受阻[22]。本研究中也观察到麻疯树授粉10 h后,一些花粉管顶端膨大而停止生长或者花粉管保持短小状态而停止生长(图6 A),该现象发生的理论机制是否与前人相同,有待进一步研究。
尽管麻疯树花粉只有2 d寿命,散粉9 h后花粉活力降为45.15%[12],但麻疯树雄花量远大于雌花,雌雄花比例约为1∶25[2],而且一朵麻疯树雄花产生约1 617粒花粉,花粉量较大,具有蜜腺可以吸引蚂蚁,蜜蜂等进行传粉[2,7],柱头于开花当日便具有可授性,可授期可延续到花后5~8 d[12]。因此,这些条件是可以保证麻疯树成功繁殖[12]。然而,在自然状态下结果率为76.42%,有研究者认为其结实率的高低主要受访花者限制[13];但是却不能解释人工授粉条件下,结果率仅为87.93%以及平均每个果实具有2.00~2.85粒种子[7,13](麻疯树每个果实具有3个胚珠,理论上每个果实应具有3粒种子)的现象。本研究显示,落在柱头的花粉粒授粉4 h后全部萌发,而花柱中观察到的花粉管数量少于柱头萌发的花粉管数量(图2 C 1,C 2;D 1,D 2),又观察到授粉10 h后柱头存在没有伸长的花粉管,因此,可能存在某种机制阻止了柱头萌发花粉的花粉管进一步伸长,引起受精受阻,这样就可能导致少部分雌花或胚珠不能正常受精,进而导致部分雌花不能结果或部分胚珠败育。由此可以部分解释在自然环境甚至人工授粉情况下,结果率为76%~88%以及每果实平均具有2.00~2.85粒种子的现象。
对植株使用花粉管通道法进行遗传转化时,在花粉管生长到胚囊的过程中,外源基因可以被花粉管吸收,如果外源基因进入胚囊并且参与受精过程,那么基因的转化就有可能实现。本研究显示,麻疯树花粉管伸长过程中存在胼胝质塞,是不利于目的DNA通过花粉管进入胚囊的。然而,对油菜、玉米、小麦、水稻等物种的研究发现,利用花粉管通道介导转化时,目的DNA并不是通过花粉管进入胚囊,而是沿着花粉管的外壁,顺着花粉管穿过柱头时形成的管道进入子房[23]。因此,本研究显示麻疯树采用花粉管通道法进行遗传转化仍具有一定可行性。
花粉管通道介导转化技术中,目的基因通过连续的花粉管外表面进入胚囊,转化在花粉管通道形成后精子和卵子融合到合子分裂的这一段时间较好,大多数植物的受精过程研究发现,完成精卵融合需要2~9 h[23]。本研究显示,麻疯树花粉从授粉至花粉管进入子房,至少需要11 h,比Abdelgadir H.A等[24]的研究结果晚3 h,建议在麻疯树中利用花粉管导入目的DNA在授粉11 h以后进行。

