四逆汤对DSS诱导的小鼠溃疡性结肠炎的抗炎作用
张莲珠,宋 颖,马 军,王艺惟,张 昱,范雪影,李嘉玮,王义山,宋 宇
(1.海南热带海洋学院 a.热带海洋生物资源利用与保护教育部重点实验室; b.海南省热带海洋渔业资源保护与利用重点实验室;c.水产与生命学院,海南 三亚 572022; 2.长春市宽城区医院,长春 130052;3.吉林大学 动物科学学院,长春 130062)
0 引言
溃疡性结肠炎(ulcerative colitis,UC)是炎性肠病中一种难治的、慢性进展且容易复发的疾病.病程可长达几十年甚至伴随终生,严重降低了患者的生活质量,缩短患者寿命,增加社会经济负担.由于其长期慢性炎症的刺激,溃疡性结肠炎相关性结肠癌的发病风险也逐渐增高,病程30年的UC患者结肠癌变概率高达30%[1-2].我国UC的发病率正处在上升阶段,若不加以有效防治,UC 将成为一种流行性疾病[3-4].寻找新的有效的UC治疗药物与方法,是当前迫切需要解决的棘手难题.中医学认为UC属于“泄泻”“赤沃”“大瘕泄”等范畴.泄泻日久,肾阳虚衰,不能温运脾阳,运化失常,伤及肠络,则大便为黏液血样;阳虚生内寒,可见遇寒即发,形寒肢冷.四逆汤是《伤寒论》中的经典名方,具有回阳救逆之效.由附子、干姜、甘草组成.其中附子治风寒湿痹、痹痛麻木、脘腹冷痛之症功效卓著,为君药.干姜性味辛热,具有温中散寒、回阳通脉的功效,在四逆汤中可助附子回阳,为臣药.甘草和中益气,既能缓解附子、干姜的暴烈,又能协助附子、干姜的回阳救逆之功效,为佐使药.现代临床疗效观察和动物实验研究均表明,四逆汤具有强心、升压、抗休克、提高免疫功能等作用,能保护心脑血管系统和肠黏膜,对冠心病、动脉粥样硬化等有较好的治疗效果[5-8],在临床上除了更多地用于治疗休克、阳虚发热、血栓闭塞性脉管炎等病症外,还常用于治疗胃肠炎和腹泻.例如,角田睦子运用四逆汤治疗几种类型的溃疡性结肠炎[9].本课题组在对四逆汤的前期研究中发现,该方剂对小鼠UC有显著的治疗效果,本研究进一步探索四逆汤对DSS诱导的小鼠UC的干预作用及作用机制,为四逆汤在预防或治疗溃疡性结肠炎中的应用提供实验依据,使四逆汤在医药领域发挥新的用途.
1材料和方法
1.1动物
实验动物:36只SPF级C57BL/6雄性小鼠购自北京维通利华实验动物技术有限公司(5周龄,体重17~19 g,合格证号No.11400700312216),本实验在吉林大学动物伦理福利委员会监督下(IACUC)在吉林大学实验动物中心屏障设施开展,遵守吉林大学及国家对于实验动物伦理福利的要求(批准号:201802064),饲养条件严格依照GB14925进行,实验过程中小鼠被允许自由采食和饮水.
1.2实验主要试剂
四逆汤由炙附片、干姜、炙甘草组成,由长春中医药大学附属医院提供.DSS购自瑞典TdB公司;小鼠IL-6、IL-10、IL-17、TNF-α ELISA检测试剂盒购自美国BioLegend公司;组织细胞裂解液、PMSF购自上海碧云天生物技术有限公司;异氟烷购自深圳市瑞沃德生命科技有限公司;甲醛溶液购自成都市科隆化学品有限公司.
1.3仪器
酶标仪购自TECAN公司;NANODROP 1000购自Thermo;组织匀浆机购自M.P.Biomedicals;显微镜(Ts2)购自日本Nikon公司;KD-3368-Ⅳ电脑病理专用冷冻石蜡两用切片机购自日本浮山株式会社;ABS型小动物气体麻醉机购自上海玉研科学仪器有限公司.
1.4UC模型制备与给药方法
小鼠自购入后于SPF实验动物设施中适应饲养一周,而后将小鼠随机分为3组,每组12只:正常对照组(CTL)、DSS模型组(DSS)、四逆汤干预组(SND).正常对照组自由饮用纯净水,灌胃纯净水;DSS模型组分两个周期进行给药造模,DSS I 期自由饮用2.5%的DSS 7天,之后自由饮用纯净水7天,DSS II 期自由饮用2.5%的DSS 7天;四逆汤干预组同DSS模型组同步造模,且于造模开始每天1次灌胃给予四逆汤水煎干浸膏粉(四逆汤水煎剂经减压浓缩至相对密度 1.26~1.30(80 ℃)的稠膏,减压干燥(0.08 MPa,60 ℃)得干燥浸膏,粉碎过80目筛,得干浸膏粉.临用前以无菌蒸馏水配制,按照《药理实验方法学》“不同动物等效剂量折算系数表”折算,给药量为60 kg体重成年人用量的8.65倍)至实验结束,正常组和模型组灌胃予蒸馏水10 mL·kg-1·d-1.实验过程中,每天记录小鼠体重、观察小鼠活动情况,收集小鼠粪便,DAI评分评估小鼠结肠炎患病情况.DSS II 期造模结束后第2、3天处死小鼠并取材.
1.5 HE染色观察结肠组织
末次给药后,禁食不禁水24 h,异氟烷麻醉,心脏采血保留血清,处死小鼠.将小鼠置于冰上解剖取材,分离远端结肠,4 ℃预冷的PBS溶液冲洗结肠,用眼科剪沿肠系膜纵轴剖开肠腔,冷PBS溶液冲洗后观察结肠黏膜损伤情况.取距小鼠肛门约3 cm处长度约0.5 cm的结肠置于10%甲醛溶液中固定,石蜡包埋,HE染色观察.
1.6 ELISA法测定结肠组织IL-6、IL-17、IL-10和TNF-α水平
另取一部分结肠组织加入蛋白裂解液裂解完全后离心,上清液即为结肠组织蛋白提取液.定量各组提取液的蛋白浓度,按照ELISA试剂盒说明检测各组小鼠结肠组织IL-6、IL-17、IL-10和TNF-α的水平.
1.7统计学分析
采用Graphpad Prism 7软件统计分析实验数据.以mean±SD表示各组数据,多组间比较采用One-way ANOVA方差分析,P<0.05为有显著性差异,P<0.01为差异性极显著.
2结果
2.1四逆汤对溃疡性结肠炎小鼠体重变化的影响
实验期间每天记录小鼠体重,每组小鼠体重平均数每日变化的情况见图1.在两个DSS周期中,正常对照组小鼠体重变化稍有波动,但总体较为平稳;DSS模型组小鼠体重在每个DSS饮水处理过程中体重下降明显,在DSS饮水结束后第2天体重下降率最高,体重下降到最低;四逆汤干预组小鼠体重变化率的变化趋势和DSS模型组一致,但每日体重下降率均显著低于DSS模型组,这种差异在慢性期即DSS II 期表现更为显著.

图1 各实验组小鼠体重变化率
2.2小鼠肠炎情况评估
实验期间每天收集小鼠粪便,并对小鼠粪便性状、出血状况等进行双盲评分,并综合体重下降率进行DAI评分.DAI评分是由Alex[10]等开发用于实验动物结肠炎患病情况的评价体系.评分共分3项,每项满分为4分,DAI得分为3项得分总和,得分越高说明实验动物患病情况越严重,评分标准如表 1 所示.
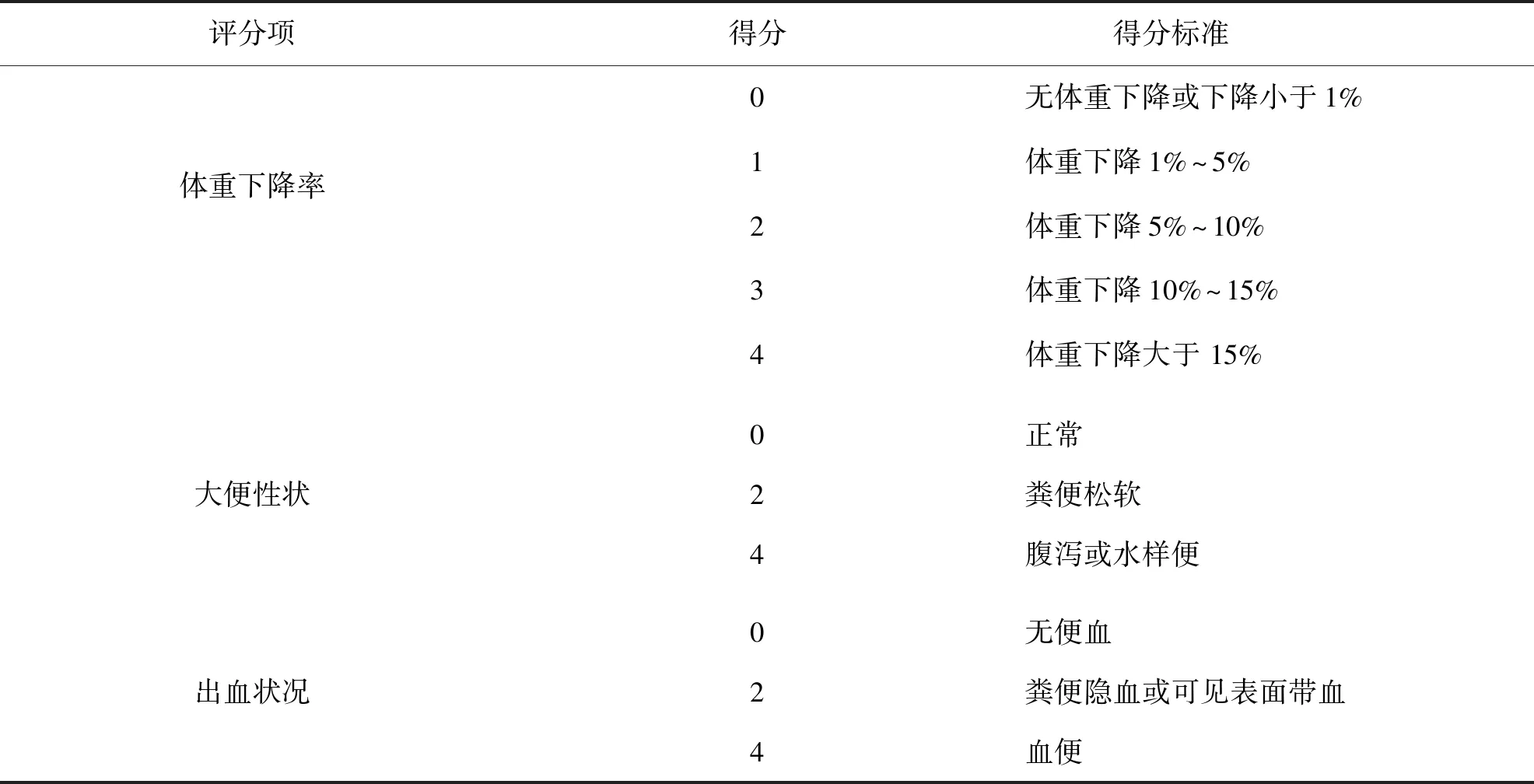
表1 DAI评分标准
根据表1的评分标准,各组小鼠DAI评分每日变化情况见图2.在两个DSS周期中,正常对照组小鼠DAI评分在第8天、第11天以及第18天略有波动,DAI评分均为0分,说明小鼠未患炎症;模型组小鼠DAI评分在第8天和第18天即两个DSS饮水结束后第2天达到最高,即肠炎患病最严重,这与体重变化率改变情况一致;四逆汤干预组DAI评分分别在第7天和第17天比模型组提前1天达到高峰,但得分均显著低于模型组,且四逆汤干预组炎症恢复较模型组快,恢复后DAI评分低.以上情况表明四逆汤对DSS诱导模型小鼠溃疡性结肠炎在急性期DSS I期和慢性期DSS II 期均有显著改善.

图2 各实验组小鼠DAI评分
2.3四逆汤对溃疡性结肠炎小鼠结肠组织病理变化的影响
对各实验组小鼠肠组织HE染色并于光镜下分别观察肠黏膜、黏膜下组织及肌层的损伤情况,进行结肠炎组织学评分(评分方法[11]见表2).如图3-A所示,正常对照组小鼠结肠黏膜上皮组织完整,结构清晰,上皮细胞排列整齐,腺体完整,无病变.模型组小鼠的结肠组织黏膜广泛缺失,腺体多数不完整,炎症细胞广泛浸润直至肌层,呈典型炎症改变,多数结肠受损面积超过整个结肠的50%,肌层明显增厚有纤维化表现,炎症程度十分严重(图3-B、C箭头线及圆圈).而四逆汤干预组黏膜损伤较轻,未见或少见炎症细胞浸润及弥漫,肌层略增厚,炎症程度较轻(图3-D箭头线).表3小鼠肠炎病理组织学评分显示,正常对照组各项得分均为0分,模型组的炎症严重程度、炎症浸润范围及隐窝损伤各项得分均显著高于正常对照组和四逆汤干预组,四逆汤干预组对炎症的改善作用明显.
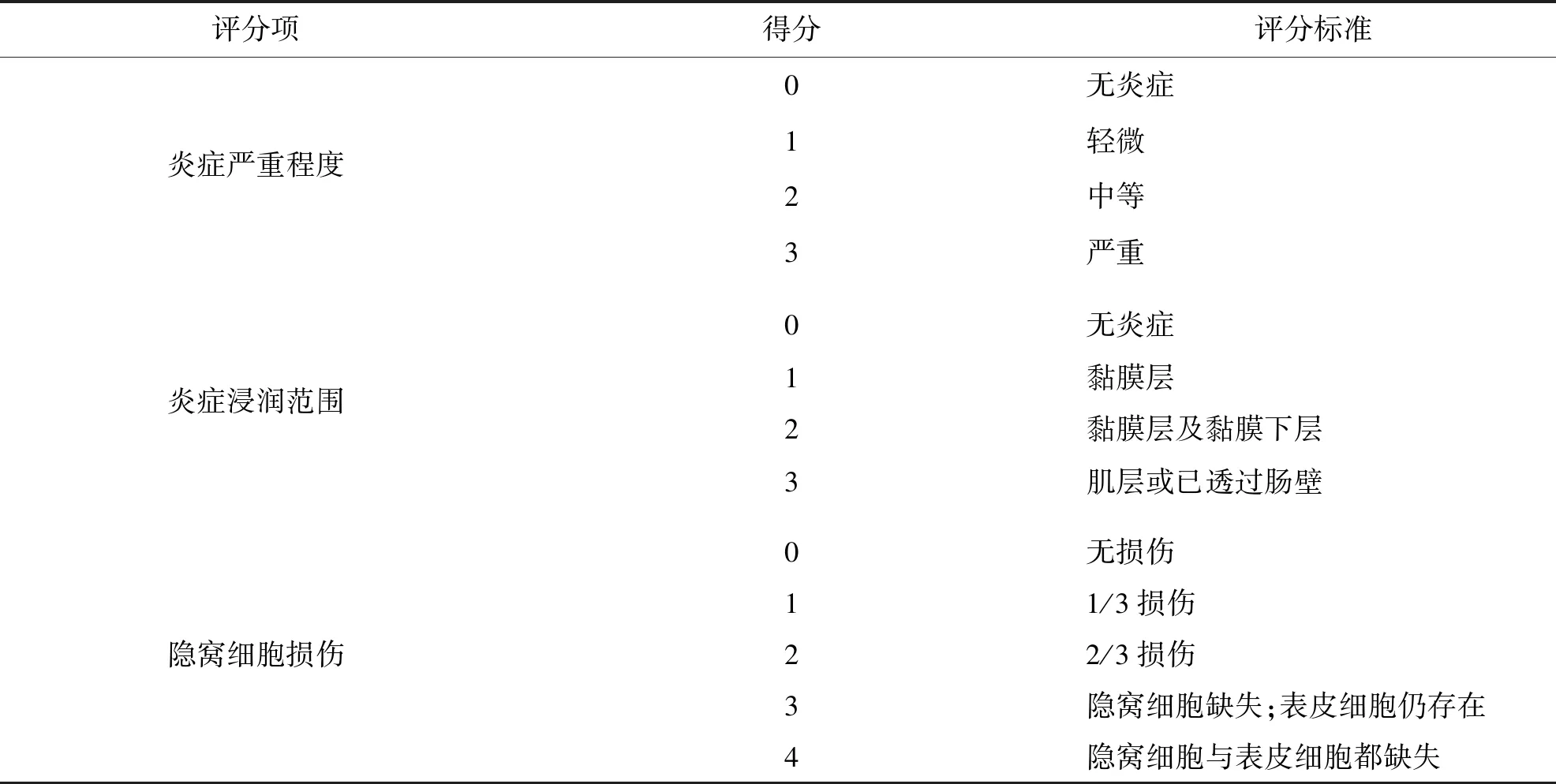
表2 结肠炎组织学评分方法

a.正常对照组 b.模型组 c.模型组 d.四逆汤组图3:各组小鼠结肠组织HE染色(×40)
表3 小鼠肠炎病理评分(Mean±SD)

评分项CTLDSSSND炎症严重程度02.7±0.45##1.9±0.22∗∗#炎症浸润范围02.6±0.42##2.1±0.22∗##隐窝细胞损伤03.3±0.97##1.7±0.84∗∗#总分08.6±1.64##5.7±0.84∗∗##
注:与模型组比较,*P<0.05,**P<0.005,与正常对照组比较#P<0.05,##P<0.005.
2.4四逆汤对小鼠结肠组织炎症因子表达水平的影响
在两个DSS造模过程中,采用ELISA法检测小鼠结肠组织IL-6、IL-10、IL-17和TNF-α等炎症因子表达(图4).如图4-A所示,IL-6作为肠炎典型炎症因子在模型组表达量显著高于四逆汤干预组的表达量.IL-17在各组表达趋势与IL-6相同,模型组的IL-17表达水平显著高于四逆汤干预组,四逆汤干预组表达水平与正常对照组接近(图4-B).IL-10在各组表达趋势与IL-6和IL-17相反,四逆汤干预组表达水平显著高于模型组表达水平且接近正常对照组(图4-C).TNF-α表达量在四逆汤干预组表达水平显著高于模型组(图4-D).在急性期即第1个DSS周期,四逆汤干预组和模型组4个细胞因子表达水平无显著差异,在慢性期即第2个DSS周期,四逆汤干预组明显降低了炎症因子的表达.
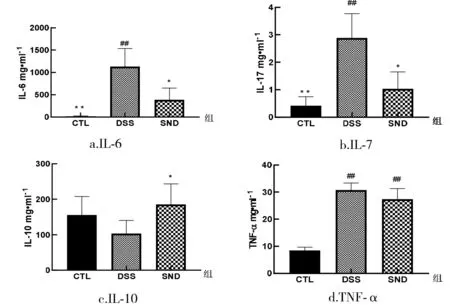
图4 小鼠结肠组织细胞因子表达注:与模型组比较,*P<0.05,**P<0.005,与正常对照组比较#P<0.05,##P<0.005.
3讨论
溃疡性结肠炎是一种病因尚不十分清楚的以黏膜和黏膜下层浸润为主、特发于结肠和直肠的慢性非特异性炎症性疾病.病程漫长,常反复发作.临床表现为腹痛、腹泻、黏液样脓血便、里急后重等.目前认为UC的发病主要涉及免疫异常、遗传、肠道菌群紊乱、黏膜屏障等因素[11-12].传统治疗方案的主要治疗目标是通过使用氨基水杨酸类抗炎药、免疫抑制剂或者结肠切除术等方案,诱导或者维持UC于缓解期,但用后相关并发症逐渐增多.寻找新的有效的UC治疗药物与方法,是当前迫切需要解决的棘手难题.
四逆汤源自张仲景的《伤寒论》,由炙附子、干姜、炙甘草3药组成,为温里剂,具有回阳救逆之功效.现有研究表明,四逆汤具有抗休克、抗动脉粥样硬化、免疫调节、保护心血管、保护肠黏膜及治疗糖尿病并发症等药理作用.本课题组在对四逆汤的前期研究中发现,该方剂对小鼠UC有显著的治疗效果.为进一步明确四逆汤在预防或治疗溃疡性结肠炎中的作用,本研究通过建立DSS诱导UC疾病小鼠模型,给予四逆汤干预,评估四逆汤的干预效果.DAI评分结果显示四逆汤可改善肠炎中体重下降、稀便、血便等症状,且四逆汤对慢性期肠炎改善效果明显优于急性期;病理评分结果显示四逆汤能够保护肠黏膜,维持肠上皮的完整性,减少隐窝细胞的损伤和炎症细胞的浸润,减轻炎症程度.溃疡性结肠炎肠道炎症的启动及其慢性化在很大程度上可能与促炎因子和抗炎因子的失衡有关.UC患者肠黏膜中促炎细胞因子水平升高,抗炎细胞因子水平下降,从而产生免疫调节功能紊乱,导致UC的发病.研究表明,与UC相关的主要促炎细胞因子有IL-6、IL-17、IL-1β[13-15],而主要的抗炎细胞因子有IL-4、IL-10、IL-13等,其中IL-10的抗炎作用已通过基因敲除小鼠得到了证实[16-18].IL-6可通过STAT-3信号途径激活核因子(NF-κB)诱导细胞因子的表达,血清IL-6水平可反映UC的严重程度[19].本研究中,四逆汤显著降低了结肠组织中IL-6、IL-17的表达水平,这可能与其抑制stat3,JNK等信号通路的表达有关,同时四逆汤也使得肠上皮中抗炎因子IL-10的表达有所增加.抑制促炎因子的表达,促进抗炎因子的表达,这可能是其对UC发挥改善作用的原因之一.而反常的是与正常对照组比较,四逆汤增加了TNF-α在肠上皮中的表达,这与以往的多数研究结果相反,通常TNF-α能促使中性粒细胞聚集,启动炎性反应及免疫应答[20].然而有研究表明,TNF-α虽然会诱发炎性疾病,但在疾病发生期间也具有相反的保护作用.因为上皮细胞TNF-α是先天免疫系统不可或缺的一部分,TNF-α的产生,部分是针对肠腔中破坏黏膜完整性的抗原的,这种保护作用是由增加上皮先天免疫介导的,结果使得获得性免疫系统的细胞不被募集,进而抑制了炎症级联的发作[21-22].因此,我们推测四逆汤可能通过促进TNF-α的表达,刺激而不是抑制上皮先天免疫而发挥保护作用,这一推测还需要进一步的研究加以验证.
本研究中,我们建立了由DSS诱导的溃疡性结肠炎小鼠模型评价中药复方四逆汤对溃疡性结肠炎的干预效果并初步探讨其作用机制.四逆汤通过改善腹泻、便血等症状保护肠黏膜,抑制促炎因子IL-6、IL-17的表达,促进抗炎因子IL-10的表达,调节促炎因子和抗炎因子之间的平衡,并可能通过增加TNF-α的产生诱发天然免疫从而干预实验性溃疡性结肠炎且作用显著.本研究为四逆汤在预防或治疗溃疡性结肠炎中的应用提供了实验依据,为经典方四逆汤“温中散寒”的功效与应用提供现代科学内涵.

