大气颗粒物对斑马鱼胚胎的毒性及机制研究进展
郭少娟,张元元,王菲菲,杨立新
环境基准与风险评估国家重点实验室,中国环境科学研究院
2018年世界卫生组织(WHO)数据显示[1],在全球范围内,93%的儿童生活在空气污染程度高于《WHO空气质量指南》限值的环境中。由于行为、环境和生理因素的综合作用,空气污染对健康造成的许多不利影响使儿童比成年人面临更大的风险,在胎儿发育期间及幼年时期尤其脆弱,通过吸入、摄入或子宫内的接触方式,可能导致儿童持续一生的疾病。在世界许多地方,儿童尤其容易受到家庭空气污染的影响。为了满足烹饪、取暖等基本需求,燃烧煤炭和木柴等所产生的烟雾是家庭空气污染的主要原因。在低效设备中燃烧燃料会产生复杂的污染混合物。在通风不良的住宅中,炉灶中颗粒物排放量可达WHO建议最大接触量的100倍[2]。
由于特殊的生理特征和暴露模式,胚胎发育阶段对各种环境污染物尤为敏感,并且心脏是脊椎动物最早形成并行使功能的器官之一。20%的美国婴幼儿死亡和先天性缺陷有关,其中心脏、循环和呼吸系统缺陷为255例10万人[3],先天性心脏发育缺陷的出生比例为9.11 000个活产婴儿[4]。虽然心血管和神经系统出生缺陷具有明显的临床症状,但是超过65%的病因并不清楚[5]。随着研究的不断深入,越来越多的证据显示,环境污染物暴露是导致这些缺陷的重要原因[3]。流行病学研究揭示,PM2.5暴露与低体重新生儿,早产,先兆子痫,自发性流产,胎儿心血管、消化和神经系统发育异常以及出生缺陷具有相关性[6-10]。
由于传统体内发育毒性试验周期长且需要大量试验动物,既不能满足环境污染物发育毒性筛选的要求,也不符合目前毒理学研究中所提倡的3R原则(减少、替代和优化试验动物的使用)。近年来,生殖发育毒性体外替代试验逐渐成为研究热点。体外全胚胎培养(whole embryo culture, WEC)技术是欧洲替代方法验证中心(ECVAM)和经济合作与发展组织(OECD)推荐有效性较高的体外胚胎发育毒性替代试验方法[11]。通过WEC技术将动物的完整胚胎移植到体外进行培养,可以观察胚胎发育情况,筛查化合物的发育毒性,探讨其剂量-反应关系及毒性机制,是目前研究环境污染物对胚胎毒性及机制的重要技术手段,能够用于WEC的胚胎材料包括鱼类、两栖类、鸟类及哺乳类胚胎。在传统毒理学研究中,啮齿类动物胚胎培养应用较多。随着组学技术发展,模式生物斑马鱼在高通量筛选和基因编辑中更具优势[12-13]。斑马鱼与哺乳动物一样具有高度保守的基因组和信号传导通路,其基因表达70%以上为人类基因的同源物[14]。同时斑马鱼具有繁殖力强、发育速度快、产卵多、胚胎透明、体外发育,易于操作和观察,存在大量基因突变体及成熟方便的转基因、基因敲低、基因敲除技术等优点[15]。斑马鱼胚胎现已成为发育毒性研究领域的强有力研究工具[16-18]。笔者从胚胎、器官和机制3个层面归纳了大气颗粒物诱导的斑马鱼胚胎毒性效应研究进展,以期为大气颗粒物的发育毒性研究提供数据支撑和思路指导。
1 胚胎毒性
许多研究者将斑马鱼胚胎暴露于大气颗粒物,来揭示颗粒物潜在的毒性及其分子机制。暴露于大气颗粒物的斑马鱼胚胎一致地表现出胚胎毒性,引起死亡率、畸形率增加,且因颗粒物的来源、暴露方式不同而表现出不同的毒性效应和强度(表1)。Mesquita等[19-20]将巴塞罗那一个城市网点收集的大气颗粒物样本二甲亚砜(dimethylsulfoxide,DMSO)溶解后,暴露于斑马鱼胚胎,所有20个样品中死亡率均未超过总暴露胚胎的5%,死亡率加畸形率均低于15%。所有样本呈较弱但一致的胚胎毒性,且部分相同月份不同年份的样品间毒性差异显著。Mesquita等[21]又将收集到的PM1有机提取物暴露于斑马鱼胚胎,死亡率并未增加,检测的16个样品中畸形率为10%~20%。Kim等[22]把在首尔市收集的PM2.5溶解于水,用不同浓度的PM2.5水溶液注射斑马鱼胚胎,暴露处理120 h后,PM2.5浓度为3 μgmL时,胚胎减缓发育达48%,存活率降低10%;PM2.5浓度为30 μgmL时,胚胎减缓发育达60%,存活率降低30%。在斑马鱼胚胎中微注射PM2.5水溶液可导致其呈剂量依赖性的发育速度减缓和严重的死亡。Duan等[23-24]将北京市区采集的PM2.5在水中超声溶解,并暴露于斑马鱼胚胎,PM2.5浓度为200 μgmL时,胚胎死亡率增至7.8%;PM2.5浓度为400 μgmL时,胚胎死亡率高达100%。PM2.5以剂量和时间依赖的方式降低孵化率、增加死亡率,引起胚胎毒性。Zhang等[25]将斑马鱼胚胎暴露于苏州市区5 mgL的PM2.5抽提的有机提取物(extractable organic matter,EOM),72 h后,诱发心脏缺损,显著增加了心脏畸形的发生率,降低了心率,胚胎孵化率也呈剂量依赖性下降。Zhang等[26]收集了济南市区PM2.5暴露于斑马鱼胚胎,显著增加了其死亡率、畸形率并降低孵化率,减小了斑马鱼体长。PM2.5暴露引起剂量和时间依赖的发育毒性增强,畸形更加明显,导致鱼鳔缺失、轻微卵黄潴留和心包水肿、体轴和尾弯曲、面部及眼部缺陷、斑马鱼幼鱼的运动能力损伤(总运动距离缩短和平均速度减缓)。
另外吸烟过程中形成的颗粒物也与许多疾病有关,但其发育效应的机制仍不清楚。Massarsky等[27-29]探究了参考香烟3R4F燃烧的总颗粒物(total particulate matter,TPM)对斑马鱼胚胎早期发育毒性,结果表明:TPM能在胚胎体内累积,增加死亡率和畸形率、延迟孵化、减小幼鱼体长、降低心率和代谢率、改变斑马鱼运动行为;暴露24 h的胚胎自主收缩频率较高;暴露144 h的幼鱼表现出游泳亢进即多动症,尤其是在黑暗条件下。
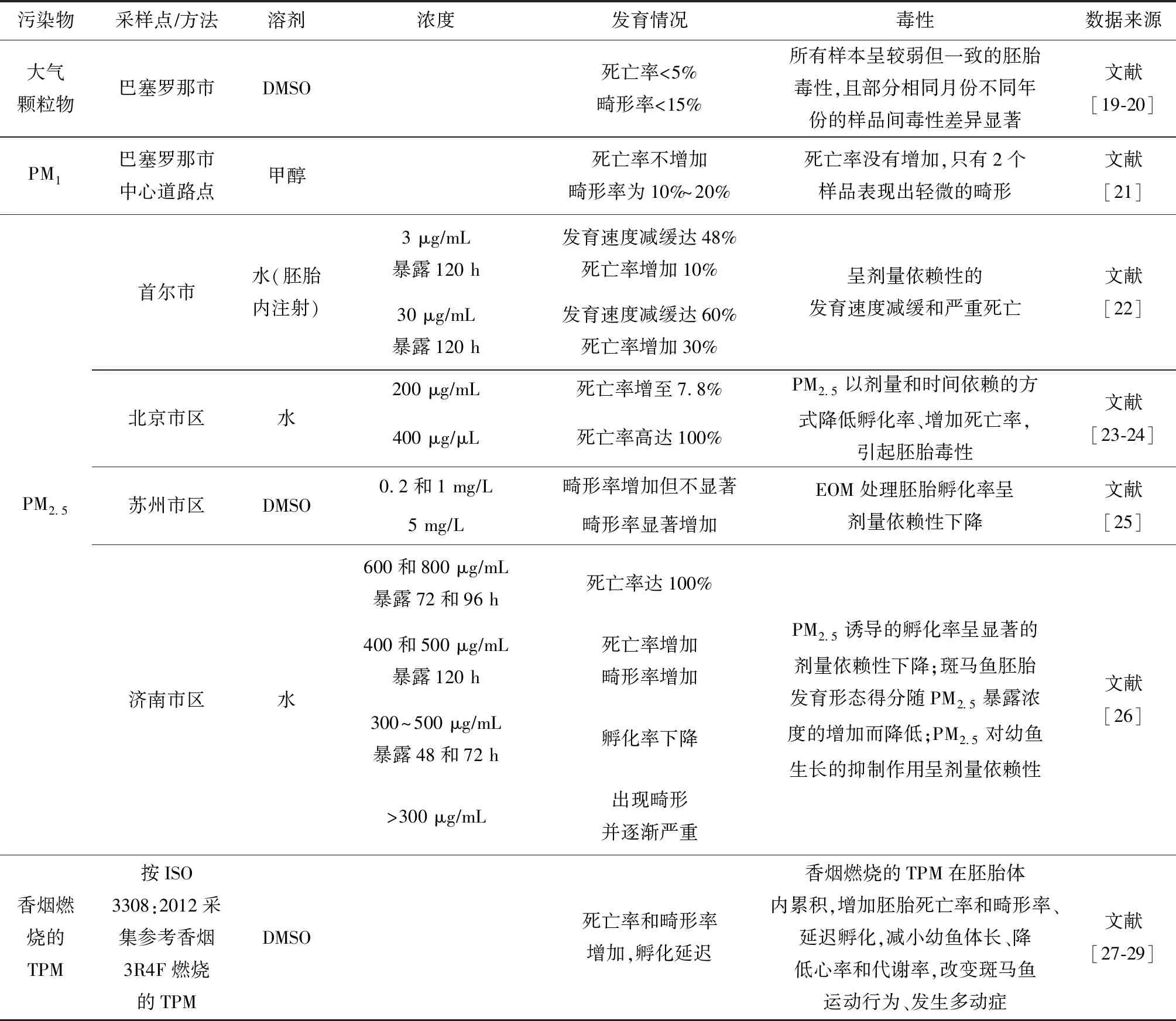
表1 大气颗粒物对斑马鱼胚胎毒性的影响
总之,来源于不同国家或同一国家不同地区的颗粒物,包括吸烟形成的颗粒物,用水或有机溶剂抽提处理后,不同浓度水平的抽提液直接暴露或进行注射,斑马鱼胚胎呈剂量和时间依赖性的发育毒性增加效应,主要引起斑马鱼胚胎畸形率升高、死亡率增加、孵化率下降、发育速度减缓、心率和代谢率降低,如鱼鳔缺失、轻微卵黄潴留和心包水肿、体轴和尾弯曲、面部及眼部缺陷,还减弱了斑马鱼幼鱼的总运动距离和平均速度,损伤运动能力。烟草颗粒物暴露还表现出游泳亢进,尤其是在黑暗条件时。
2 器官毒性
斑马鱼胚胎在发育过程中暴露于大气颗粒物,会发生心脏、肝、肠道、骨骼和肌肉、鱼鳔等多器官组织及心血管系统、神经系统和运动系统会损伤。在斑马鱼胚胎内注射浓度分别为30和3 μg/mL的PM2.5水提取物后,约21%和11%的胚胎背部骨骼畸形弯曲,且尾巴向上弯曲,呈现明显的剂量依赖性的骨骼变形[22]。
将北京市区采集的PM2.5溶解在水中,并对斑马鱼胚胎进行暴露,PM2.5浓度为200 μg/mL时,斑马鱼心包水肿、心率呈剂量依赖性下降,心脏区红细胞的相对数量显著降低,心排血量减少,造成心脏畸形,引发心脏毒性;应用200 μg/mL的PM2.5溶液对转基因斑马鱼Tg(fli-1:EGFP,内皮细胞表达)进行暴露,胚胎的静脉血管(subintestinal vessels,SIVs)面积显著减少至对照组的36.9%,呈剂量依赖性地抑制血管生成;PM2.5还可诱导斑马鱼幼体肝脏畸形,肝脏呈剂量依赖性减小,肝细胞间接触疏松,形态不规则,空泡细小,表现出肝组织退化、肝萎缩和卵黄囊滞留;PM2.5抑制Tg(NBT:GFP)转基因斑马鱼的轴突长度,改变轴突结构,引起神经元损伤,从而损伤神经系统[24]。
苏州市区采集的PM2.5抽提的EOM可明显引起斑马鱼胚胎心脏呈现球囊状心腔、心包水肿[25]。济南市区采集的PM2.5处理的斑马鱼胚胎,其心脏、肝脏、肠道和肌肉出现异常变化,细胞自噬积累显著增加;增加氧化应激水平和扰乱斑马鱼幼鱼的抗氧化防御系统,鱼鳔缺失,轻微蛋黄潴留和心包水肿,体轴和尾弯曲,面部及眼部缺陷,运动能力减弱;心肌层和心肌细胞减少,肝细胞间连接松散,肠绒毛磨损,肠壁变薄,肌组织中肌纤维稀疏,排列松散和紊乱;PM2.5浓度为200 μg/L时,除线粒体嵴肿胀外无其他损伤,但浓度增至300或400 μg/mL时,引起肝细胞结构异常,细胞器溶解,细胞质中出现液泡和许多自噬小体;Tg(zlyz-EGFP)暴露后,白细胞数显著增加,引起炎症反应[26]。巴塞罗那市采集的大气颗粒物引起斑马鱼幼鱼畸形,包括脊柱畸形、卵黄囊和心包水肿、鱼鳔畸形和平衡障碍[20-21]。
烟草TPM可导致斑马鱼胚胎多种心血管畸形,增加脑出血的发生率,破坏大脑主要血管的生成,引起大脑血管发育紊乱,这与Wnt(wingless-related MMTV integration site)信号的下调有关。中脑静脉(MsV)、后脑动脉(MtA)、大脑中静脉(MCeV)、后端大脑静脉(PCeV)、背侧纵静脉(DLV)和背中线交界处(DMJ)在大脑中形成一定的运行模式,但TPM可引起脑内该模式的改变。TPM还会引起心包水肿、弦心、下颌变短、蛋黄潴留、脊索弯曲,且TPM暴露后脑出血、心包水肿、弦心发生率呈剂量依赖性增加。对照组血红蛋白主要定位于心包,而TPM暴露的血红蛋白存在于其他部位,这是胚胎早期出血引起的。外源物质代谢和氧化应激的谷胱甘肽过氧化物酶(GPx)、谷胱甘肽还原酶、过氧化氢酶、超氧化物酶等标记物均受到影响。斑马鱼胚胎暴露24 h时,自发收缩的频率比正常高;144 h时,表现出游泳亢进。总之,TPM暴露会引起斑马鱼胚胎氧化应激、血管生成紊乱、耗氧量减少等问题[29]。大气颗粒物引起的斑马鱼胚胎器官毒性汇总见表2。
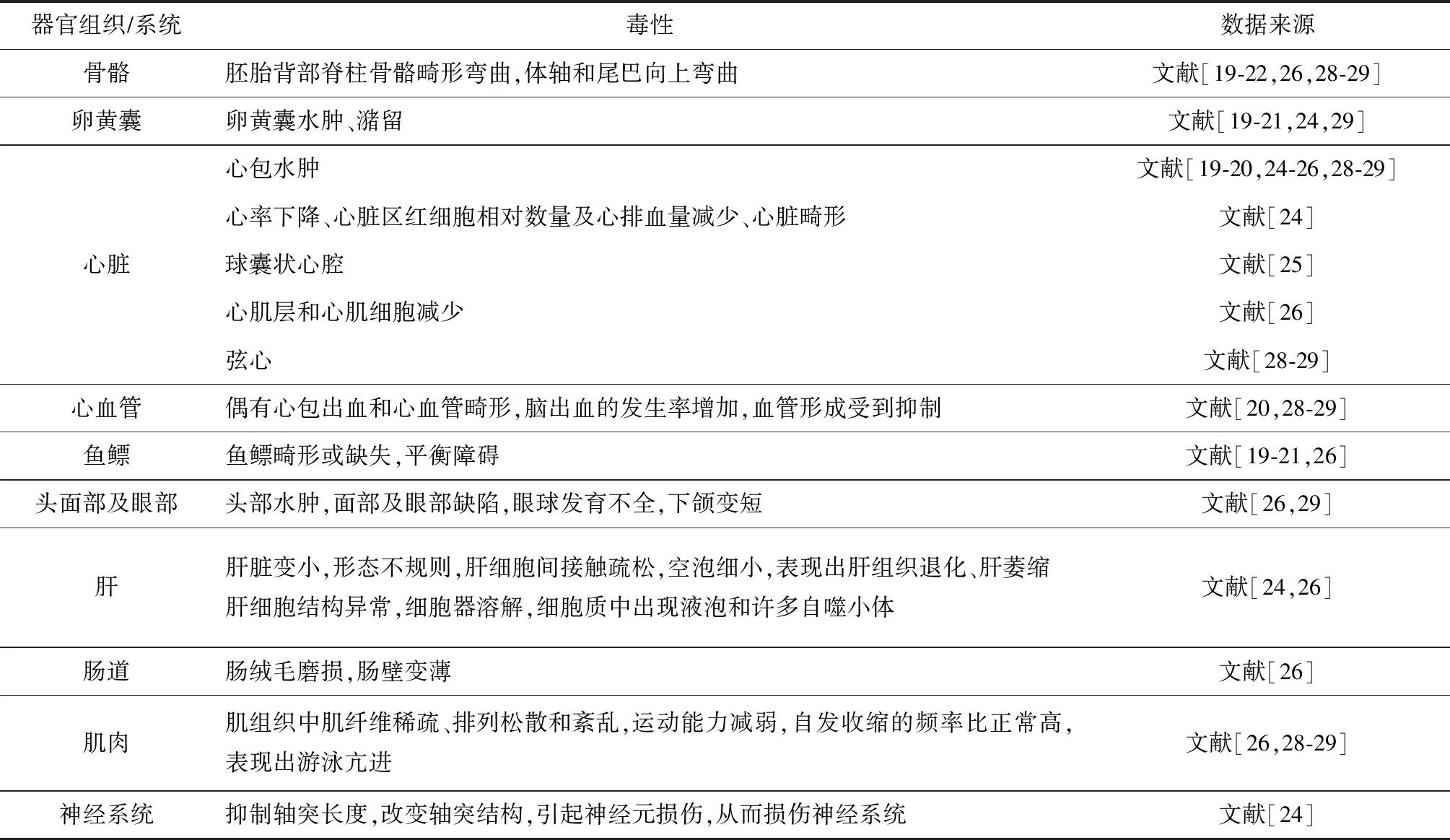
表2 大气颗粒物引起的斑马鱼胚胎器官毒性汇总
综上,大气颗粒物暴露后引起斑马鱼胚胎骨胳畸形弯曲,体轴和尾弯曲;轻微卵黄潴留,心包水肿,心脏区红细胞相对数量和心排量减少,血管形成受到抑制,心肌层和心肌细胞减少,心脏畸形,心率和代谢率降低;畸形明显,如鱼鳔缺失或畸形,平衡障碍,面部及眼部缺陷;肝细胞间接触疏松,形态不规则,空泡细小,表现出肝组织退化、肝萎缩、肝脏变小;抑制轴突长度,改变轴突结构,引起神经元损伤,从而损伤神经系统;肠绒毛磨损,肠壁变薄;肌组织中肌纤维稀疏,排列松散和紊乱。
3 分子毒性机制
3.1 氧化应激及炎症反应
PM2.5可以使斑马鱼胚胎释放炎性细胞因子和激活活性氧。PM2.5通过氧化应激影响斑马鱼胚胎发育,导致其死亡[22]。Zhang等[26]发现300和400 μg/mL的PM2.5暴露后,斑马鱼胚胎白细胞数显著增加,相关基因Tgfβ和Cox2表达量上调,证明PM2.5可显著增加斑马鱼胚胎炎症反应。另外PM2.5暴露导致斑马鱼胚胎活性氧(ROS)生成量和丙二醛(malondialdehyde,MDA)量增加,SOD(superoxide dismutase)和GSH(glutathione)量减少,表明其可损伤胚胎的氧化防御系统。促炎因子的过量表达、ROS持续性大量存在均会损伤内质网或其他细胞器。进一步检测与胚胎内质网应激(endoplasmic reticulum stress,ERS)相关的Hspa5、Chop、Ire1、Xbp1s和Atf6 5个基因,其表达量均上调,揭示PM2.5通过Ire1-Xbp1和Atf6通路诱导斑马鱼胚胎产生ERS,ERS可诱导自噬,细胞内自噬小体累积,检测的Lc3、Beclin1和Atg3自噬相关基因表达量上调。以上研究结果表明,炎症和ERS诱导的自噬参与了PM2.5诱导的斑马鱼胚胎发育毒性。
香烟TPM的各种成分可引起斑马鱼胚胎病变,但发育缺陷的机制尚不清楚。Massarsky等[27]应用TPM1.4处理斑马鱼胚胎,发现暴露72 h后Cyp1a的体内活性显著降低,96 h后胚胎的GST(glutathione-S-transferase)活性增强,且氧化应激的标记物〔如GR(glutathione reductase)〕活性显著增加,但SOD、Gpx(glutathione peroxidase)、CAT(catalase)的活性没有变化。过氧化氢和脂质过氧化物GR能还原GSSG(oxidized glutathione),再生成GSH,GSSG可通过GSH与ROX(主要是过氧化氢和脂质过氧化物)形成。在TPM处理组(包括0.4 μg/mL尼古丁、1.4 μg/mL TPM0.4和TPM1.4)TGSH和GSSG的浓度、GSSG∶TGSH均显著升高,但GSH浓度不受影响。相对地,基础耗氧率(oxygen consumption rate,OCR)仅在TPM1.4组显著降低,引起FCCP诱导的绝对最大速率降低。可推测TPM暴露的斑马鱼中GSH的合成较高,以保持恒定的GSH水平来中和ROS或溶解TPM的有毒组分,GSSG∶TGSH的增加标志着存在氧化应激。将分别含0.1、0.5和1.0 μg/mL尼古丁的TPM处理斑马鱼胚胎,与氧化还原系统相关的Nrf2、Gpx1、CuZnSOD、MnSOD和GCLc基因随发育时间不同表达量无明显变化,但有几个统计上的显著变化。如在TPM1.0暴露的幼鱼中,Nrf2、CuZnSOD、MnSOD等几种抗氧化基因的转录表达量呈下降的趋势,而在暴露24 h时Gpx1的转录表达量略有下降,随后上升到对照组水平[30]。
综上,PM2.5和香烟TPM可使斑马鱼胚胎发生氧化应激和炎症反应,并诱导自噬,导致胚胎毒性。
3.2 基因表达
斑马鱼胚胎暴露于大气颗粒物后,大多数研究表明基因mRNA表达量发生相对变化(表3),且不同的大气颗粒污染物来源(如城市、乡村)基因表达量变化存在差异,部分基因mRNA表达量与样品的化学成分有关,如与有机物呈正或负相关。Duan等[23]探索了PM2.5对斑马鱼模型动物的全基因表达的影响,发现PM2.5可诱导2 311个基因表达差异,其中1 261个基因高表达,1 050个基因低表达。诱导高表达基因的基因本体论(GO)分析发现,其涉及氧化还原过程、转运、外源物质刺激反应、化学刺激反应、代谢过程、蛋白酶解、跨膜转运、细胞氧化还原稳态、铁离子转运与甾体生物合成等生物过程;低表达基因涉及的功能包括造血干细胞分化、成体喂养行为、药物转运、食欲负调节、DNA介导的转录调节、MAPKK活性激活、细胞饥饿反应、细胞黏附、侧板中胚层发育和亲同种抗原的细胞黏附。基于KEGG数据库,对基因通路相互作用进行分析,主要涉及细胞色素P450对异源性物质代谢、谷胱甘肽代谢及代谢通路;细胞色素P450对药物的代谢,苯丙氨酸代谢,酪氨酸代谢,ABC转运体,色氨酸代谢,类固醇合成,甘氨酸、丝氨酸和苏氨酸代谢,甾体激素生物合成,辅酶Q等萜烯类醌生物合成,卟啉和叶绿素代谢,烟酸和烟酰胺代谢,PPAR信号通路与亚油酸代谢。PM2.5仅通过单一途径显著抑制光转导。另外,通过信号网络分析鉴定了PM2.5诱导的斑马鱼胚胎关键基因,揭示了其可能的作用机制。在信号网中获得63个关键基因,差异程度超10的有9个。qRT-PCR鉴定结果表明,Cyp3a65、Mgst2、Gstp1、Gsto2、Gsto1和Cyp1a表达量均显著上调,Ephx1无显著变化,Gstal和Aldh3b1均有明显的下调。
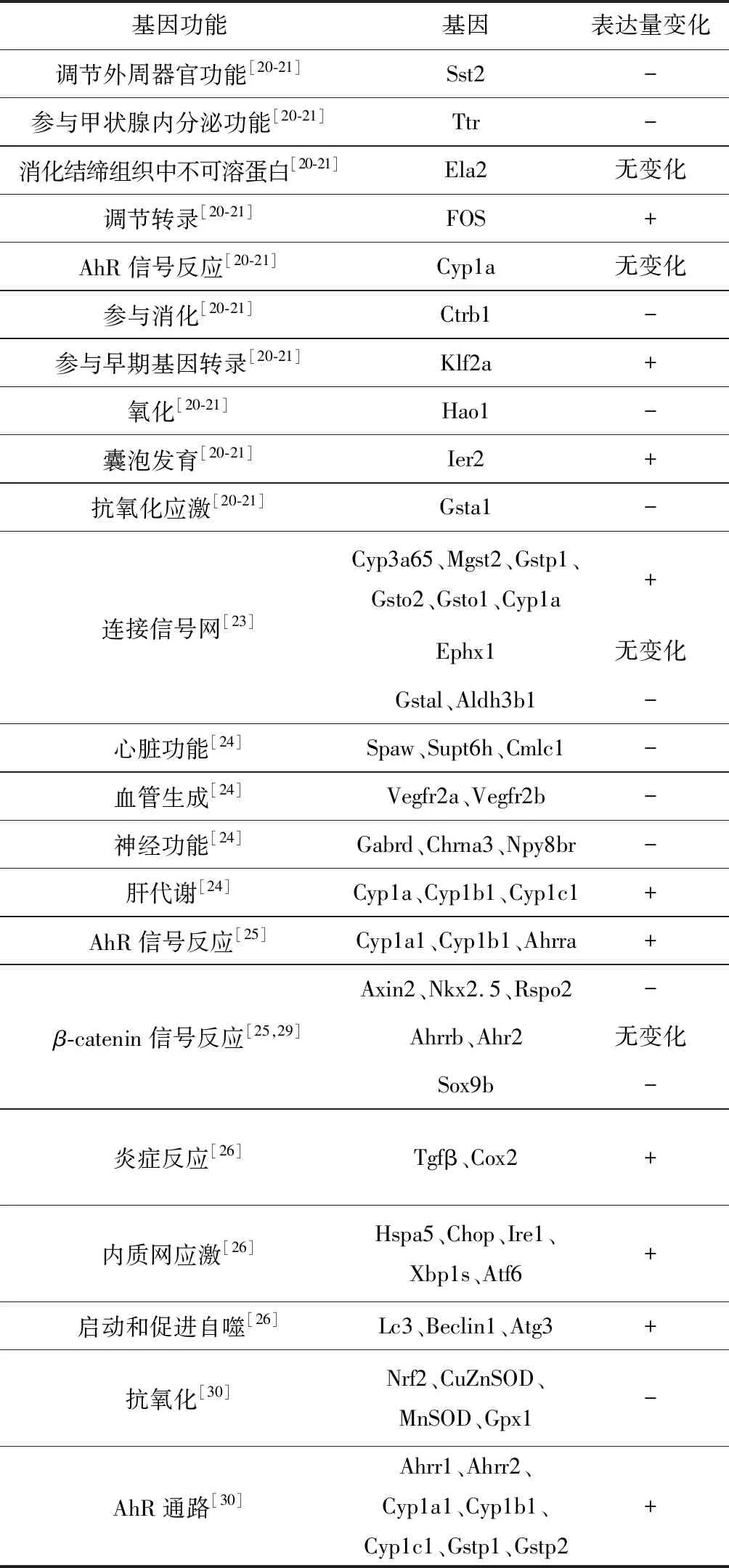
表3 大气颗粒物引起斑马鱼胚胎的基因表达量变化汇总
注:+表示基因表达量上调;-表示基因表达量下调。
Mesquita等[20]研究发现,斑马鱼胚胎暴露于大气颗粒物后,4 603个基因的mRNA表达量发生了显著变化。分层聚类表明,城市和农村样本间存在差异效应。K-means聚类分析将基因分成3类,并对其进行GO分析,包括暴露于农村提取物的胚胎中高表达基因1 835个:1)涉及蛋白质折叠和RNA-蛋白质相互作用的胚胎发育基本功能;2)暴露于城市样本的胚胎中mRNA表达量增加,而暴露于农村样本的胚胎中mRNA表达量不足的577个基因,不涉及任何功能;3)任何暴露处理后,表达量都显著增加的2 191个基因,涉及氧化还原反应的硫氧还蛋白样酶、谷胱甘肽-转移酶以及氧化应激的经典标记物,如过氧化氢酶(CAT)和谷胱甘肽-过氧化物酶(Gpx1a,Gpx4a)。进一步筛选Cyp1a、Egln3、Gsta1、Ela2、Ctrb1、Sst2、Hao1、Ttr、Fos、Junbb、Ier2、Ahrra和Klf2a等13个基因做qRT-PCR分析,发现表达量与样品的化学成分有关。暴露于PM1有机提取物的胚胎中,大多数基因mRNA表达量发生相对变化,且与相应PM1提取物污染水平相关。聚类分析确定了2种表达模式基因组:1)由Gstal、Hao1、Ctrb1、Sst2和Ttr基因组成的负相关组;2)由FOS、Ier2和Klf2a基因组成的正相关组。Cyp1a和Ela2介于二者之间。Cyp1a表达与样品的二英活性呈显著正相关,FOS、Ier2、Klf2a与多环芳烃(polycyclic aromatic hydrocarbons,PAHs)和元素碳(elemental carbon,EC)呈显著正相关。相反,基因Gstal、Hao1、Ctrb1、Sst2和Ttr与PM中几种有机物,尤其是与氧化化合物(IsoOXI和PinOXI)和生物质燃烧相关的标记物(C3-C5 DCAs和BB标记物)等呈负相关。分析与AHR通路相关的Ahr2、Ahrr1、Ahrr2、Cp1a、Cyp1b1、Cyp1c1、Gstp1和Gstp2基因的表达水平,Ahrrs、Cyps和Gsts均明显上调,且大部分早在暴露24 h时就已上调。Cyps和Gsts的表达量通常在暴露24 h达到高峰,48 h后有下降趋势[21]。
Duan等[23]探索PM2.5对斑马鱼模型动物microRNA表达的影响,发现PM2.5共诱导27种microRNA发生变化,其中13种上调,14种下调;并用qRT-PCR方法验证了let-7b、let-7i、miR-122、miR-153b-3p、miR-19a-3p、miR-19b-3p、miR-24和miR-7a 8个microRNA在斑马鱼中的表达差异,结果表明,PM2.5处理后let-7b、miR-153b-3p、miR-122和miR-24显著上调,let-7i、miR-19a-3p、miR-19b-3p和miR-7a显著下调。
3.3 心脏发育分子机制
PM2.5与先天性心脏缺陷之间存在关联,PM2.5中许多有机成分可作为AhR(aryl hydrocarbon receptor)激动剂,激活AhR可以拮抗Wnt/β-catenin信号。AhR信号通路的激活可导致鱼类胚胎的心脏畸形[32],Wnt/β-catenin信号的激活在早期发育阶段可诱导心脏分化,但在发育后期会抑制分化[33],Sox9b和Nkx2.5都是斑马鱼心脏发育所必需的关键转录基因[34]。Zhang等[25]在研究PM2.5毒性机制时,先假定PM2.5可激活AhR,进而抑制心脏发育必需的Wnt/β-catenin靶基因的表达,从而导致心脏缺陷。研究过程中应用PM2.5的EOM对斑马鱼胚胎AhR和Wnt/β-catenin信号通路的影响进行分析。结果表明:EOM可导致斑马鱼胚胎在暴露72 h时心脏畸形和心率下降,EOM+AhR拮抗剂CH223191或β-catenin激动剂CHIR99021共同暴露的胚胎与仅暴露于EOM相比,胚胎心脏缺陷得到挽救;EOM增加了AhR靶标基因Cyp1a1、Cyp1b1和Ahrra的表达水平,降低β-catenin靶标基因Axin2、Nkx2.5、Sox9b的mRNA水平;PM2.5的EOM激活AhR信号通路,使暴露于EOM的斑马鱼胚胎3个AhR靶基因Cyp1a1、Cyp1b1和Ahrra的mRNA表达水平显著上调,3个β-catenin靶基因Axin2、Sox9b和Nkx2.5在斑马鱼胚胎中的mRNA表达水平显著下调,Ahrrb和Ahr2表达量不受暴露影响,β-catenin自身的蛋白水平下调。这些变化可能与EOM诱导的心脏缺陷有关。
AhR和Wnt/β-catenin信号通路间存在交叉作用,AhR抑制剂CH缓解了EOM诱导的β-catenin靶基因下调水平,β-catenin激活剂CHIR抑制EOM诱导的AhR靶基因Cyp1a1过表达。PM2.5的EOM激活AhR信号,通过抑制Rspo2表达和Wnt/β-catenin信号,导致对心脏发育至关重要的基因表达异常[35]。Massarsky等[30]进一步研究发现,TPM引起的畸形发生率一般不受NAC/BSO治疗或Nrf2敲除的影响。相反,Ahr2基因敲除会降低畸形率,而Cyp1a或Cyp1b1基因敲除会增加畸形率。基因敲除试验表明,AHR途径,而不是抗氧化途径介导TPM毒性。转基因(Flk1:EGFP)斑马鱼暴露于TPM后,脑内血管量下降,但关键血管生成基因Ti2、Angpt1、Notch3和Flk1的表达量基本不变,Vegf的表达量则随着TPM浓度的增加而增加。Massarsky等[36]研究发现,TPM可导致多种心血管畸形,大脑血管发育紊乱。这些影响与Wnt信号通路基因表达水平降低和β-catenin蛋白表达量的下调有关。TPM与CHIR共处理,能改善mRNA表达水平,但不能减缓TPM诱导的心血管毒性。TPM损伤脑血管发育,但该效应与血管生成基因的表达变化不相关。
综上,大气颗粒物通过氧化应激和炎症反应,引起细胞凋亡、自噬,调控相关基因的表达,影响心血管、神经和运动系统发育,从而诱导胚胎发育毒性。
4 结语
(1)斑马鱼胚胎暴露于大气颗粒物,可引起死亡率、畸形率增加,且因颗粒物的来源、暴露方式不同而表现出不同的毒性效应和强度。
(2)暴露于大气颗粒物后,斑马鱼胚胎骨骼畸形弯曲,体轴和尾弯曲;轻微卵黄潴留,心包水肿,心脏区红细胞相对数量和心排量减少,血管形成受到抑制,心脏畸形,心率和代谢率降低;畸形明显,如鱼鳔缺失或畸形,平衡障碍,面部及眼部缺陷;肝细胞间接触疏松,形态不规则,空泡细小,表现出肝组织退化、肝萎缩、肝脏变小;抑制轴突长度,改变轴突结构,引起神经元损伤,从而损伤神经系统。大气颗粒物可通过改变斑马鱼胚胎全基因表达、胚胎microRNA表达、心脏AhR和Wnt/β-catenin通路相关基因表达,影响炎症、氧化应激等生理过程,导致胚胎毒性和器官畸形,影响心血管、神经、运动等系统发育。
(3)目前,多应用体外细胞试验来研究大气颗粒物对胚胎发育毒性的影响,斑马鱼作为发育毒理学研究的主要模型动物,未来可成为揭示大气颗粒物诱导产生的发育毒性效应和机制的强有力研究工具。

