猪血浆球蛋白的高效制备研究
杨海,张淇美,龚慧芳,唐青海,阳希,岳跃飞
(1.衡阳师范学院 南岳山区生物资源保护与利用湖南省重点实验室,湖南 衡阳 421008;2.南岳生物制药有限公司 湖南省血液制品工程技术研究中心,湖南 衡阳 421007)
我国是养猪大国,随着养猪业的规模化发展和猪肉消费的持续增加,猪血逐渐成为生猪集中屠宰加工过程中的重要副产物[1]。据估计,2019 年我国猪血产量约200 万吨,由于深加工技术制约,大部分猪血用来直接食用或制作动物饲料等低附加值产品[2],因此,猪血深加工技术越来越受到重视[3]。
球蛋白是一类具有抗体活性或结构与抗体相似的球蛋白,是机体免疫作用和抗病能力中最关键、最直接的基础性物质,在人和动物疾病防治中发挥了重要作用。据报道,猪免疫球蛋白能有效治疗轮状病毒引起的婴幼儿腹泻[4]、家禽呼吸道疾病[5],仔猪口服猪免疫球蛋白能显著提高存活率[6],在科研工作中则常常用来标记抗原[7]。随着人们对猪球蛋白功能的认识不断深化,猪球蛋白在生物医药中的应用逐渐铺开,市场对猪球蛋白量与质的需求越来越高,迫切需要对猪球蛋白的高效制备技术进行研究。
从母猪初乳中可以提取到高质量的猪球蛋白,但存在提取成本高、条件要求高、原料来源少等不足,难以规模化生产。猪血中的球蛋白含量高达2 %,而且产量丰富,成本低廉,因此,从猪血中提取球蛋白是实现猪球蛋白规模化生产的可靠途径[8]。目前,从猪血中提取球蛋白的方法有盐析法、辛酸沉淀法、层析法、免疫吸附法、利凡诺法等,存在回收率低、纯度低、成本高以及环境污染等不足[8-9]。
本研究旨在以新鲜猪血为原料,采用差速离心法获得猪血浆,探索并确定猪血浆球蛋白制备过程中的血浆稀释倍数、pH、乙醇浓度和温度四个关键参数,通过三次乙醇反应和纯化操作,从猪浆血中分离提取球蛋白,为猪血浆球蛋白的规模化制备提供参考。
1 材料与方法
1.1 主要试剂
柠檬酸三钠、五水硫酸铜、酒石酸钾钠、碘化钾、乙醇、氯化钠、柠檬酸、醋酸、醋酸钠、氢氧化钠、盐酸均购自天津科密欧试剂公司,标准酪蛋白购自Sigma 公司,猪球蛋白标准品购自北京博尔西公司,蛋白Marker 购自赛默飞公司。
1.2 主要仪器
pH 计(优特仪器有限公司,ECPH70042S)、低温离心机(Eppendorf, 5920 R)、探针式温度计(欧达时,TP500)、低温恒温槽(江苏恒诺仪器有限公司,NDC-3020J)、全自动蛋白电泳分析仪(美国海伦娜公司,SPIFE4000)、可见分光光度计(尤尼柯仪器有限公司,UV2150)、磁力搅拌器、电热恒温水浴锅等。
1.3 试验方法
1.3.1 差速离心获取血浆
新鲜猪血和3.8 %的柠檬酸三钠按照9:1 比例混匀,4 ℃静置30 min 后,4 ℃1000 r/min 离心30 min;取上清液,4 ℃3000 r/min 离心30 min,取上清液,得到清亮血浆。血浆分装,于-20 ℃条件下保存。
1.3.2 蛋白浓度测定
采用双缩脲法测定蛋白含量,具体操作为:将蛋白溶液与试剂按表1 混合,37 ℃水浴20 min,冷却至室温后,在紫外分光光度计(540 nm)上进行检测并获得数据。
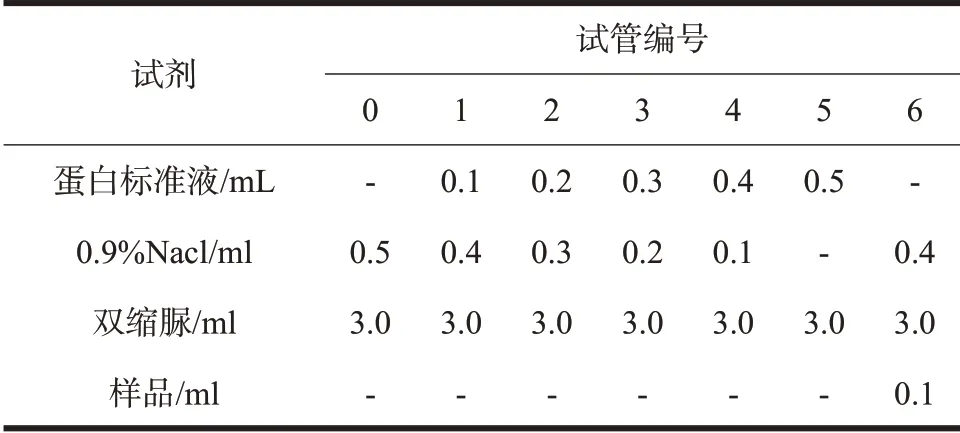
表1 猪血浆蛋白浓度配比
1.3.3 猪血浆球蛋白的制备
根据拟定的猪血浆球蛋白制备技术路线(图1),将乙醇反应分为三个阶段,在低温恒温槽内完成三次乙醇反应:

图1 猪血浆球蛋白制备技术路线
第一次乙醇反应:用0.9 %的氯化钠稀释血浆至蛋白含量为5 %,1 mol/L 的柠檬酸调pH 至6.8-7.1,降温至1.5 ℃-0.5 ℃;边搅拌边缓慢加入-15 ℃、95 %的乙醇,控制最终乙醇浓度为20 %(按每1000 毫升血浆制品加267 毫升95 %乙醇计算);复测pH 并调制6.9-7.1,于-4.5 ℃至-5.0 ℃搅拌(反应),-3.0 ℃至-5.0 ℃温度下离心30 min,取沉淀。
第二次乙醇反应:沉淀用-2 ℃-0 ℃、0.01 mol/L的氯化钠溶解,定容至12-14 倍沉淀体积;沉淀充分溶解后,用pH4.0 的醋酸-醋酸钠缓冲液调pH 至5.4-5.6,降温至-0.5 ℃--1 ℃;边搅拌边缓慢加入-20 ℃、95 %的乙醇,控制乙醇终浓度为14.5 %-15 %;复测pH 并调至5.4-5.5,-4.8 ℃至-5.3 ℃条件下搅拌(反应);-3.0 ℃至-5.0 ℃条件下离心30 min,取上清。
第三次乙醇反应:每1 L 上清加入5 g 氯化钠,控制乙醇浓度为18 %-20 %;用0.5 mol/L 的氢氧化钠调pH 至6.9-7.1;-5 ℃至-6 ℃条件下搅拌(反应),-4.0 ℃至-6.0 ℃条件下离心30 min,沉淀即为球蛋白粗品。
蛋白纯化:5 倍球蛋白粗品沉淀量、2-4 ℃的去离子水溶解沉淀;1 M/L 的醋酸调pH 至4.0 左右,澄清后过滤,收集沉淀;中空纤维超滤柱超滤脱醇;0.5 M/L 的盐酸调pH 至3.6-3.7;调蛋白浓度至6-8 %,用7-8 ℃的去离子水连续6 次等体积透析,收集沉淀并冻干,于-20 ℃条件下保存。
1.3.4 猪血浆球蛋白的定性定量分析
采用SDS-PAGE 法进行定性分析,即采用5 %浓缩胶、12 %分离胶,获得SDS-PAGE 电泳图,并于标准蛋白进行比对。
取0.1 g 冻干后的粗蛋白沉淀,充分溶于100 mL 的纯净水中,利用全自动蛋白电泳分析仪完成蛋白定量检测,直接获取蛋白纯度和含量数据,并采用SPSS11.0 软件对数据进行统计分析。
2 结果与分析
2.1 目标蛋白的定性分析
SDS-PAGE 电泳图谱分析可知,如图2 所示,提取产物在56KD 和27kD 处出现标志性条带,与猪血浆球蛋白标准品条带大小一致,说明获得物为猪血浆球蛋白。
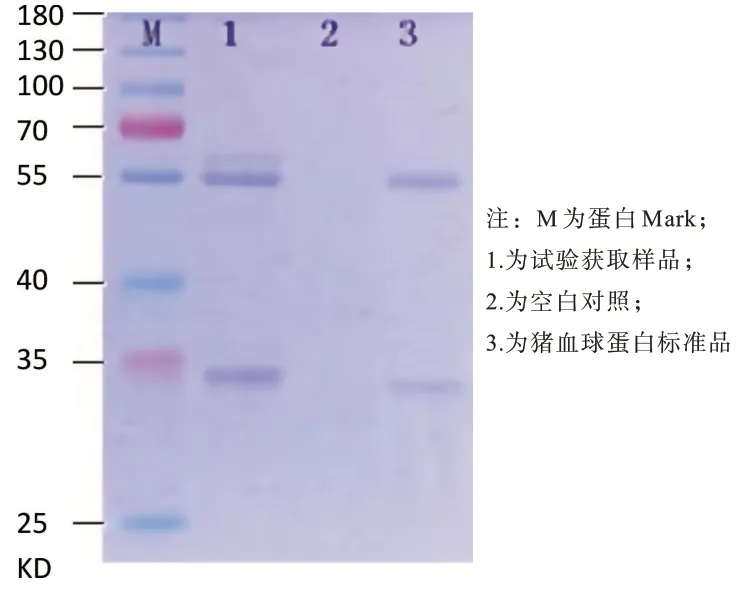
图2 球蛋白SDS-PAGE 电泳图谱
2.2 目标蛋白的定量分析
全自动蛋白电泳分析仪获得扫描图像(图3),结果显示,猪血浆蛋白峰单一且集中,说明提取的蛋白具有较高的纯度。

图3 球蛋白电泳分析图谱
2.3 第二阶段稀释倍数对球蛋白制备的影响
第二阶段不同稀释倍数对球蛋白提取的影响见表2。由表2 可知,当蛋白沉淀稀释12 倍时,球蛋白得率可以达到25.6 g,纯度可以达到99.3 %,明显高于稀释倍数为17和22时的球蛋白得率和纯度。

表2 第二阶段不同稀释倍数对球蛋白提取的影响
2.4 pH 对球蛋白制备的影响
乙醇反应时,pH 对球蛋白提取的影响见表3、表4 和表5。

表3 第一阶段乙醇反应pH 对球蛋白提取的影响
由表3 可知,第一阶段乙醇反应,当pH 为7.0时,球蛋白得率和纯度最高,分别达到29.1 g 和97.2 %,显著高于pH 为6.0 和6.5 时的球蛋白得率和纯度,说明第一次乙醇反应的适宜pH 为7.0。

表4 第二阶段乙醇反应pH 对球蛋白提取的影响
由表4 可知,第二阶段乙醇反应,当pH 分别为4.5、5.0 和5.5 时,球蛋白得率没有显著差异,均超过24 g,但pH 为5.5 时的球蛋白纯度显著高于pH 为4.5 和5.0 时的球蛋白纯度。

表5 第三阶段乙醇反应pH 对球蛋白提取的影响
由表5 可知,第三阶段乙醇反应,当pH 为6.5和7.0 时,球蛋白得率没有显著差异,但均高于pH为6.0 时的球蛋白得率;pH 分别为6.0、6.5 和7.0时,球蛋白纯度却无显著差异。
2.5 乙醇浓度对球蛋白制备的影响
第二阶段乙醇浓度对球蛋白制备的影响见表6。

表6 第二阶段乙醇浓度对球蛋白提取的影响
由表6 可知,第二阶段乙醇浓度为15 %时,可以获得较好的球蛋白得率和纯度,乙醇浓度为10 %和20 %时,球蛋白得率和纯度差异并不显著,但低于15 %的乙醇浓度时,蛋白得率和纯度则会显著降低。

表7 第三阶段乙醇浓度对球蛋白提取的影响
由表7 可知,第三阶段乙醇浓度为18 %时,可以获得较好的球蛋白得率和纯度,高于18 %的乙醇浓度时,球蛋白得率和纯度差异不显著,但低于18 %的乙醇浓度时,球蛋白得率和纯度则会显著降低。
3 结论与讨论
球蛋白是决定机体抗病能力的关键物质,也是具有广阔市场前景的生物药物[10]。球蛋白可以从初乳、蛋黄等生物材料中提取,但存在成本高、条件要求高等不足。随着我国养猪业的规模化发展和生猪集中屠宰的推进,猪血深加工逐渐成为一个行业热点问题。免疫球蛋白占猪血浆蛋白总量的16.3 %,从猪血浆中提取球蛋白成为首选[11]。因猪血的成分复杂,脂蛋白含量高,提取其球蛋白方法不同程度地存在纯度低、回收率低、分离效率低、成本高以及介质残留等尚待解决的问题,因此建立一套成熟的猪血浆球蛋白制备工艺,对于延长猪血产品附加值、减少屠宰环节污染、促进生物产业发展均具有重要意义。
低温乙醇沉淀法是人血浆球蛋白制备的主要方法,其基本原理是:低温状态下,血浆中加入乙醇,借助乙醇较低的介电系数,夺取与溶质结合的水分子,使蛋白质分子间的吸引力增大,溶解度降低,继而生成沉淀。低温乙醇沉淀法用于制备猪血浆球蛋白,必须解决此方法的适用性问题,特别是需要探明影响猪血浆球蛋白得率和纯度的关键参数。
蛋白浓度对低温乙醇法提取蛋白具有重要影响[12]。蛋白浓度过高会引起目标蛋白变性(形成聚合体)或者纯度降低,蛋白浓度过低则会降低目标蛋白的回收率。因此,要使球蛋白充分溶解,提高得率,第二次乙醇反应时的沉淀物稀释倍数非常重要。本研究的结果表明,第二次乙醇反应时,沉淀12 倍稀释,球蛋白得率和纯度分别为25.6 %和99 %,显著高于沉淀17 倍和22 倍稀释时的球蛋白得率和纯度(p<0.05),说明沉淀稀释倍数在12 倍时,比较适合猪血浆球蛋白分离。
蛋白质是带电的两性电解质,当蛋白质溶液处于等电点pH 时,蛋白间的静电荷为零,相邻的蛋白质由于没有静电斥力而集聚沉淀。猪血浆球蛋白的等电点pH 在5.8-7.3 之间,因此,获得三次乙醇反应的适宜pH 是进行高效制备球蛋白的前提和基础。第一次乙醇反应的主要目的是沉淀血浆球蛋白,因此pH 要靠近球蛋白的等电点,并远离杂蛋白的等电点,使球蛋白形成沉淀,杂蛋白则留在上清液中。研究结果表明,pH 在7.0 时,球蛋白得率和纯度分别为29.1 %和97 %,显著高于pH为6.0 和6.5 时的蛋白得率和纯度(p<0.05),说明pH7.0 比较适合猪血浆球蛋白分离。第二次乙醇反应的主要目的在于去除沉淀杂蛋白,pH 在5.5 时,球蛋白得率和纯度分别为26.7 %和99 %,显著高于pH 4.5 和5.0 时的得率和纯度(p<0.05),说明pH 在5.5 时适合猪血浆球蛋白分离。第三次乙醇反应主要目的在于沉淀球蛋白。研究结果表明,pH在7.0 时,球蛋白得率和纯度分别为33.0 %和98.7 %,显著高于pH 6.0 和6.5 时的得率和纯度,说明pH 在7.0 时适合猪血浆球蛋白分离。
乙醇可以降低蛋白的介电系数,使其溶解度急剧下降,随着乙醇浓度的提高,球蛋白溶解度逐渐下降,调整乙醇浓度是沉淀球蛋白的手段之一。第二次乙醇反应,乙醇浓度在15 %时,球蛋白得率和纯度分别为30.8 %和98.4 %,显著高于乙醇浓度在10 %和乙醇浓度在20 %时的得率和纯度(p<0.05),说明乙醇浓度在15 %时,比较适合猪血浆球蛋白分离;第三次乙醇反应,乙醇浓度在18 %时,球蛋白得率和纯度分别为28.7 %和98.5 %,显著高于乙醇浓度在11 %和乙醇浓度在25 %时的得率和纯度(p<0.05),说明乙醇浓度在18 %时适合猪血浆球蛋白分离。
温度是维持蛋白结构功能的主要因素[13],球蛋白是一种活性蛋白,制备过程中的温度控制非常关键。本研究采用高精度探针式温度计对乙醇和蛋白工作液进行温度检测,在低温恒温槽(温度波动范围±0.05 ℃)内完成三次乙醇反应,有效保障了球蛋白制备过程的温度要求。研究表明,全程操作温度控制在-4 ℃至-5 ℃的情况下,猪血浆球蛋白具有较高的回收率和纯度,也具有较清晰的电泳图谱。
目前,已有低温乙醇法提取牦牛血清球蛋白[14]和抗人T 细胞猪免疫球蛋白[15]的报道,尚无低温乙醇法制备非特异性猪血浆球蛋白的报道,本文对低温乙醇法制备猪血浆球蛋白进行了适用性研究,确定了工艺步骤和关键参数,获得了较高的球蛋白回收率和纯度,为猪血浆球蛋白的规模化制备提供了参考。

