山东某地散养猪源大肠杆菌抗药性研究
骆延波 , 胡 明 , 李璐璐 , 张 印 , 张 庆 , 赵效南 , 齐 静 , 邓旭明 , 刘玉庆
(1.吉林大学动物医学学院 , 吉林 长春 130062 ;2.山东省农业科学院畜牧兽医研究所 山东省畜禽疫病防治与繁育重点实验室 , 山东 济南 250100)
自从我国首次报道质粒介导的黏菌素耐药机制(MCR-1)在动物和人体内出现以来[1],世界各地均有报道[2-5]。在大肠杆菌中发现mcr-1基因是很重要的,因为多黏菌素被认为是治疗多重耐药细菌感染最后使用的抗生素[6]。多个重要的实例证明,mcr-1基因可能与动物过度使用多黏菌素有关,并且这个基因大多源自兽医临床分离株。新德里金属β-内酰胺酶-1 (New delhi metallo-β-lactamase 1,NDM-1)自2008年首次在肠杆菌科细菌中发现后,在世界各地广泛流行并迅速蔓延,严重威胁着人类健康,成为一个全球性的公共卫生学问题[7-8]。国内外关于mcr-1基因和ndm-1基因的研究多集中在医院、社区和规模化养猪场,对于散养猪或小型养猪场研究很少。在我国养殖水平较高的省份和地区养猪大多以规模化、集约化养殖模式为主,但很多地区存在着个体散养方式。由于养殖模式和管理水平存在着较大差异,也会导致饲养管理方式不同,从而在疫病控制、细菌抗药性水平、生产效率等方面存在区别。本试验调查山东省某地个体散养猪模式和商品猪场规模化的差异,特别是针对以上2种基因的存在情况,特选取该地区散养猪较为集中的乡镇进行了研究,为不同的养殖模式管理提供一定的参考依据。
1 材料与方法
1.1 材料
1.1.1 采集的样品 在山东省某地采集相关样品200份,包括商品化猪场和散养户的猪饲料、饮水、猪粪、猪肛拭子、猪鼻拭子和村庄污水。
1.1.2 培养基 大肠杆菌显色培养基、沙门菌显色培养基、高盐培养基、MHB液体培养基、MHA固体培养基,均购自北京陆桥生物技术有限责任公司。
1.1.3 药物 多黏菌素、强力霉素、头孢噻呋、庆大霉素、氟苯尼考、恩诺沙星、氨苄西林、新霉素,均为100 mg/支,均购自中国兽医药品监察所。
1.1.4 仪器 96点阵药敏检测仪(山东省农业科学院畜牧兽医研究所研制);凝胶成像系统(美国AlphaInnotech公司);生物安全柜(苏净集团安泰公司);紫外分光光度计(Ultrospec 3100 pro,英国 Biochrom公司);PCR仪(美国Bio-Rad公司)。
1.2 方法
1.2.1 采样 每个村庄随机选3个养殖户,分别采集每个养殖户猪饲料、饮水、猪粪、猪肛拭子、猪鼻拭子、饲养户的猪鼻拭子和村庄污水。
1.2.2 分离培养细菌 参照文献[1]分别制作含有药物(环丙沙星2 μg/mL,黏杆菌素4 μg/mL)的琼脂培养基,划线分离培养细菌,37 ℃培养18 h,分离纯化细菌。所有大肠杆菌均经质谱鉴定。
1.2.3 细菌总DNA提取 将每一个养殖户所有样品混合在一起为一个样品,共62份,采用细菌总DNA试剂盒提取混合样品的总DNA。
1.2.4 引物设计与合成 根据文献[1]分别设计扩增ndm-1基因及mcr-1基因的引物,引物序列如下:NDM-1-F:5′-CCGGAATTCATGGAATTGCCCAA-TATTATGCA-3′,NDM-1-R:5′-CCCAAGCTT-TCAGC-GCAGCTTGTCGGCCAT-3′,扩增片段大小为 831 bp。CLR5-F:5′-CGGTCAGTCCGTTTGTTC-3′,CLR5-R:5′-CTTGGTCGGTCTGTAGGG-3′,扩增片段大小为309 bp。引物由生工生物工程(上海)股份有限公司合成。
1.2.5 基因的扩增 取新鲜培养的细菌200 μL,12 000 r/min 离心1 min,100 μL灭菌水悬浮,沸水浴煮 5 min,12 000 r/min 离心 1 min,得到的基因组 DNA作为模板,以NDM-1-F和NDM-1-R为引物,通过PCR扩增ndm-1 基因,反应条件:95 ℃ 预变性 5 min;95 ℃ 变性 30 s,56 ℃ 退火 30 s,72 ℃ 延伸1 min, 共30个循环;72 ℃ 再延伸7 min。mcr-1基因扩增反应条件:95 ℃ 预变性 5 min;95 ℃ 变性 30 s, 52.5 ℃退火 30 s,72 ℃延伸30 s,共30个循环;72 ℃ 再延伸5 min。PCR产物经1%琼脂糖凝胶电泳鉴定。
1.2.6 细菌抗药性水平检测 参照美国临床与实验室标准化协会(CLSI)标准,采用琼脂平板法和微量肉汤稀释法,测定分离株对多黏菌素、强力霉素、头孢噻呋、庆大霉素、氟苯尼考、恩诺沙星、氨苄西林和新霉素共8种抗生素的抗药性水平。
2 结果
2.1 细菌分离 从所有200个样本中分离到大肠杆菌50株,分离率为25%(50/200)。从62个混合样本中分离到mcr-1阳性大肠杆菌24株,检出率38.71%(24/62)。
2.2mcr-1基因的检测 从62个混合样品中检出38个样品含mcr-1基因,检出率为61.29%(38/62)。个体散养猪场和商品猪场都有检出。基因扩增结果见图1。

图1 大肠杆菌mcr-1基因PCR扩增
2.3ndm-1基因的检测 从62个混合样品中检出6个样品含ndm-1基因,检出率为9.68%(6/62),只存在于商品猪场。基因扩增结果见图2。
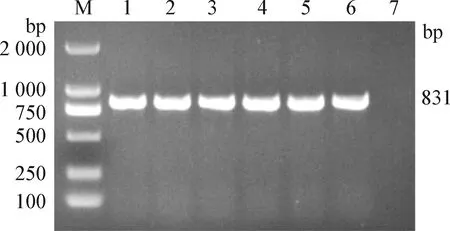
图2 大肠杆菌ndm-1基因扩增
2.4 细菌抗药性检测 分离到的大肠杆菌对8种抗生素抗药性情况统计见表1。从表1可以看出,携带mcr-1或ndm-1基因的大肠杆菌抗药性水平较高,对多黏菌素、强力霉素、头孢噻呋、恩诺沙星、氨苄西林的抗药率均达到100%,对新霉素的抗药率为66.67%,对庆大霉素的抗药率为75%,对氟苯尼考的抗药率为83.33%。商品猪场源同时携带mcr-1基因和ndm-1基因的大肠杆菌抗药性水平相对更高,对强力霉素、头孢噻呋和氨苄西林的抗药率达到100%,对多黏菌素、新霉素、庆大霉素、恩诺沙星和氟苯尼考均达到83.33%。不携带mcr-1基因和ndm-1基因的大肠杆菌抗药性水平也较高。
3 讨论
3.1mcr-1基因可以垂直传播,也可以水平传播。mcr-1基因是质粒介导的乙酰转移酶的抗药性基因,能够在人和动物的肠道菌群中传播抗药性,其抗药性机制多样[9],严重影响到公共卫生。本试验采集样品来自不同地区散养户生猪饲养的整个生产环境,mcr-1抗药性基因的普遍检出说明此基因广泛存在于生猪的整个饲养环境中,是能够水平传播的,另外在不同区域、猪的不同生长阶段,mcr-1基因均能检测到,且抗药性水平基本相似,说明此基因是垂直传播的,这与规模化养猪的相关研究结论基本一致[10]。
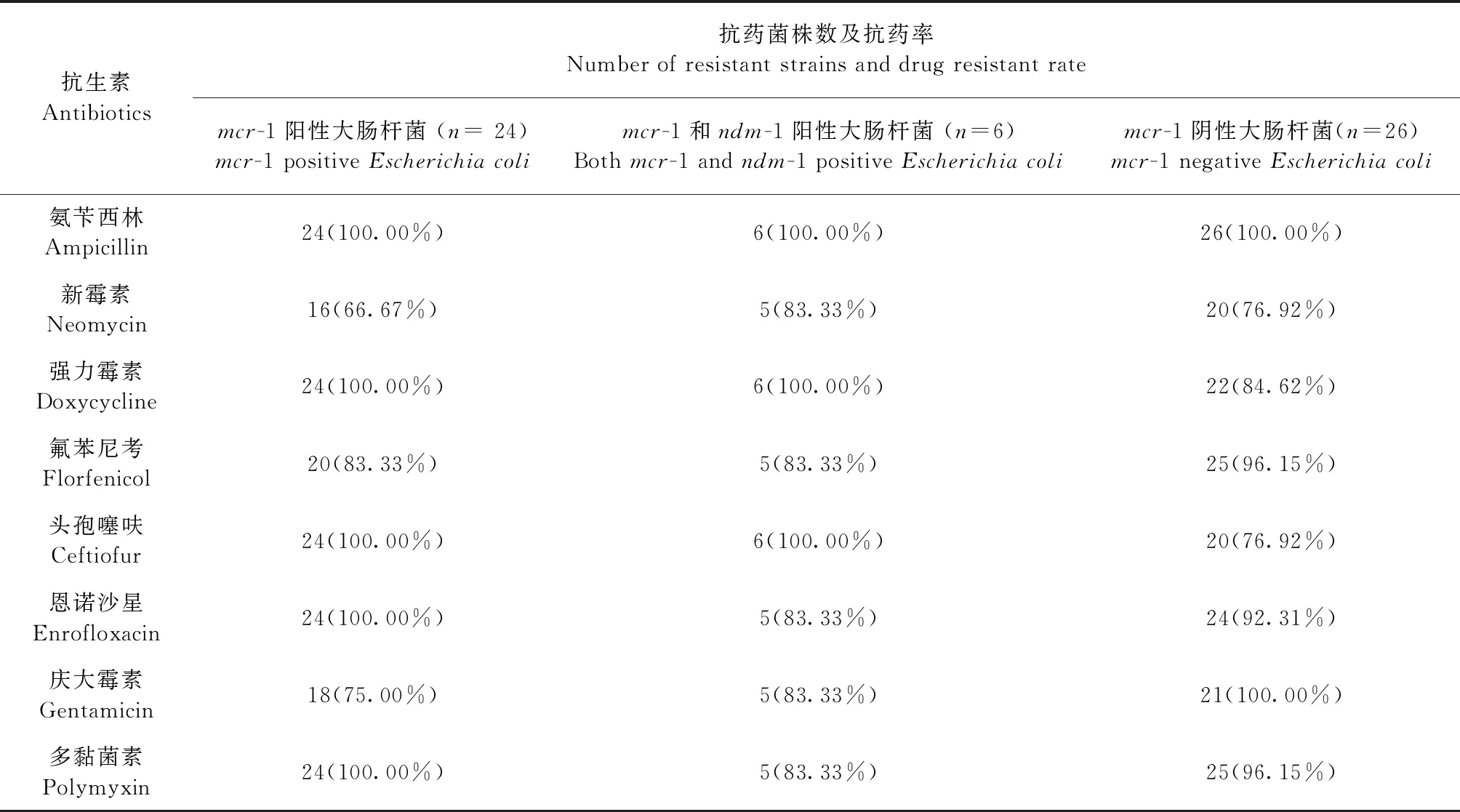
表1 大肠杆菌药物敏感试验结果
3.2 大肠杆菌对多黏菌素产生抗药性同样存在于散养户猪群中。多黏菌素是人兽共用的抗生素,在临床是作为抑制细菌的最后防线的抗生素,抑菌效果显著[3]。由于目前使用多黏菌素较多且时间较长,因此在动物体内和环境中分离到大肠杆菌对其表现出一定水平的抗药性。这与长期使用该抗生素有一定的关系,与细菌抗药性产生机理是一致的,这种情况不仅存在于规模化养猪场,也存于散养户猪只。导致这种情况的原因,规模化养猪场一般都有相对规范的用药程序,剂量规范但用药时间长,而散养户相对用药不规范,用药时间短,但剂量很大,也造成抗生素对病原菌的不同压力,因此规模化养猪场和散养户在养殖过程中不同用药模式造成了细菌抗药性水平存在差异。
3.3 携带ndm-1基因的大肠杆菌主要集中于规模养猪场。携带ndm-1基因的细菌能够水解几乎所有的β-内酰胺类抗生素(β-lactam antibiotic),可以使碳青霉烯类和其他β-内酰胺类抗生素失去功效。导致现有抗菌药物无法满足临床治疗需要[7]。由于blaNDM-1强大的跨区域和跨种属传播的能力,致使这些携带菌在世界各地广泛流行,严重威胁着人类健康。科研人员对其作用机制进行了广泛研究[11-12],并探索了其相关防控技术[13-14]。从本试验结果来看,所有样品中ndm-1基因检出率不高,63个混合样品中只分离到6个阳性样品,均来自于商品猪场,总体抗药性水平高于散养模式,而散养户中均未分离到,说明ndm-1基因的筛选效果与密集用药情况直接相关,也可能与其传播方式有关。由于抗生素使用剂量增大造成的选择性压力推动了ndm-1 的进化,导致其突变亚型频繁出现。目前已知至少24种ndm-1 突变亚型[15]。更严重的是,mcr-1 基因的出现导致部分菌株对多黏菌素也产生耐药性,会造成对抗ndm-1 细菌的方法减少[1],因此为减少mcr-1基因和ndm-1基因的传播,必须限制使用抗生素,切实加强兽医药物品监管,定期检测病菌抗药性。
3.4 用含有黏杆菌素4 μg/mL的琼脂培养基筛选携带mcr-1基因的大肠杆菌效果较好。从62个混合样品中检测到38个样品含有mcr-1基因(阳性率61.29%),这与发表的文献结论一致[1,5],表明该方法分离效果较好,能够作为分离抗多黏菌素细菌的首选方法。
4 结论
动物养殖过程中,在动物体内或环境存在抗药性基因mcr-1和ndm-1。从62个混合样品中检测到38个样品含有mcr-1基因(阳性率61.29%),6个样品含有ndm-1基因(阳性率9.68%)。mcr-1基因检出率较高(61.29%),说明该基因已经适应宿主的变化,广泛存在于规模化养猪场和散养户猪群及其周围环境。ndm-1基因检出率较低(9.68%),但集中于用药密集的商品猪场,与长期过度集中使用抗生素有关。散养猪模式和规模化养猪模式的不同造成的细菌抗药性类型和水平存在一定差异。

