新疆南疆部分规模牛场犊牛轮状病毒、冠状病毒感染情况调查与基因鉴定
崔 鑫 , 孟凡艳 , 鱼海玮 , 张迎春 , 黄 腾 , 胡建军
(1. 塔里木大学动物科学学院 , 新疆 阿拉尔 843300 ; 2. 新疆生产建设兵团第一师畜牧兽医工作站 , 新疆 阿拉尔 843300)
腹泻是引起1月龄以内犊牛死亡的主要原因,犊牛腹泻病因极其复杂,通常引起新生犊牛腹泻的原因包括非感染性因素(如饲养环境因素、营养因素)和感染性因素(细菌、病毒和寄生虫等因素)。牛轮状病毒(Bovine rotaviru,BRV)和牛冠状病毒(Bovine coronavirus,BCoV)是引起1月龄左右的犊牛发生严重脱水性腹泻的非细菌性主要病原体[1]。这2种病毒均通过粪口途径传播[2],并能适宜低温的生长环境,寒冷的季节可导致病毒的积累,临床上多以急性发作的水样腹泻为主要特征,病情较重时出现大量血液粪便、脱水和虚弱,甚至死亡,严重阻碍犊牛的生长发育[3]。BCoV引起的疾病临床过程、组织学的损伤、腹泻产生的机理及发病犊牛的年龄都与BRV相似,且感染毒力和造成的死亡率均高于BRV[4-5]。这2种病毒常常会发生混合感染,造成病牛的临床症状更加严重,当继发细菌感染时,会出现发病急、死亡迅速的特点[6-7]。
养牛业是新疆南疆地区的重要畜牧产业之一,犊牛感染BRV、BCoV会对养牛业造成极大的经济损失。为调查新疆南疆地区部分规模化奶牛场中是否存在这2种病毒的感染,本试验从规模化奶牛场中采集腹泻发病犊牛的粪便样品,采用ELISA和逆转录-聚合酶链反应(Reverse transcription-polymerase chain reaction,RT-PCR)的方法进行检测、分析,为当地规模化奶牛场这2种病的防控提供参考依据。
1 材料与方法
1.1 材料
1.1.1 病料来源 2017年10月—2018年2月,在新疆南疆地区12个规模化奶牛场共采集1月龄以内发生腹泻症状的犊牛粪便样品325份,冻存于-20 ℃ 冰箱中备用。
1.1.2 主要试剂 BRV、BCoV抗原双抗体夹心ELISA试剂盒,购自美国爱德士(IDEXX)生物科技公司;病毒检测用RNA提取试剂盒、PrimeScriptTMOne Step RT-PCR Kit等,均购自天根生化科技(北京)有限公司。
1.2 试验方法
1.2.1 样品处理 每份粪便样品取0.5 g于1.5 mL灭菌离心管中,加入1 mL生理盐水旋涡振荡,8 000 r/min 离心2 min,取上清液100 μL于新的灭菌离心管中,保存于-80 ℃冰箱中备用。
1.2.2 BRV和BCoV抗原的ELISA检测 通过商品化BRV和BCoV抗原双抗体夹心ELISA试剂盒,具体操作步骤按照试剂盒说明书进行。
1.2.3 BRV与BCoV的RT-PCR检测 经BRV和BCoV抗原双抗体夹心ELISA试剂盒检测为阳性的粪便样本作为RNA提取样本,按照病毒检测用RNA提取试剂盒说明书进行RNA的提取,提取后的RNA于-80 ℃冰箱保存备用。
BRV、BCoV的PCR扩增引物[8](表1)由生工生物工程(上海)股份有限公司合成。

表1 BRV与BCoV的RT-PCR扩增引物
BRV的RT-PCR检测反应体系(25 μL):PrimeScrip 1 step Enzyme Mix 0.5 μL,引物各0.5 μL,模板RNA 2.5 μL,2×1 step Buffer 12.5 μL,RNase Free ddH2O 8.5 μL,混匀后瞬时离心。PCR反应条件:50 ℃反转录30 min;95 ℃预变性5 min;94 ℃变性1 min,54 ℃退火1 min,72 ℃延伸1 min,35个循环;72 ℃延伸5 min。取3.0 μL扩增产物进行1%琼脂糖凝胶电泳,凝胶成像仪观察结果。
BCoV的RT-PCR检测反应体系(25 μL):PrimeScrip 1 step Enzyme Mix 0.5 μL,引物各0.5 μL,模板RNA 2.5 μL,2×1 step Buffer 12.5 μL,RNase Free ddH2O 8.5 μL,混匀后瞬时离心。PCR反应条件:50 ℃反转录30 min;94 ℃预变性5 min;95 ℃变性50 s,55 ℃退火45 s,72 ℃延伸50 s,35个循环;72 ℃延伸10 min。取3.0 μL扩增产物进行1%琼脂糖凝胶电泳,凝胶成像仪观察结果。
1.2.4 PCR产物回收及测序 按照DNA凝胶回收试剂盒说明书回收PCR产物,送至北京金诺锐杰基因科技有限公司进行测序。
2 结果
2.1 BRV和BCoV抗原的ELISA检测 经BRV、BCoV抗原双抗体夹心ELISA试剂盒对所采集的粪便样品进行检测,其中12个规模化奶牛场中BRV的检出率为15.38%,BCoV的检出率为9.54%(见表2),2种病毒混合感染率为6.67%。
2.2 BRV的RT-PCR检测 以样品的RNA提取产物为模板,BRV引物VP7-1/VP7-2进行RT-PCR,扩增出1 062 bp大小的基因目的片段;再以PCR产物为模板进行基因分型鉴定,以引物VP7-1/G5-2、VP7-1/G6-2、VP7-1/G8-2、VP7-1/G9-2、VP7-1/G10-2进行半套式RT-PCR,其中仅有引物VP7-1/G10-2扩增出715 bp大小的基因目的片段(见图1)。
2.3 BRVVP7基因核苷酸同源性分析 样本序列与NCBI下载的15个参考株序列通过DNASTAR进行核苷酸同源性比较(见图2)。结果显示,样本核苷酸序列与15个参考毒株的同源性高达90%以上,与参考株RVA(突尼斯/2014,牛,KX599304.1)和MAR(摩洛哥/2011,牛,KT726335.1)的核苷酸同源性分别为95.1%和95.6%。确定该样本为牛轮状病毒A群,命名为BRV-10T。
2.4 BRV-10T 基因分型分析 通过MEGA软件对BRV-10T基因与参考株进行核苷酸同源性比较(见图3)。结果显示,BRV-10T与15个参考毒株的同源性高达75%以上,与参考株15T(伊朗/2011,牛,KM243016.1)、BoRota(加拿大/2009,牛,JX470517.1)、BOV(摩洛哥/2014,牛,KU729666.1)、BRV-2(埃及/2015,牛,KX268317.1)、Cow-tc(美国/1983,牛,LC133552.1)、DQ-75(中国/2008,牛,GU144587.1)、HM26(中国/2008,牛,FJ545658.1)、KC-1xUK(美国/2003,牛,HQ844013.1)、MAR(摩洛哥/2011,牛,KT726335.1)、MX001(墨西哥/2006,牛,FJ217204.1)、XJX-07(中国/2007,牛,EU828784.1)、ZAF(南非/2009,牛,KP752915.1)的同源性高达80%以上,同参考株RVA(突尼斯/2014,牛,KX599304.1)的同源性最为相近,达到94.7%,经基因分型确定BRV-10T为BRV G10型。

表2 ELISA检测结果

图1 BRV的RT-PCR鉴定
2.5 BCoV的RT-PCR检测 将ELISA检测到的阳性粪便样品通过RNA的提取后,采用BCoV 的引物BCV-P1/BCV-P2,经RT-PCR扩增得到730 bp大小的目的基因片段(见图4)。
2.6 BCoV的基因核苷酸同源性分析 应用DNASTAR软件,将下载的7个冠状病毒科参考株N基因与检测的样本核苷酸序列进行核苷酸同源性比较(见图5)。结果显示,该样本与BCoV参考毒株的N基因核苷酸同源性为96.2%~98.5%,确定该样本为牛冠状病毒,命名为BCV-Aks-01株。
3 讨论
自20世纪80年代,我国首次发现BRV和BCoV后,在我国各个地区对2种病毒的报道也越来越多。李鑫等[9]对我国12个不同地区的牛血清进行了ELISA抗体检测,调查表明,BRV在我国牛群中的感染极为普遍;姜向阳[10]、田风林等[11]分别对陕西省、固原市的部分牛场犊牛进行了BRV抗原检测。沙金明等[12]、胡传伟等[13]研究表明,我国青海省及东三省都存在BCoV感染的情况;蒋静等[14]、刘合义等[15]对沿海地区的牛场进行了BCoV的抗体检测,发现BCoV感染率逐年增加,且腹泻牛群的阳性率明显高于未腹泻牛群,表明BRV与BCoV在我国牛群中的感染趋势已逐渐蔓延。
在新疆,段新华等[16]采用ELISA的方法对新疆不同地区的7个规模化牛场进行了BRV抗原检测,并通过聚丙烯酰胺凝胶电泳(PAGE)的方法对其进行了复检,结果表明:各场阳性率为25%~50%,且PAGE的复检符合率为85.7%;俞银江等[17]运用犊牛腹泻四联检测试剂盒对新疆塔城地区2个团场西门塔尔发病犊牛的肠内容物进行BCoV病原检测,结果显示,阳性率为55.56%,且存在与其他致腹泻病原的混合感染。
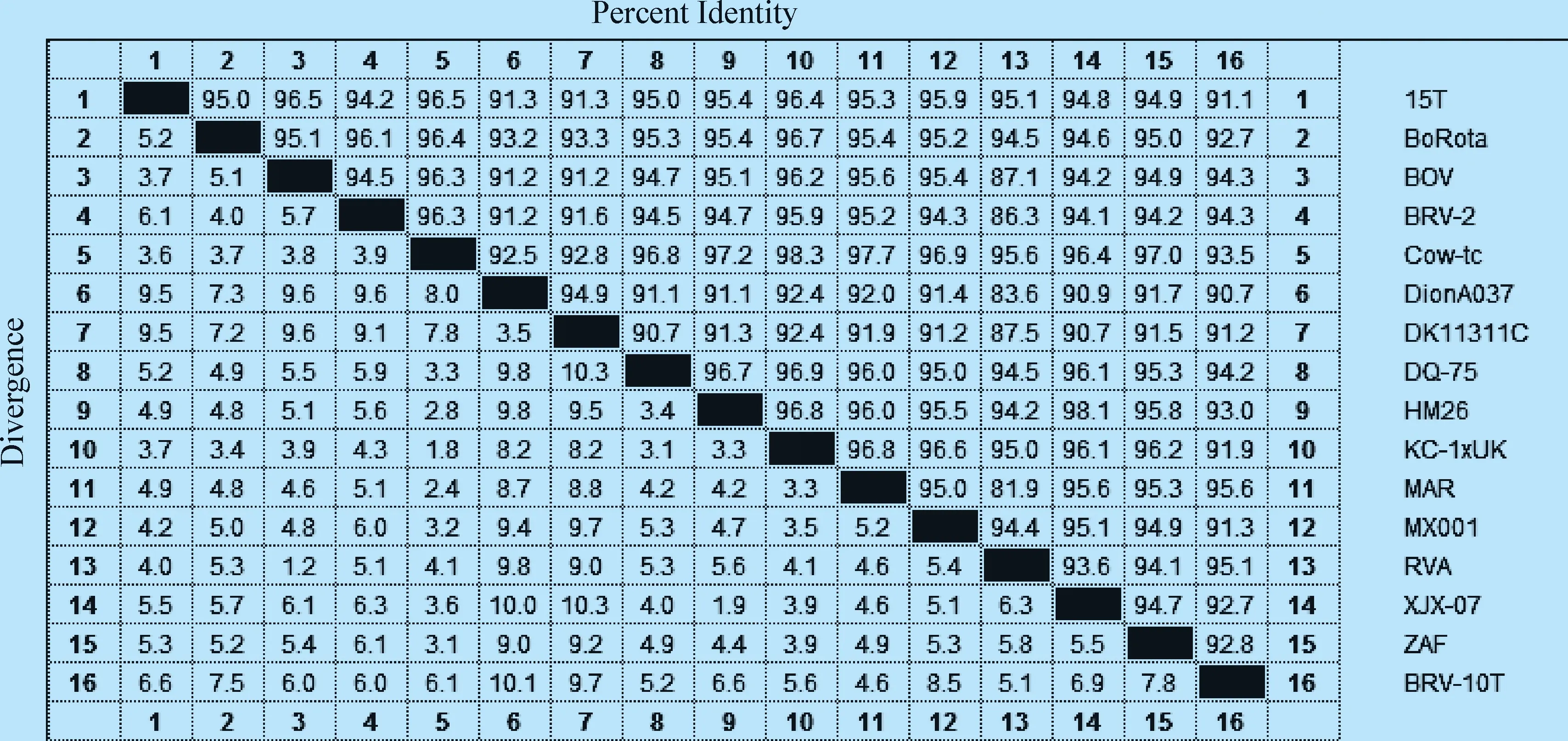
图2 BRV VP 7基因核苷酸同源性比较(Clustal W)
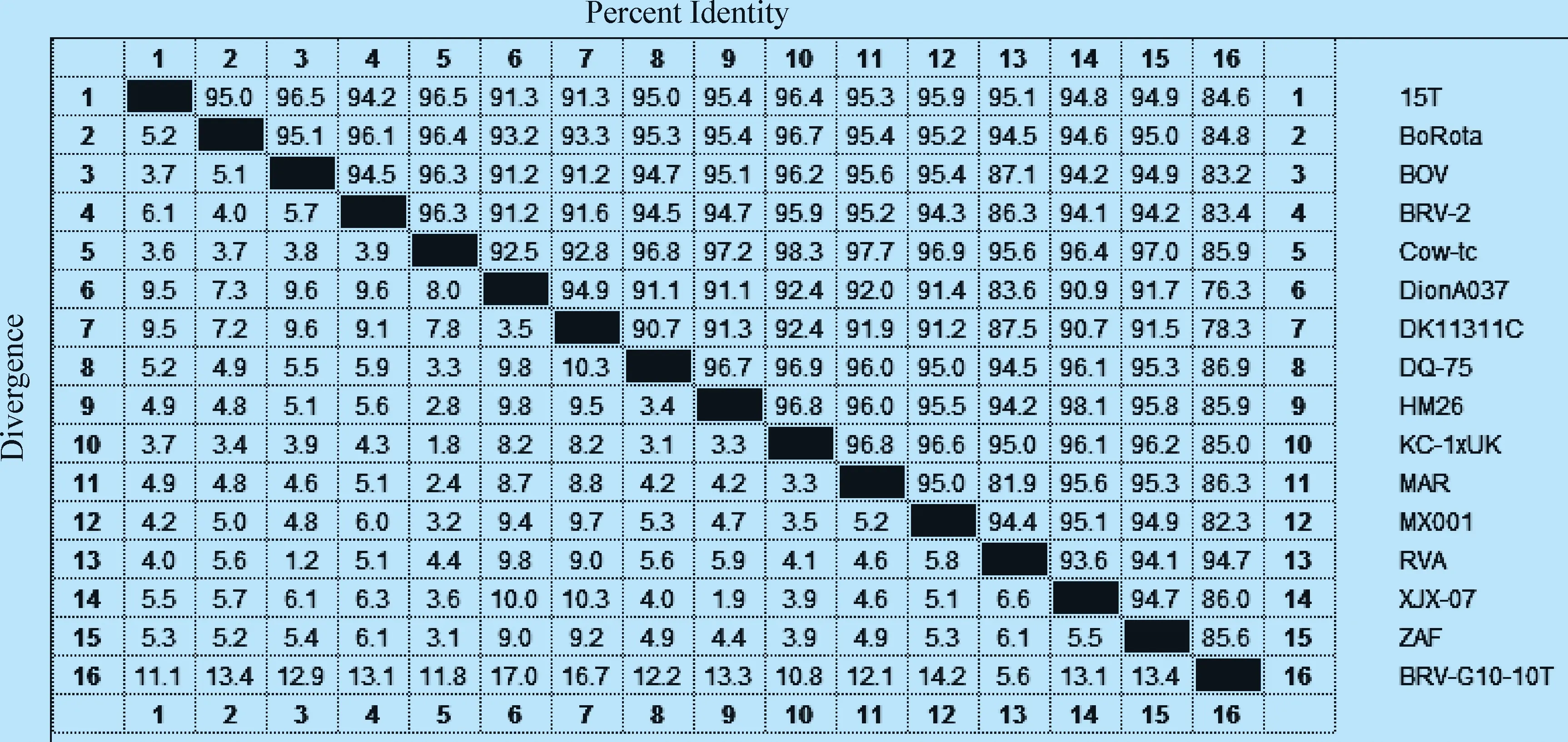
图3 BRV-10T基因核苷酸同源性比较(Clustal W)
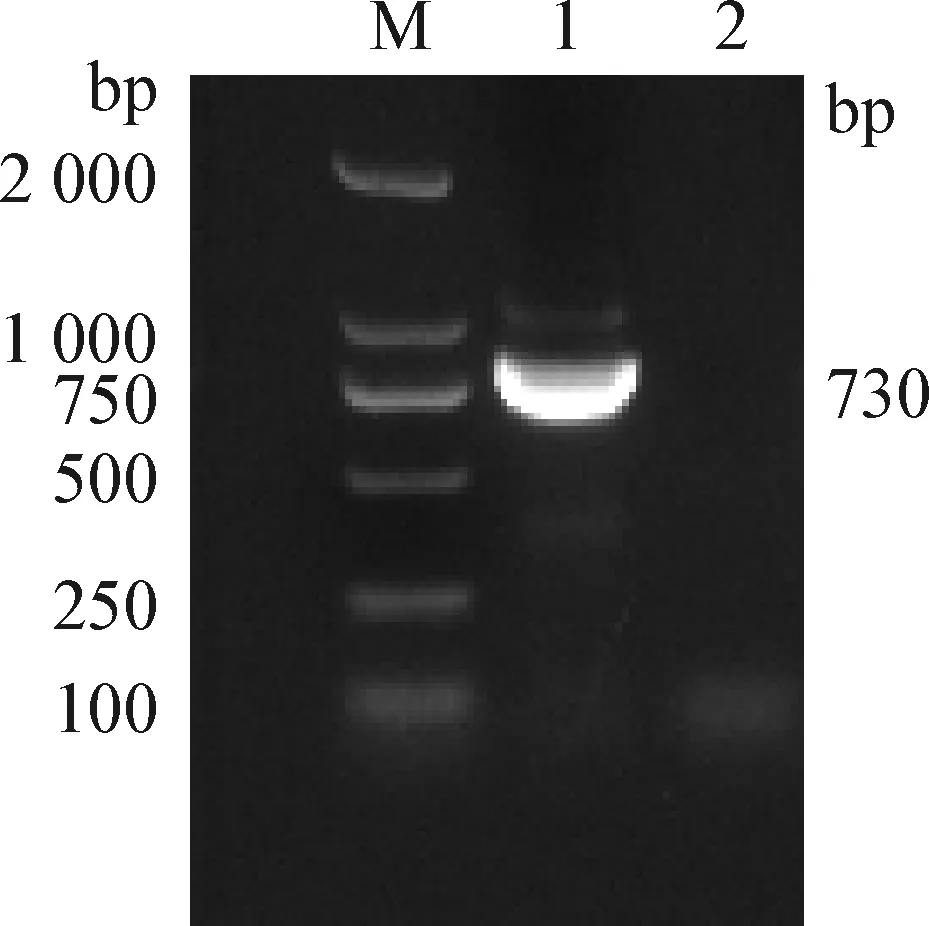
图4 BCoV的RT-PCR检测
张莹钰等[18]、张婉琪等[19]对新疆南疆BCoV进行了病毒分离、基因型鉴定及全基因组序列测定,本调查在其试验基础上采用轮状病毒和冠状病毒抗原双抗体夹心ELISA的方法对南疆地区12个规模化牛场进行了BRV、BCoV感染情况的调查,结果表明:ELISA检测到50个BRV阳性粪便样品,31个BCoV阳性粪便样品,感染率分别为15.38%和9.54%,2种病毒的混合感染率为6.76%;说明南疆部分牛场存在BRV、BCoV的感染且存在混合感染的情况,且轮状病毒是A群G10型。

图5 BCV-Aks-01株N基因核苷酸同源性比较(Clustal W)
轮状病毒根据其抗原性可分为7个群,其中A群对犊牛的感染力最强,通过轮状病毒VP4和VP7序列分析和比对,将血清群分为P基因型和G基因型。目前,全球流行的主要牛轮状病毒为G6、G8和G10型,而我国流行的主要牛轮状病毒为G6和G10型[20],常继涛等[21]从新疆地区奶牛场的腹泻粪便样品中检测到轮状病毒G10型和G6型;而本试验发现,在新疆南疆规模化奶牛场中存在A群G10型轮状病毒感染,与国内流行的牛轮状病毒基因型是一致的。通过本调查证实,在新疆南疆部分规模化奶牛场存在BRV、BCoV感染以及混合感染的情况,为其制定完善的防控措施提供了科学依据。

