花生和土壤中噻虫胺超高效液相-串联质谱仪检测及分析方法
李清华,任立瑞,尹明明,陈福良,李文明
(1.中国农业科学院植物保护研究所,农业农村部作物有害生物综合治理重点实验室,北京 100193;2.河南农业大学植物保护学院,郑州 450000)
噻虫胺(clothianidin),分子式为C6H8ClN5O2S,是高效、安全、高选择性的一类新烟碱类农药,具有卓越的内吸、触杀和胃毒作用。2012年,噻虫胺在我国取得登记,已登记的噻虫胺剂型以颗粒剂和悬浮剂为主,此外还有水分散粒剂、悬浮种衣剂和可湿性粉剂等。噻虫胺已被广泛用于水稻、番茄和茶树等作物,用以防治稻飞虱、蚜虫等害虫[1]。近年来,已报道关于噻虫胺的残留检测方法有:液相色谱法(LC)[2-3],高效液相色谱法(HPLC)[4-6],液相色谱-串联质谱法(LC-MS/MS)[7-9],超高效液相色谱-串联质谱法(UPLC-MS/MS)[10-12]。前处理方法有:基质分散萃取法(MDE)[13],固相萃取法(SPE)[14],分散固相萃取(DSPE)[15],液液微萃取法(LLM)[16]。检测作物有:韭菜[17]、草莓[18]、绿豆[19]等。目前,关于噻虫胺在花生上的残留及分布情况尚未见报道,我国也尚未制定噻虫胺在花生中的MRL值[20]。因此,本文建立了同时检测花生及土壤中噻虫胺残留的QuEChERS方法及超高效液相-串联质谱(UPLC-MS/MS)检测方法,为噻虫胺在花生中的残留检测提供参考依据。
1 材料与方法
1.1 仪器与试剂
XevoTM TQ-S超高效液相-串联质谱仪(UPLCMS/MS),美国沃特世公司;BSA224S-CW电子天平,德国Sartorius公司;Vottex QL-861涡旋仪,海门市其林贝尔仪器制造有限公司。
99.0%噻虫胺标样,德国Ehrenstorfer公司;18%噻虫胺包埋颗粒剂,中国农业科学院植物保护研究所;乙腈(色谱纯),美国Fisher Scientific公司;乙腈(分析纯),国药集团化学试剂有限公司;NaCl(分析纯)、无水MgSO4(分析纯),国药集团化学试剂有限公司;PSA、C18,美国安捷伦公司;纯净水,杭州娃哈哈集团有限公司。
1.2 试验方法
1.2.1 仪器条件
色谱条件:Acquity UPLC BEH C18色谱柱(2.1 mm×50 mm,1.7 μm),美国沃特世公司;柱温:35℃;流动相:乙腈+0.2%甲酸水溶液(体积比90∶10);流速:0.28 mL/min;进样量:3 μL。
质谱条件:ESI正离子源模式电离;多反应检测(MRM);毛细管电压:3.0 kV;锥孔电压:52 V;离子源温度:150℃;脱溶剂温度:300℃;脱溶剂气流量:500 L/h;锥孔气流量:50 L/h;定量离子对:168.80/249.90。
图1为0.1 mg/L噻虫胺乙腈溶剂标准溶液色谱图,在上述液相色谱条件下,噻虫胺的相对保留时间为1.33 min。
1.2.2 样品前处理
分别称取花生仁、花生壳、土壤各10.0 g,花生叶片5.0 g,置于50 mL离心管中,加入5 mL超纯水(花生叶片不加水),加入10 mL乙腈,振荡10 min;再加1 g NaCl和4 g无水MgSO4,振荡5 min,4 000 r/min离心5 min。取1.5 mL上清液至装有50 mg PSA和150 mg无水MgSO4的2 mL离心管中(花生仁、叶片净化剂为50 mg PSA和50 mg C18),涡旋2 min,以5 000 r/min速度离心5 min,将上清液过0.22 μm滤膜至2 mL进样瓶,待测。

图1 0.1 mg/L 噻虫胺乙腈溶剂标准色谱图
1.3 标准溶液配制
称取噻虫胺标准品0.010 1 g于50 mL容量瓶中,用乙腈溶解并定容,制备200 mg/L的标准储备液,置于4℃冰箱保存。分别用乙腈将噻虫胺标准储备液梯度稀释至0.005、0.010、0.020、0.050、0.100、0.200、0.500、1.000、2.000 mg/L,作为噻虫胺溶剂标准工作溶液。用空白基质提取液配制相同浓度梯度的噻虫胺溶液,作为噻虫胺基质标准工作溶液。
2 结果与分析
2.1 方法标准曲线、线性相关性和基质效应
将噻虫胺标准溶液在上述仪器条件下测定,以噻虫胺浓度与对应峰面积绘制标准曲线,噻虫胺标准溶液进样质量浓度(x)为横坐标,峰面积(y)为纵坐标。结果表明,在0.005~2.000 mg/L质量浓度范围内,y=294 824x+8 145.6,R2=0.999 3,线性关系良好。以方法的最低检测浓度0.005 mg/kg为定量限。基质效应(ME值)为基质标准曲线斜率/溶剂标准曲线斜率,当ME值大于1.1时,表现为基质增强效应;ME值小于0.9时,表现为基质减弱效应;当ME值介于0.9~1.1时,基质效应可以忽略[21]。由表1可知,花生叶片和花生壳均存在基质增强效应,故需引入基质标准曲线校正。
2.2 添加回收率与精密度
分别在空白花生叶片、花生仁、花生壳及土壤样品中添加3个水平的噻虫胺标准溶液,使得噻虫胺添加浓度分别为0.01、0.10、1.00 mg/kg,每个添加水平重复5次。将添加样品密封,静置2 h后,按照1.2.2操作,得到的添加回收样品,采用1.2.1分析方法进行测定,结果见表2。当添加浓度为0.01~1.00 mg/kg时,噻虫胺在3种花生基质中平均添加回收率为93.8%~110.6%,变异系数为1.38%~8.13%;在土壤中的添加回收率为93.2%~104.0%,变异系数为1.21%~1.41%。结果表明,本方法具有较高的回收率与精确度,满足农药残留检测要求[22]。

表1 噻虫胺标准曲线方程及相关系数
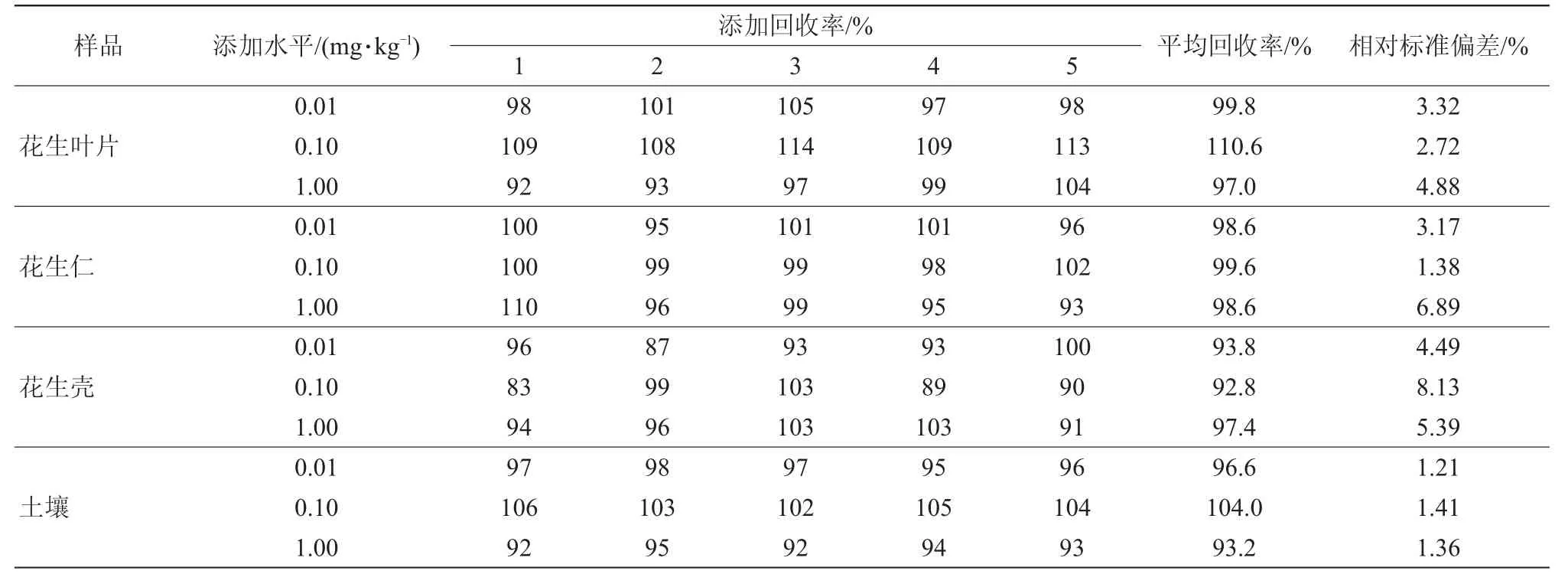
表2 添加回收率与相对标准偏差
2.3 方法应用
采用本文建立的方法,播种时,花生经18%噻虫胺包埋颗粒剂混土穴施且仅施药1次,收获期检测花生及土壤样品中噻虫胺残留量,河南和山东两地样品中,噻虫胺在花生叶片、花生壳、花生仁及土壤中均能检测到,并且其残留量由高到低的顺序依次为花生叶片、花生壳、土壤、花生仁,且花生叶片中残留量明显高于花生样品其他组织部位。检测结果见表3。
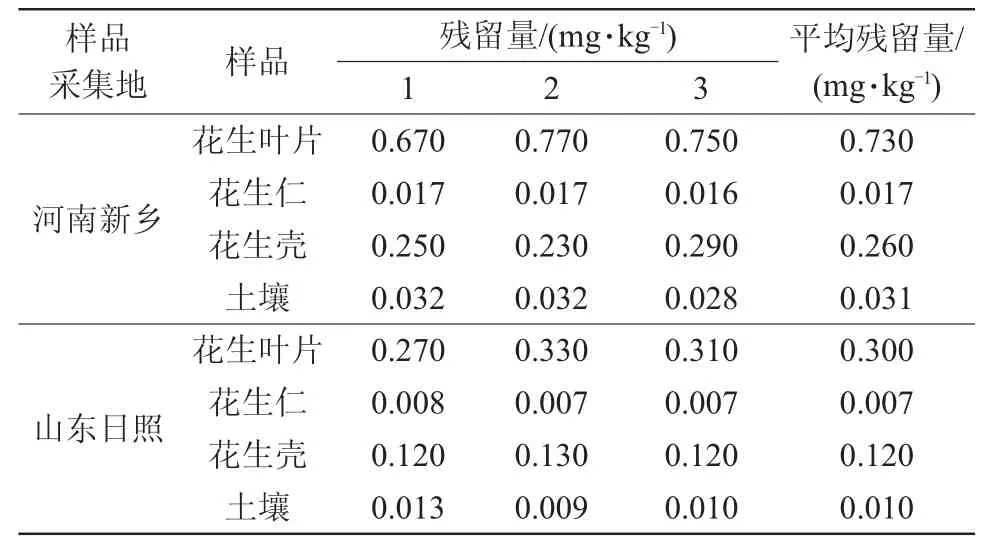
表3 噻虫胺在花生各部位及土壤中平均残留量
噻虫胺在河南新乡地区花生叶片中平均残留量为0.730 mg/kg,花生仁中为0.017 mg/kg,花生壳中为0.260 mg/kg,土壤中为0.031 mg/kg;山东日照地区噻虫胺在花生叶片中平均残留量为0.300 mg/kg,花生仁中为0.007 mg/kg,花生壳中为0.12 mg/kg,土壤中为0.010 mg/kg。中华人民共和国国家标准《食品安全国家标准食品中农药最大残留限量》(GB 2763—2016)中规定,噻虫胺每日最大允许摄入量为0.1 mg/kg。而国内外对花生中噻虫胺最大残留限量标准尚未做明确规定。
3 结论与讨论
采用超高效液相-串联质谱仪检测花生及土壤中噻虫胺残留,结果表明,噻虫胺在花生及土壤中添加回收率为93.2%~110.6%,变异系数为1.21%~8.13%,定量限为0.005 mg/kg,符合农药残留检测要求。本文前处理方法简单可行,选用试剂经济易得,检测方法精确度及灵敏度高,能保证检测结果的精确度和可靠性,可为噻虫胺在花生中的残留检测提供参考依据。

