高脂饮食小鼠胆囊胆固醇结石模型特征分析和肝脏转录组学研究*
庄 谦 董志霞 叶 欣 程金年 宛新建上海交通大学附属第六人民医院消化内镜中心(200233)
背景:高脂饮食诱导的小鼠胆囊胆固醇结石模型是胆囊结石成因及其防治研究常用的动物模型。目的:探讨高脂饮食小鼠胆囊胆固醇结石模型特征并进行肝脏转录组学研究。方法:20只雄性C57BL/6J小鼠随机分为2组,分别予普通饲料喂养(对照组)和成石饲料喂养[成石饮食(LD)组]。喂养8周后观察胆囊结石形成情况,检测血脂和胆囊胆汁脂质成分,采用Illumina高通量测序技术筛选模型小鼠肝脏组织差异表达基因,并进行GO和KEGG富集分析。采用real-time PCR验证肝脏胆汁酸合成相关基因表达。结果:LD组小鼠胆囊胆固醇结石成石率为100%,对照组无结石形成。LD组小鼠存在明显的肝大和肝脏脂肪变性,血清总胆固醇、三酰甘油水平以及胆囊胆汁胆固醇含量、胆固醇饱和指数均显著高于对照组(P<0.05)。高通量测序和生物信息学分析共筛选出1 330个差异表达基因。KEGG分析显示差异表达基因主要在脂类代谢、胆汁分泌、胰岛素分泌等通路富集。GO分析显示脂肪酸代谢过程相关通路是显著富集的类型。肝脏转录组学分析和real-time PCR均显示LD组小鼠肝脏组织中胆汁酸合成相关基因CYP7A1、CYP8B1、CYP7B1表达显著低于对照组(P<0.05)。结论:胆囊胆固醇结石小鼠存在显著胆固醇、胆汁酸和脂肪酸代谢紊乱。转录组学研究可筛选出胆固醇结石形成过程中发挥作用的差异表达基因,为相关研究提供参考。
胆结石是一种常见的消化系统疾病,欧洲等发达国家和地区患病率高达20%[1],我国报道的患病率为7%~10%[2],且因人口老龄化、饮食西方化等因素的影响,近年我国胆结石发病率呈明显上升趋势。根据所含胆固醇比例不同,胆囊结石可分为胆固醇结石、胆色素结石和混合性结石,我国以胆固醇结石最为常见[3]。在胆囊胆固醇结石的成因及其防治研究中,高脂饮食诱导的小鼠胆囊胆固醇结石模型是常用动物模型之一,造模方法为喂饲C57BL/6小鼠4~8周的高胆固醇、高胆酸、高脂肪饲料,成石率可达100%[4-5],模型动物可出现与胆囊结石患者相似的病理生理学变化。尽管目前对胆囊胆固醇结石发生的病理生理学过程已有较深入的认识,如肠肝循环胆固醇-胆汁酸代谢异常、胆汁胆固醇过饱和等[6-8],但对胆囊胆固醇结石形成的详细机制尚不完全清楚。因此,本研究成功建立了高脂饮食小鼠胆囊胆固醇结石模型,并进行模型特征和肝脏转录组学分析,以期为胆固醇结石的成因研究以及寻找潜在的防治靶点提供参考。
材料与方法
一、实验动物和主要试剂
SPF级健康雄性C57BL/6J小鼠20只,6周龄,购自上海西普尔-必凯实验动物有限公司[许可证号: SCXK(沪)2018-0006],饲养于上海交通大学附属第六人民医院实验动物中心 SPF级屏障环境中。成石饲料(含15%脂肪+1.25%胆固醇+0.5%胆酸)、普通饲料(含0.02%胆固醇;南通特洛菲饲料科技有限公司)。总胆固醇测定试剂盒、总胆汁酸试剂盒、三酰甘油测定试剂盒、高密度脂蛋白胆固醇(high density lipoprotein cholesterol, HDL-C)测定试剂盒、低密度脂蛋白胆固醇(low density lipoprotein cholesterol, LDL-C)测定试剂盒(南京建成生物工程研究所);磷脂测定试剂盒(富士胶片和光纯药株式会社);Trizol总RNA抽提试剂(上海碧云天生物技术有限公司);逆转录试剂盒(HiScript®Ⅲ RT SuperMix for qPCR)、real-time PCR试剂盒(AceQ®Universal SYBR qPCR Master Mix;南京诺唯赞生物科技股份有限公司)。
二、方法
1. 动物模型建立:实验小鼠经1周普通饲料适应性喂养后随机分为2组,每组10只,分别予普通饲料喂养(对照组)和成石饲料喂养[成石饮食(lithogenic diet, LD)组]。环境条件:12 h光照和12 h黑暗交替,温度21~25 ℃。实验期间小鼠自由饮水和进食,每周记录体质量。实验方案通过上海交通大学附属第六人民医院动物福利伦理委员会审核批准。
2. 组织标本采集:喂养8周后,所有小鼠隔夜禁食12 h,称重并编号;腹腔注射戊巴比妥钠溶液(40 mg/kg)麻醉,摘取眼球留取全血,冰上静置后3 000 r/min离心10 min,收集上层血清,-80 ℃保存备用。颈椎脱臼处死小鼠,打开腹腔,观察并记录胆囊胆固醇结石形成情况。完整剥离胆囊,称重,以密度为1 g/mm3近似计算胆囊体积[9],留取胆囊胆汁待测。肝脏和胆囊以4%多聚甲醛固定或液氮速冻后-80 ℃保存备用。
3. 血脂和胆囊胆汁脂质检测:吸取血清,采用总胆固醇、三酰甘油、HDL-C、LDL-C测定试剂盒进行检测;吸取混匀的胆囊胆汁,采用总胆固醇、总胆汁酸、磷脂测定试剂盒进行检测。操作均严格按试剂盒说明书进行。分别计算胆汁中胆固醇、胆汁酸和磷脂摩尔浓度占三者摩尔浓度之和(即胆汁总脂质摩尔浓度)的百分比,根据Carey表计算胆汁胆固醇饱和指数[10]。
4. 肝脏和胆囊组织学检查:肝脏、胆囊组织4%多聚甲醛固定、脱水、透明、包埋、切片,常规行HE染色,肝脏组织另行油红染色,光学显微镜下观察组织病理学改变。使用Image-Pro Plus软件(v6.0)分析油红染色切片中红色脂滴面积占整个视野面积的百分比,进行油红染色定量。
5. Illumina 高通量测序和分析:由北京贝瑞和康生物技术有限公司进行小鼠肝脏组织 RNA提取和检测、文库构建、文库质检和上机测序,并进行数据质控和基因表达分析。
①建库测序:每组取5只小鼠的肝脏组织提取RNA并检测,浓度和总量达标进行文库构建。以磁珠富集真核生物mRNA,将mRNA打断成短片段,以mRNA为模板依次合成cDNA第一链和第二链;继而对双链cDNA进行3’-末端腺苷酸化,再连接测序接头,最后进行PCR扩增富集cDNA。文库构建完成后进行文库质检,合格后通过Illumina NovaSeq测序平台进行高通量测序。
②生物信息学分析:对测序得到的原始序列进行过滤,得到干净、有效、高质量的clean reads。应用Hisat2软件(v2.0.6)将由测序数据得到的reads比对参考基因组,进而对转录本进行注释和定量。应用edgeR软件(v3.3.3)分析基因在各样本中的差异表达情况,并进行多重假设检验校正,得到校准后P值。以校准后P值<0.05且差异表达倍数>2为标准筛选差异表达基因。应用R语言(v4.0.2)绘制展现差异表达结果的火山图和热图。
基因本体论数据库(Gene Ontology, GO; http://www.geneontology.org/)可对基因和蛋白功能进行限定和描述。从生物过程(biological pro-cess)、细胞组分(cellular component)和分子功能(molecular function)三个层面对差异表达基因进行GO富集分析,确定差异表达基因的主要生物学功能。同理,应用京都基因与基因组百科全书数据库(Kyoto Encyclopedia of Genes and Genomes, KEGG; https://www.kegg.jp/)对各个信号通路中的差异表达基因数目和富集情况进行KEGG富集分析。本研究使用clusterProfiler软件(v3.16.1)进行差异表达基因的GO和KEGG富集分析。
6. Real-time PCR验证肝脏胆汁酸合成相关基因表达:以Trizol试剂提取肝脏组织总RNA,逆转录合成cDNA,根据试剂说明书配置PCR反应体系,检测胆固醇7α-羟化酶(cholesterol 7α-hydroxylase, CYP7A1)、微粒体甾醇12α-羟化酶(sterol 12α-hydroxylase, CYP8B1)、氧甾醇7α-羟化酶(oxysterol 7α-hydroxylase, CYP7B1)、甾醇27α-羟化酶(sterol 27α-hydroxylase, CYP27A1)表达。PCR引物由生工生物工程(上海)股份有限公司合成(表1)。PCR反应条件:95 ℃ 10 s,60 ℃ 30 s,共40个循环。采用2-ΔΔCt法计算目的基因mRNA相对表达量。

表1 肝脏胆汁酸合成相关基因PCR引物序列
三、统计学分析
结 果
一、小鼠一般情况和胆囊胆固醇结石形成率
喂养8周后,对照组小鼠胆囊中未见结石,胆汁澄清透亮;LD组小鼠胆囊中可见鹅卵石样或不规则形态结石形成,胆汁混浊,可见大量胆固醇结晶(图1A),成石率为100%。两组小鼠造模期间体质量无明显差异(P=0.465;图1B);LD组胆囊体积大于对照组,差异有统计学意义(P<0.01;图1C);两组肝质量/体质量比分别为6.75%±0.45%和4.87%±0.21%,LD组明显大于对照组,差异有统计学意义(P<0.01;图1D),表明成石饲料可致小鼠肝脏体积增大。

**两组间比较,P<0.01
二、小鼠血脂、胆囊胆汁脂质成分和肝脏、胆囊组织学改变
与对照组相比,LD组小鼠血清总胆固醇、三酰甘油、LDL-C水平明显升高,HDL-C水平明显降低,差异均有统计学意义(P<0.01,P<0.01,P<0.01,P=0.02;图2A)。
LD组小鼠胆囊胆汁内胆固醇占总脂质的百分比高于对照组,胆汁酸占总脂质的百分比低于对照组,差异均有统计学意义(P<0.01,P=0.03;图2B);胆固醇占比升高、胆汁酸占比降低,导致胆汁胆固醇饱和指数增加,差异有统计学意义(P<0.01;图2C)。

两组间比较,*P<0.05, **P<0.01
对照组小鼠肝脏组织HE染色细胞结构清晰,未见明显病变,LD组则可见大量脂肪变性空泡,提示肝脏脂肪变性(图3A);油红染色LD组红色脂滴面积占视野面积百分比高于对照组,差异有统计学意义(P<0.01;图3B),提示肝脏脂质沉积。与对照组相比,LD组小鼠胆囊壁明显增厚(图3C)。
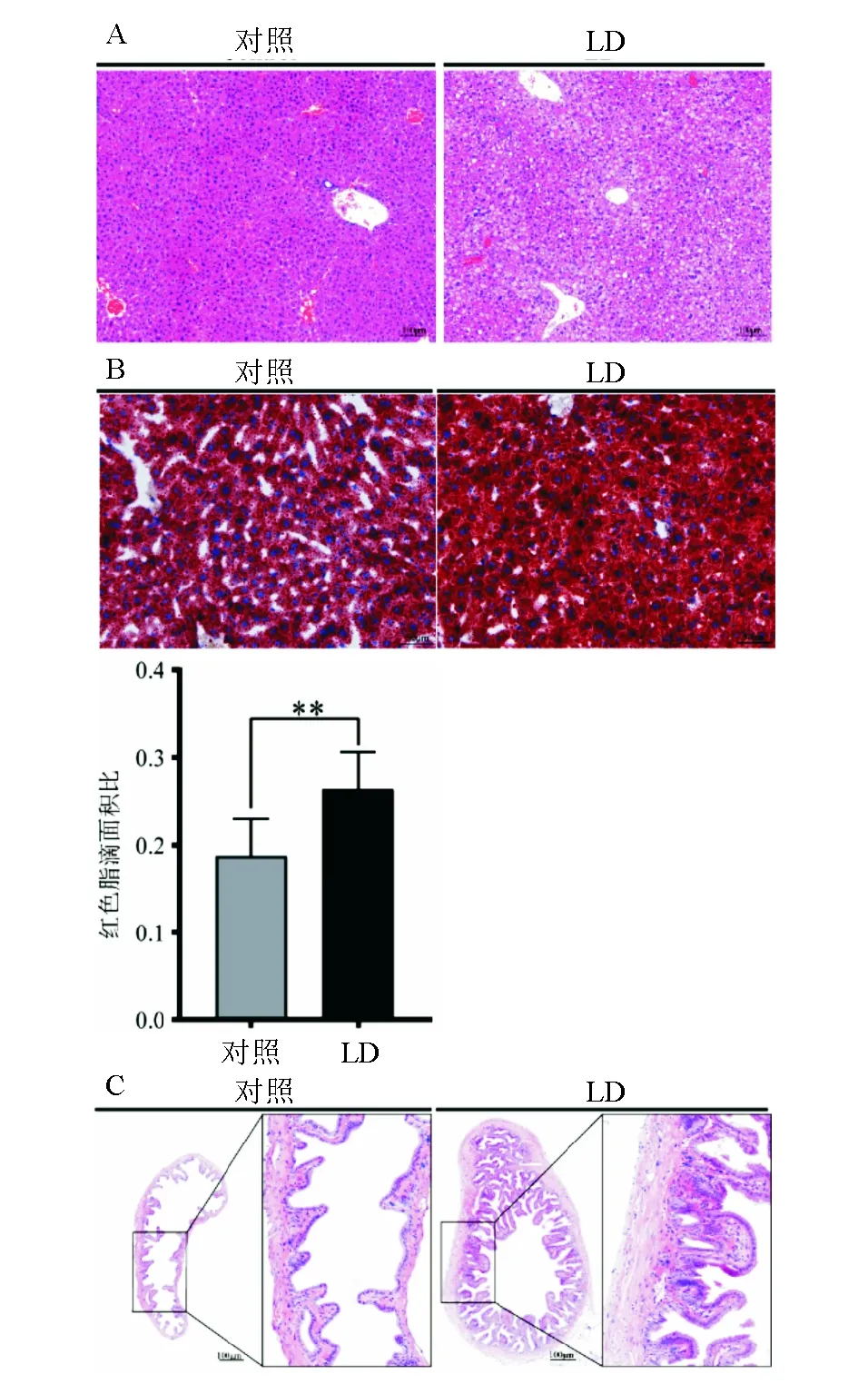
**两组间比较,P<0.01A:肝脏HE染色(×150);B:肝脏油红染色(×300);C:胆囊HE染色(完整视图,×50;局部放大视图,×200)图3 对照组与LD组小鼠肝脏、胆囊HE染色和肝脏油红染色比较
三、肝脏差异表达基因筛选
以P<0.05和差异表达倍数>2为标准,共筛选出1 330个LD组肝脏组织相对于对照组的差异表达基因,其中上调基因420个,下调基因910个,据此绘制火山图(图4A),热图展示了差异表达最显著的前50个基因(图4B)。
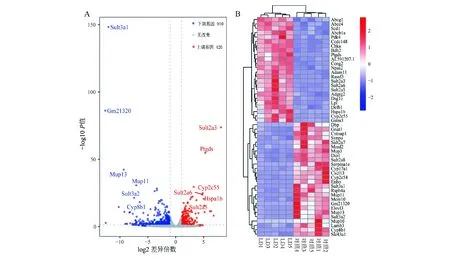
图4 LD组小鼠肝脏组织差异表达基因火山图(A)和热图(B)
四、差异表达基因KEGG富集分析和GO功能富集分析
对筛选出的差异表达基因进行KEGG富集分析,结果显示差异表达基因在19条通路显著富集(图5A),主要富集于脂类代谢、胆汁分泌、胰岛素分泌等通路。GO功能注释、富集分析显示,在生物过程分组,脂肪酸代谢过程相关通路是显著富集的类型;在细胞组分分组,细胞膜等与物质转运相关的细胞组分是显著富集的类型;在分子功能分组,甾体羟化酶活性、离子跨膜转运蛋白活性等相关通路是显著富集的类型(图5B)。

图5 差异表达基因KEGG富集分析(A)和GO富集分析(B)
五、Real-time PCR 验证肝脏胆汁酸合成相关基因表达
肝脏组织中胆汁酸合成相关基因CYP7A1、CYP8B1和CYP7B1在LD组的相对表达量均低于对照组,差异有统计学意义(P=0.02,P<0.01,P<0.01),两组间CYP27A1表达差异无统计学意义(P>0.05;图6)。上述基因表达情况的real-time PCR验证结果与肝脏转录组学分析结果一致。

两组间比较,*P<0.05, **P<0.01
讨 论
目前观点认为,胆汁胆固醇过饱和是胆固醇结石形成的首要条件[8]。本研究发现,经8周成石饲料喂养后,小鼠胆囊胆汁中胆固醇含量明显增加。小肠是胆固醇吸收的主要场所,成石饲料中的胆酸可显著促进小肠胆固醇吸收[5]。过量的胆固醇吸收使小鼠血清总胆固醇以及其他脂质含量明显增加。此外,成石饲料喂养的小鼠还表现为肝大和显著的肝脏脂肪变性,肝脏分泌进入胆汁的胆固醇增多,最终导致胆汁胆固醇含量增加,促进胆汁胆固醇过饱和发生和结石形成。尽管成石饲料中含有15%的脂肪,但本研究中LD组小鼠造模过程中体质量的变化与对照组相比并无明显差异。既往研究也发现,在高脂饮食中额外添加0.5%胆酸可在不影响小鼠进食量的情况下显著抑制和逆转高脂饮食诱导的体质量增加,其机制可能与胆酸与G蛋白耦联胆汁酸受体1(G protein-coupled bile acid receptor 1, GPBAR1)结合,进而通过环腺苷酸(cAMP)介导甲状腺激素激活、增加能量消耗有关[11-12]。因此,添加胆酸是胆固醇结石模型与许多其他高脂饮食模型的重要不同之处,在参考其他无胆酸高脂饮食模型的研究结果时,应考虑如有胆酸存在,对结果会有何种影响。
转录组是指特定组织或细胞在某一发育阶段或功能状态下转录出的所有 RNA的总和,转录组学能从整体水平研究基因功能,筛选出差异表达基因,为在分子水平寻找潜在致病基因提供了极大的便利[13]。本研究通过Illumina NovaSeq测序平台对小鼠肝脏组织RNA进行高通量测序和生物信息学分析,探讨成石饲料诱导小鼠胆囊胆固醇结石形成的潜在机制。结果共筛选出1 330个差异表达基因,其中上调基因420个,下调基因910个。胆汁酸主要由肝细胞通过经典途径和替代途径合成。经典途径由CYP7A1启动,替代途径由CYP27A1启动,CYP8B1、CYP7B1也在胆汁酸合成过程中发挥关键作用[14]。Real-time PCR验证显示,胆汁酸合成限速酶CYP7A1在LD组小鼠肝脏组织中表达下调, CYP8B1、CYP7B1表达亦显著下调,提示模型小鼠自身胆汁酸合成显著受抑,推测可能与成石饲料中的胆酸激活核受体法尼酯X受体(farnesoid X receptor, FXR),进而抑制CYP7A1等基因转录有关[15-16]。既往研究发现普通饲料喂养的小鼠胆汁中存在大量亲水性胆汁酸牛磺-β鼠胆酸(tauro-β-muricholic acid, T-βMCA)[14],而经成石饲料喂养后,疏水性胆酸盐替代了胆汁中原先含量最高的T-βMCA,胆汁疏水性增加,进而促进胆汁胆固醇过饱和发生[5,17]。胆固醇结石与胰岛素抵抗以及非酒精性脂肪性肝病、2型糖尿病等代谢相关疾病存在密切联系[7,18],有学者认为胆固醇结石是代谢综合征的一种表现形式[19]。本研究KEGG分析进一步显示,LD组小鼠肝脏组织差异表达基因主要在脂类代谢、胆汁分泌、胰岛素分泌等通路富集;GO分析提示脂肪酸代谢过程相关通路是显著富集的类型。因此,胆汁酸、脂肪酸等代谢紊乱可能是胆囊胆固醇结石形成的重要因素。
综上所述,本研究探讨了高脂饮食诱导小鼠胆囊胆固醇结石模型的特征,并通过肝脏转录组学分析筛选出在胆固醇结石形成过程中发挥作用的差异表达基因,研究结果提示模型小鼠存在自身胆汁酸合成障碍以及胆固醇、脂肪酸代谢紊乱,可能与胆固醇结石形成密切相关,为胆固醇结石成因及其防治研究提供了参考。

