人工碳纳米材料的植物效应研究进展
张冠琳 高存斌 刘玉真
摘要:随着纳米科技的发展,人工碳纳米材料(Engineered carbon nanomaterials,ECNMs)在诸多领域得到广泛应用。与此同时,ECNMs不可避免地释放进入环境,增加与生物接触的机会,其生物毒性效应及潜在的环境风险不容忽视。植物是人类重要的食物来源,目前已有研究表明ECNMs对植物有毒害作用,对食品安全及人类健康造成威胁。鉴于此,在简要介绍ECNMs环境来源的基础上,综述了目前国内外关于ECNMs对植物生理生长的影响及作用机制的研究进展,并对当前研究方法和面临的挑战进行探讨,为ECNMs的生物安全性评估、植物保护、原材料的合理规划使用提供一定的理论依据与实践参考。
关键词:碳纳米材料;植物毒性;作用机制;生物安全
中图分类号:X171.5 文献标识码:A
文章编号:0439-8114(2020)02-0014-06
DOI:10.14088/j.cnki.issn0439-8114.2020.02.003 开放科学(资源服务)标识码(OSID):
Research advances on plant effects of engineered carbon nanomaterials
ZHANG Guan-lin,GAO Cun-bin,LIU Yu-zhen
(College of Geography and Environment,Shandong Normal University,Jinan 116023,China)
Abstract: With the development of nanotechnology, engineered carbon nanomaterials are widely used in many fields. Meanwhile, ECNMs inevitably release into the environment, which will enhance the chances of contact with organisms. Biological toxicity and potential environmental risks can not be ignored. Plants are an important source of human food. At present, the researches have shown that ECNMs have toxic effects on plants and threaten food safety and human health. Based on the brief introduction of the environmental sources of ECNMs, the research progress of the effect and mechanism of ECNMs on the physiological growth of plants at home and abroad was summarized, the current research methods and challenges were discussed, so as to provide theoretical basis and practical reference for the biosafety assessment, plant protection and rational planning and using of raw materials of ECNMs.
Key words: carbon nanomaterials; plant toxicity; mechanism of action; biological safety
人工碳纳米材料(Engineered carbon nanomaterials,ECNMs)是指在三维空间中至少有一维处于1~100 nm范围内的碳基纳米材料[1],主要包括碳纳米管(Carbon nanotubes,CNTs)、石墨烯、富勒烯(Fullerene)及其各自的衍生物。由于其优异的性能,ECNMs在抗菌材料、生物医药、能源储存、电子器件等众多领域得到广泛应用[1-4]。与此同时,ECNMs在生产、运输、使用、回收处置的过程中不可避免地释放进入环境,与环境中的植物接触,且已有研究表明ECNMs能够穿透植物细胞壁、细胞膜进入体内,并造成包含细胞凋亡、组织病变、器官损伤、个体发育迟缓及存活率下降等在内的多种植物毒性[5-8]。而目前关于ECNMs的研究以制备和应用居多,对其植物毒性效应及潜在的环境風险的研究鲜见报道,因此越来越多的学者开始关注这一问题,相继开展了一系列研究。本文从ECNMs对植物生理生长的影响出发,重点综述了ECNMs对植物毒害、促进及其他影响的研究进展,在此基础上归纳总结了ECNMs植物效应作用机制,并对当前的研究方法及趋势进行了探讨与展望,对植物保护、食品健康及生态安全的研究具有重要意义。
1 ECNMs的环境来源
ECNMs因其独特、优异的性能得到广泛应用,据测算,ECNMs市场份额呈逐年递增态势,复合增长率达到20.1%,预计2020年将达到56.4亿美元[9]。高额产量导致ECNMs在环境中暴露水平提高,在消费和使用过程中可能释放、扩散进入大气和陆地,通过沉降、径流等方式汇集和固定在土壤中。Mueller等[10]在2008年基于对瑞士土壤每年的物质流进行分析,推算出ECNMs暴露浓度为0.27 ng/(kg·d);Gottschalk等[11]在2009年基于对工程碳纳米产品的生命周期分析提出ECNMs暴露浓度为0.55 ng/(kg·d),在欧洲、美国等高暴露地区可达1.53~5.26 pg/(kg·d);Sun等[12]在2014年对ECNMs生命周期分析后指出ECNMs暴露浓度增长迅速,达到1.09 μg/(kg·d)。此外,随着近年来ECNMs在大气中的浓度日益升高,其污染范围和危害性日趋严重。Carboni等[13]对荷兰阿姆斯特丹市土壤进行采样测量,发现高达48%的土壤样本均有ECNMs的检出,且在人口密集区、工业区周边和下风向区域检出了更高的浓度;Kolosnjaj-Tabi等[14]指出,目前柴油机排气含大量ECNMs,且随着柴油车占比的增高,ECNMs在空气中的浓度呈递增趋势,最终ECNMs会进入人体或在土壤中固定沉积,引发一系列环境问题。
ECNMs在环境中富集并被植物吸收,通过植物进入食物链,继而对人类安全造成威胁,因为农田土壤安全关乎人类健康。目前,ECNMs主要以缓释/控释肥料的纳米包膜[15]、土壤环境传感器[16]、土壤改良剂[17]、土壤修复剂[18]等形式进入农田土壤。如国外富含ECNMs的工业废水经活性污泥法处理后,富含ECNMs的剩余污泥60%会作为肥料直接施入农田[19],ECNMs进入土壤后将会长期固定、吸附在土壤中,移动性降低,对农田环境和植物生长产生长期、难以预料的影响[20,21]。
2 ECNMs的植物效应
2.1 ECNMs对植物的毒害作用
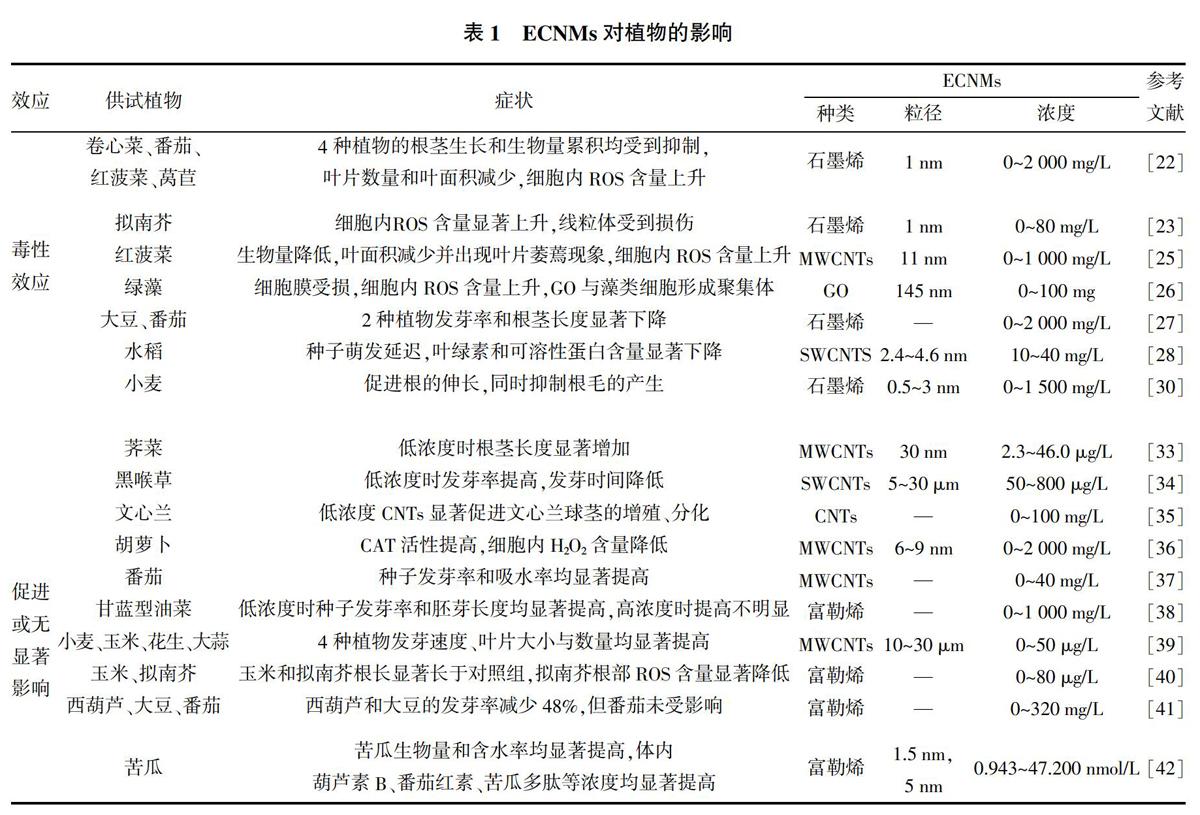
关于ECNMs对植物个体发育及生理生长的影响,相关学者已开展诸多研究并取得了一定的成果(表1)。研究发现,ECNMs对植物种子萌发及幼苗生长会产生抑制作用,对细胞内线粒体造成损伤,并证明氧化应激是其主要的毒性效应作用机制[22,23]。Begum等[22]研究发现,石墨烯能显著降低卷心菜、番茄、红菠菜等的生物量,高浓度(2 000 mg/L)石墨烯作用下,根毛几乎消失,呈现明显的时间-剂量-效应关系。同样,Ghodake等[24]在研究中也发现类似现象。Begum等[23]对此现象进行深入研究,发现当石墨烯为40 mg/L时,拟南芥细胞的活性氧含量开始显著上升,当浓度达到80 mg/L时,细胞中线粒体开始受到损伤;Begum等[25]还发现多壁碳纳米管(Multi-walled carbon nanotubes,MWCNTs)也会对植物产生类似的毒性效应,红菠菜暴露15 d后,体内ROS累积表现出明显的氧化胁迫症状;当补充抗坏血酸后,这些效应被逆转,证明ROS在MWCNTs毒性效应中起主导作用,间接说明氧化应激是造成MWCNTs毒性效应的主要机制。此外,Begum等[22]发现MWCNTs的毒性效应随植物种类的不同而有所差异,与对照组相比,生菜、红菠菜、黄瓜、水稻的根和茎生长受到抑制,而辣椒、大豆几乎没有观察到毒性作用。
除此之外,近年来的诸多研究也证实ECNMs对植物存在毒性作用,主要表现为种子发芽率降低,幼苗根、茎发育迟缓,叶绿素、蛋白质等含量下降,细胞膜被破坏。Nogueira等[26]研究发现,经氧化石墨烯(GO)处理的藻类细胞,ROS含量上升,细胞膜受到损伤,氧化应激效应显著;同时,随时间的延长,GO发生团聚,并吸附在藻类细胞表面形成藻类-纳米碳聚集体,导致间接毒性效应。Chang等[27]研究发现,单壁碳纳米管(Single-walled carbon nanotubes,SWCNTs)和MWCNTs处理均可导致小麦根系生物量、根长和根茎表面积发生显著下降。同样,袁刚强等[28]研究發现,10~40 mg/L的SWCNTs延迟了水稻种子萌发,降低了幼苗鲜重,且水稻叶绿素和可溶性蛋白含量随SWCNTs浓度的增加而下降。
2.2 ECNMs对植物生长的促进作用
近年来国内外研究表明,ECNMs因暴露浓度和受试植物种类不同,对植物生长发育的影响并不显著,基本不产生毒性效应,有的反而起促进作用(表1)。研究发现,适宜浓度范围内的ECNMs对植物种子萌发、根和茎的伸长、酶活性、营养品质等具有正向调节作用[29-32]。Mondal等[33]用改性碳纳米管(2.3~46 μg/L)处理芥菜种子,结果显示最低浓度处理组(2.3 μg/L改性碳纳米管)芥菜根、茎较对照组伸长2.5倍和1.6倍;Hatami等[34]用SWCNTs(50~800 μg/mL)处理天仙子,发现低浓度处理组发芽率提高,发芽时间降低;李佳慧[35]用0~100 mg/L CNTs处理文心兰,发现低浓度CNTs(25、50 mg/L)对文心兰球茎的增殖、分化具有显著促进作用,且有利于文心兰的生根和壮苗;Park等[36]用0~2 000 mg/L MWCNTs处理胡萝卜,结果显示MWCNTs提高了胡萝卜CAT的活性,从而减少了胡萝卜H2O2含量,有延缓衰老的效果。
关于植物在添加ECNMs条件下种子发芽率提高、根和茎伸长的原因,有关学者进行了研究,发现ECNMs可以渗透进入植物种子内部,有助于种子对水分的吸收,并调整其酶活性,从而促进了种子的萌发及根、茎的伸长[37-40]。Khodakovskaya等[37]研究发现0~40 μg/mL MWCNTs可使番茄种子发芽率提高,同时发现种子的含水率高于对照组;Xiong等[38]研究发现低浓度富勒烯可促进甘蓝型油菜的发芽,并提出可通过施加适宜浓度的富勒烯,缓解干旱环境下水分胁迫对种子萌发及生长的不良影响;Rao等[39]用0~50 μg/L MWCNTs处理小麦、玉米、花生、大蒜,发现4种作物经处理后的发芽速度较对照组快3~4倍,且幼苗叶片数量和大小呈现剂量依赖性,认为低浓度MWCNTs通过促进植物吸水来缩短发芽时间及提高生物量;来佳佳[40]在聚乙二醇模拟干旱胁迫条件下,用0~80 μg/L C60处理玉米和拟南芥种子,发现经处理后的玉米和拟南芥根长均显著长于对照组,深入研究发现拟南芥根部ROS含量明显低于对照组,推测C60可能通过清除根部ROS的方式促进根的伸长。
2.3 ECNMs对植物的其他影响
随着ECNMs的广泛使用,ECNMs将不可避免地释放进入环境在土壤中不断累积,而土壤中分布着大量微生物,1 g土壤中微生物数量通常为几亿到几百亿个,已有研究表明微生物所处的特殊的根际环境影响ECNMs对植物的作用[43,44]。Hao等[43]以C60、rGO、MWCNTs进行水稻土壤盆栽试验,发现变形杆菌的敏感度随ECNMs种类的不同而变化,施加MWCNTs与rGO的土壤中变形杆菌数量显著下降,进而影响水稻的生长发育。另有研究发现,在土培条件下,经MWCNTs处理的番茄,开花数量和果实数为对照的2倍,且株高和后代种子数均提高[44];同时,采用变性梯度凝胶电泳和焦磷酸测序法测定土壤微生物,发现变形菌和拟杆菌成为优势类群,认为土壤微生物可将MWCNTs输送到土壤中以促进番茄生长,具体机制有待进一步研究[44]。
3 ECNMs的植物效应作用机制
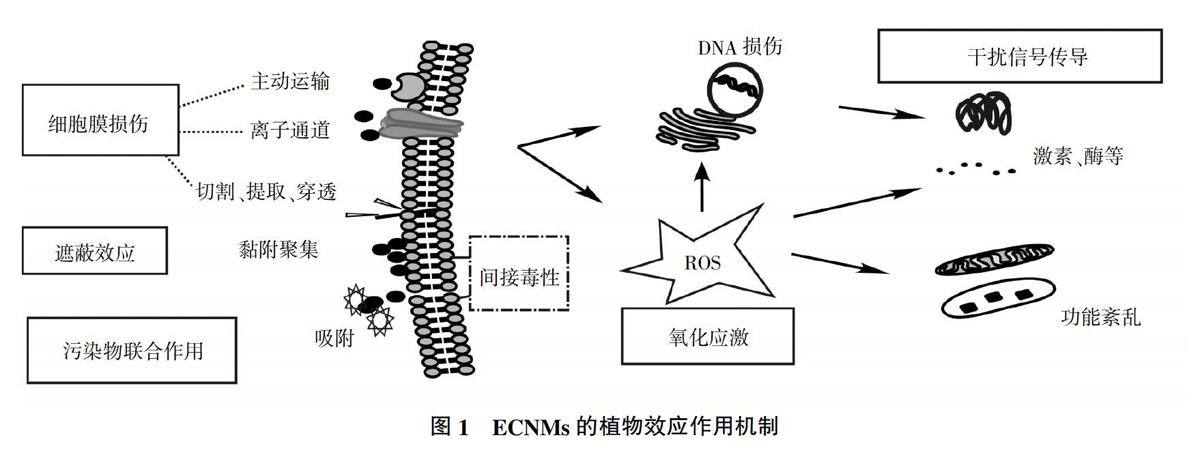
迄今为止,关于ECNMs植物效应的作用机制尚无统一定论,但目前普遍认同的作用机制主要有氧化应激、遮蔽效应、损伤细胞膜、干扰生物信号的表达以及与共存污染物联合作用等[45-49](图1)。同时,ECNMs植物效应往往不是由单一机制引起的,通常是多种机制综合作用的结果,目前其综合效应的研究尚处于探索阶段。
3.1 破坏细胞膜的完整性
呈针状、片层状等具有锋利边缘的ECNMs通过直接接触细胞膜,对细胞进行切割、穿刺或提取磷脂而破坏细胞膜完整性[45],大量胞质流出后产生空腔结构,导致细胞死亡[47,50]。除此之外,ECNMs通过内吞作用、主动运输、离子通道等方式进入细胞[51],并发生细胞内化。如Liu等[52]用羧基富勒烯(C70)处理烟草,发现C70使烟草细胞壁增厚,且切断了细胞膜和细胞壁之间的联系,引起细胞膜的破裂损伤,导致细胞凋亡。
3.2 氧化应激
目前,氧化应激被认为是ECNMs植物毒性效应主要的机制之一。活性氧(ROS)对信号传导很重要,正常情况下生物体内的抗氧化系统(包括抗氧化剂和抗氧化酶)能够及时清除细胞内多余ROS,并维持其动态平衡[53];ECNMs能够诱导ROS的产生,当ROS大量累积超过生物体抵御能力时,ROS无法被及时清除,此时生物体内发生氧化应激反应,导致脂质、蛋白质和核酸等生物大分子变性[52,54]、线粒体损伤甚至细胞凋亡[44]。Rong等[55]发现MWCNTs增强了蚕豆CAT、SOD、过氧化物酶(POD)、抗坏血酸过氧化物酶(APX)的活性,同时发现根系EP活性与细胞坏死数显著增加,证实MWCNTs引起的氧化应激导致根部的氧化损伤。
3.3 遮蔽效应
ECNMs常黏附于水生植物表面,团聚形成植物-纳米碳聚集体,降低植物对光的利用率并干扰营养物质的吸收,产生遮蔽效应[56],导致间接毒性。如牟凤伟[57]在进行SWCNTs斜生栅藻毒性试验时发现,在高浓度暴露组中,SWCNTs会在斜生栅藻分泌物的作用下在藻细胞周围大量聚集,降低光合作用效率,影响细胞的分裂增殖,导致斜生栅藻吸光度远低于对照组。
3.4 干扰生物信号的表达
ECNMs通过损伤DNA并干扰生物信号的表达是其植物效应的作用机制之一。ECNMs能够引起DNA链的断裂,引发基因突变、染色体畸变,同时诱导RNA表达失调,干扰生物体内酶的表达,由此对植物体产生影响[41,58]。如Khodakovskaya等[58]用MWCNTs处理烟草,发现烟草细胞内cycb基因表达程度显著提高,仅在處理后6 h内便增加至对照组的35倍;Hao等[41]研究了C60、还原型氧化石墨烯(rGO)和MWCNTs对水稻的影响,发现高浓度暴露下,水稻根中生长素、吲哚乙酸、油菜素类固醇和赤霉素4种植物生长调节剂的浓度较对照组显著升高,水稻芽中吲哚乙酸和赤霉素的含量显著提高,证明碳纳米材料对植物体生长调节剂含量有调节作用。
3.5 与共存污染物的联合作用
ECNMs自身具有丰富的比表面积,在生产、运输、迁移、转化过程中容易吸附并富集周围环境中的有机/无机污染物,成为污染物运载体,通过路易斯酸碱作用、静电作用、π键作用、疏水作用等产生协同或拮抗作用,改变污染物的生物有效性[49,51],由此对生物产生影响。胡献刚等[59]研究了砷、GO单一及复合污染对小麦生长的影响,发现低浓度砷促进了种子萌发,GO则无显著影响,而GO联合砷显著抑制小麦种子萌发;单一污染时小麦体内MDA及抗氧化酶活性均提高,复合污染则显著提高。复合过程中砷的形态从5价向3价和甲基砷转化,说明GO对小麦生长有毒害作用,并能显著增强砷对小麦萌发的毒性,今后的研究需注意GO与其他污染物间的协同作用。
4 展望
ECNMs因其优异的性能,在诸多领域得到广泛应用。与此同时,由于ECNMs的环境暴露,其潜在的风险必须加以重视。近年来,国内外众多学者聚焦于ECNMs植物效应这一问题,当前已在该方面取得较多进展。已有研究表明,ECNMs对植物具有一定的毒性,但也不乏积极作用。由于影响因素繁多复杂,而当前的研究在植物类型、受试条件、研究手段等方面还存在一定的局限性,若要全面充分地认识ECNMs的植物效应,准确理解并阐明其作用机制,仍需进行更加深入的研究。从已有报道来看,当前关于ECNMs植物效应的研究仍存在一些问题。
1)实际环境复杂多变。目前的试验模拟条件与真实环境相比仍存在较大差异,当前研究大多开展了ECNMs植物毒性急性试验,而实际环境中的ECNMs多以低剂量、长期暴露的方式对植物产生影响;同时,进入环境中的ECNMs与当地植物、微生物群落等相互影响,目前缺乏这一系统的生态效应评估。上述条件的限制使实验室研究结果与真实结果有所偏差,后续开展大田试验等真实环境条件下ECNMs植物效应的研究十分必要。
2)联合效应研究不足。目前,关于ECNMs联合或混合效应的研究仍较少,而进入环境中的ECNMs在水、气、土等环境介质中迁移、转化,加之其强烈的吸附特性,ECNMs不可避免地与环境中其他污染物相互作用,所以联合效应才能更加准确、真实地反映ECNMs对植物的影响,因此相关研究需要进一步补充完善。
3)研究手段仍需丰富。目前研究中常用扫描电镜、透射电镜等手段观察ECNMs在植物体内的分布,但存在分辨率不足、静态成像等缺陷,若要具体、清晰地了解ECNMs在植物体内的吸收、转运行为,需要继续丰富研究手段,利用标记示踪、荧光分析等技术进行更为直观详尽的研究,加强蛋白质组分析、基因组分析及表观遗传等分子水平的研究。
4)方法标准尚待规范。对于ECNMs生物效应的研究,目前的研究常出现结论不一的情况,究其原因是当前对ECNMs植物效应定性定量的试验方法尚未加以规范,鉴于ECNMs影响因素的复杂性,今后的研究应逐步建立起一套科学、系统的试验标准方法。
綜上所述,随着未来ECNMs生产使用量的增加及在环境中的累积,对于ECNMs植物效应的研究势在必行,在此基础上今后应开展相应的生物安全性评估及植物保护工作,并合理规划原材料的生产使用量,以应对ECNMs广泛应用而带来的生态风险与环境挑战。
参考文献:
[1] NOVOSELOV K S,FAL′KO V I,COLOMBO L,et al. A roadmap for grapheme[J].Nature,2012,490(7419):192-200.
[2] JELMY E J,RAMAKRISHNAN S,RANGARAJAN M,et al. Effect of different carbon fillers and dopant acids on electrical properties of polyaniline nanocomposites[J].Bulletin of materials science,2013,36(1):37-44.
[3] ACIK M,DARLING S B. Graphene in perovskite solar cells:Device design,characterization and implementation[J].Journal of materials chemistry A,2016,4(17):6185-6235.
[4] KOSTARELOS K,NOVOSELOV K S. Exploring the interface of graphene and biology[J].Science,2014,344(6181):261-263.
[5] ZHAO J,CAO X S,WANG Z Y,et al. Mechanistic understanding toward the toxicity of graphene-family materials to freshwater algae[J].Water research,2017,111:18-27.
[6] GHODAKE G,SEO Y D,PARK D,et al. Phytotoxicity of carbon nanotubes assessed by brassica juncea and phaseolus mungo[J].Journal of nanoelectronics & optoelectronics,2010,5(5):157-160.
[7] 朱小山,朱 琳,郎宇鹏,等.富勒烯及其衍生物对斑马鱼胚胎发育毒性的比较[J].中国环境科学,2008,28(2):173-177.
[8] LI B,YANG J,HUANG Q,et al. Biodistribution and pulmonary toxicity of intratracheally instilled graphene oxide in mice[J].Npg Asia Materials,2013,5(5):237-239.
[9] PIKULA K S,ZAKHARENKO A M,CHAIKA V V,et al. Effects of carbon and silicon nanotubes and carbon nanofibers on marine microalgae,Heterosigma akashiwo[J].Environmental research,2018,166:473-480.
[10] MUELLER N C,NOWACK B. Exposure modeling of engineered nanoparticles in the environment[J].Environmental science & technology,2008,42(12):4447-4453.
[11] GOTTSCHALK F,SONDERER T,SCHOLZ R W,et al. Modeled environmental concentrations of engineered nanomaterials(TiO2,ZnO,Ag,CNT,fullerenes) for different regions[J].Environmental science & technology,2009,43(24):9216-9222.
[12] SUN T Y,GOTTSCHALK F,HUNGERB?譈HLER K,et al. Comprehensive probabilistic modelling of environmental emissions of engineered nanomaterials[J].Environmental pollution,2014, 185(4):69-76.
[13] CARBONI A,HELMUS R,EMKE E,et al. Analysis of fullerenes in soils samples collected in The Netherlands[J].Environmental pollution,2016,219:47-55.
[14] KOLOSNJAJ-TABI J,SZWARC H,MOUSSA F. Carbon nanotubes:Culprit or witness of air pollution?[J].Nanotoday,2017,15:11-14.
[15] LIANG T B,YIN Q S,ZHANG Y L,et al. Effects of carbon nanoparticles application on the growth, physiological characteristics and nutrient accumulation in tobacco plants[J].Journal of food agriculture environment,2013,11(3):954-958.
[16] PALAPARTHY V S,HEMEN K,SURYA S G,et al. Graphene oxide based soil moisture microsensor for in situ agriculture applications[J].Sensors and actuators B:chemical,2018,273:1660-1669.
[17] SHAABAN M,VAN ZWIETEN L,BASHIR S,et al. A concise review of biochar application to agricultural soils to improve soil conditions and fight pollution[J].Journal of environmental management,2018,228(15):429-440.
[18] XIONG T,YUAN X,WANG H,et al. Implication of graphene oxide in Cd-contaminated soil:A case study of bacterial communities[J].Journal of environmental management,2018,205:99-106.
[19] WANG Y,WESTERHOFF P,HRISTOVSKi K D. Fate and biological effects of silver,titanium dioxide,and C60(fullerene) nanomaterials during simulated wastewater treatment processes[J].Journal of hazardous materials,2012,201-202:16-22.
[20] CHEN M,ZHOU S,ZHU Y,et al. Toxicity of carbon nanomaterials to liants,animals and microbes:Recent progress from 2015-present[J].Chemosphere,2018,206:255-264.
[21] NAVARRO D A,KOOKANA R S,MCLAUGHLIN M J,et al. Fate of radiolabeled C60 fullerenes in aged soils[J].Environmental pollution,2017,221:293-300.
[22] BEGUM P,IKHTIARI R,FUGETSU B. Graphene phytotoxicity in the seedling stage of cabbage,tomato,red spinach,and lettuce[J].Carbon,2011,49(12):3907-3919.
[23] BEGUM P,FUGETSU B. Induction of cell death by graphene in Arabidopsis thaliana,(Columbia ecotype) T87 cell suspensions[J].Journal of hazardous materials,2013,260(18):1032-1041.
[24] GHODAKE G,SEO Y D,PARK D,et al. Phytotoxicity of carbon nanotubes assessed by Brassica juncea and Phaseolus mungo[J].Journal of nanoelectronics & optoelectronics,2010,5(5):157-160.
[25] BEGUM P,FUGETSU B. Phytotoxicity of multi-walled carbon nanotubes on red spinach (Amaranthus tricolor L.) and the role of ascorbic acid as an antioxidant[J].Journal of hazardous materials,2012,243(4):212-222.
[26] NOGUEIRA P F M,NAKABAYASHI D,ZUCOLOTTO V. The effects of graphene oxide on green algae Raphidocelis subcapitata[J].Aquatic toxicology,2015,166(8):29-35.
[27] CHANG X P,SONG Z G,XU Y L,et al. Effects of carbon nanotubes on growth of wheat seedlings and Cd uptake[J].Chemosphere,2020,240:124931.
[28] 袁剛强,龚继来,曾光明.单壁碳纳米管材料对水稻幼苗的毒性效应[J].环境科学学报,2015,35(12):4143-4149.
[29] LAHIANI M H,CHEN J,IRIN F,et al. Interaction of carbon nanohorns with plants:Uptake and biological effects[J].Carbon,2015,81(1):607-619.
[30] ZHANG P,ZHANG R,FANG X,et al. Toxic effects of graphene on the growth and nutritional levels of wheat (Triticum aestivum L.):Short-and long-term exposure studies[J].Journal of hazardous materials,2016,317:543-551.
[31] OLESZCZUK P,JO■KO I,XING B. The toxicity to plants of the sewage sludges containing multiwalled carbon nanotubes[J].Journal of hazardous materials,2011,186(1):436-442.
[32] WANG X P,HAN H,LIU X Q,et al. Multi-walled carbon nanotubes can enhance root elongation of wheat (Triticum aestivum) plants[J].Journal of nanoparticle research,2012,14(6):841.
[33] MONDAL A,BASU R,DAS S,et al. Beneficial role of carbon nanotubes on mustard plant growth:An agricultural prospect[J].Journal of nanoparticle research,2011,13(10):4519-4528.
[34] HATAMI M,HADIAN J,GHORBANPOUR M. Mechanisms underlying toxicity and stimulatory role of single-walled carbon nanotubes in Hyoscyamus niger during drought stress simulated by polyethylene glycol[J].Journal of hazardous materials,2017, 324:306-320.
[35] 李佳慧.碳納米管处理对文心兰类原球茎增殖、分化和无菌苗生长的影响及相关机理研究[D].南京:南京农业大学,2015.
[36] PARK S,AHN Y J. Multi-walled carbon nanotubes and silver nanoparticles differentially affect seed germination,chlorophyll content,and hydrogen peroxide accumulation in carrot (Daucus carota L.)[J].Biocatalysis and agricultural biotechnology,2016,8:257-262.
[37] KHODAKOVSKAYA M V,DERVISHI E,MAHMOOD M,et al. Carbon nanotubes are able to penetrate plant seed coat and dramatically affect seed germination and plant growth[J].Acs Nano,2012,6(8):3221-3227.
[38] XIONG J L,LI J,WANG H C,et al. Fullerol improves seed germination,biomass accumulation,photosynthesis and antioxidant system in Brassica napus L. under water stress[J].Plant Physiol Biochem,2018,129:130-140.
[39] RAO D P,SRIVASTAVA A. Enhancement of seed germination and plant growth of wheat,maize,peanut and garlic using multiwalled carbon nanotubes[J].European chemical bulletin,2014,3(5):502-504.
[40] 来佳佳. ROS参与新型碳纳米材料促进玉米根系伸长并提高抗旱性的探索研究[D].郑州:河南农业大学,2018.
[41] TORREROCHE R D L,HAWTHORNE J,DENG Y,et al. Fulle
rene-enhanced accumulation of p,p′-DDE in agricultural crop species[J].Environmental science & technology,2012,46(17):9315-9323.
[42] KOLE C,KOLE P,RANDUNU K M,et al. Nanobiotechnology can boost crop production and quality:First evidence from increased plant biomass, fruit yield and phytomedicine content in bitter melon (Momordica charantia)[J].BMC Biotechnology,2013,13(1):37.
[43] HAO Y,MA C X,ZHANG Z T,et al. Carbon nanomaterials alter plant physiology and soil bacterial community composition in a rice-soil-bacterial ecosystem[J].Environmental pollution,2017,232:123-136.
[44] KHODAKOVSKAYA M V,KIM B S,KIM J N,et al. Carbon nanotubes as plant growth regulators:Effects on tomato growth,reproductive system,and soil microbial community[J].Small,2013,9(1):115-123.
[45] AKHAVAN O,GHADERI E. Toxicity of graphene and graphene oxide nanowalls against bacteria[J].Acs Nano,2010,4(10):5731-5736.
[46] SINGH Z. Applications and toxicity of graphene family nanomaterials and their composites[J].Nanotechnology science & applications,2016,9(1):15-28.
[47] NOGUEIRA P F M,NAKABAYASHI D,ZUCOLOTTO V. The effects of graphene oxide on green algae Raphidocelis subcapitata[J].Aquatic toxicology,2015,166(8):29-35.
[48] ERSHOVA E S,SERGEEVA V A,CHAUSHEVA A I,et al. Toxic and DNA damaging effects of a functionalized fullerene in human embryonic lung fibroblasts[J].Mutation research-genetic toxicology and environmental mutagenesis,2016,805:46-57.
[49] WANG F,YAO J,LIU H,et al. Cu and Cr enhanced the effect of various carbon nanotubes on microbial communities in an aquatic environment[J].Journal of hazardous materials,2015, 292:137-145.
[50] 诸晓丹,唐子圣.氧化石墨烯抗菌作用及其生物安全性的研究进展[J].上海交通大学学报(医学版),2016,36(3):447-450.
[51] 曹际玲,冯有智,林先贵.人工纳米材料对植物-微生物影响的研究进展[J].土壤学报,2016,53(1):1-11.
[52] LIU Q,ZHANG X,ZHAO Y,et al. Fullerene-induced increase of glycosyl residue on living plant cell wall[J].Environmental science & technology,2013,47(13):7490-7498.
[53] 李 婷,张超智,沈 丹,等.石墨烯和氧化石墨烯的生物体毒性研究进展[J].南京大学学报(自然科学版),2016,52(2):235-243.
[54] LIANG J,XIA X,ZAMAN W Q,et al. Bioaccumulation and toxic effects of decabromodiphenyl ether in the presence of nanoscale zero-valent iron in an earthworm-soil system[J].Chemosphere,2017,169:78-88.
[55] RONG H,WANG C R,YU X R,et al. Carboxylated multi-walled carbon nanotubes exacerbated oxidative damage in roots of Vicia faba L. seedlings under combined stress of lead and cadmium[J].Ecotoxicology & environmental safety,2018,161:616-623.
[56] HU X,LU K,MU L,et al. Interactions between graphene oxide and plant cells:Regulation of cell morphology,uptake,organelle damage,oxidative effects and metabolic disorders[J].Carbon,2014,80(1):665-676.
[57] 牟凤伟.不同类型的碳纳米管对斜生栅藻的毒性效应研究[D].长沙:中南林业科技大学,2013.
[58] KHODAKOVSKAYA M V,DE SILVA K,BIRIS A S,et al. Carbon nanotubes induce growth enhancement of tobacco cells[J].ACS Nano,2012,6(3):2128-2135.
[59] 胡獻刚,康 佳,卢凯成,等.氧化石墨烯联合砷对小麦生态毒性[J].中国药理学与毒理学杂志,2013,27(S1):63.
收稿日期:2019-04-20
基金项目:山东省自然科学基金项目(ZR2016DM09);国家大学生创新创业训练计划项目(201810445087);山东省高校科研项目(J15LH06)
作者简介:张冠琳(1997-),女,山东寿光人,在读本科生,研究方向为环境科学,(电话)18340085930(电子信箱)guanlinz@126.com;通信作者,
刘玉真(1979-),女,山西绛县人,讲师,博士,主要从事土壤污染与治理研究,(电话)13854110599(电子信箱)yzhliu320@126.com。

