HIF-1α在七氟醚后处理减轻大鼠心肌缺血再灌注致线粒体功能损伤中的作用研究
杨龙,吴建江,王江,郑宏
缺血/再灌注损伤(I/RI)是围术期心脏不良事件发生和死亡的重要原因,有效降低围术期心肌缺血再灌注损伤是多学科亟待解决的问题。七氟醚因具有诱导平稳、苏醒迅速等独特的药理学特性而被广泛应用于临床和基础研究,同时也是围术期极具希望的对抗心肌缺血再灌注损伤的重要手段。研究发现,缺氧诱导因子-1α(HIF-1α)是参与低氧反应转录调节的转录因子,主要通过调控下游低氧敏感基因的表达使细胞在低氧环境下得以生存[1],被认为是心肌内源性保护机制的起始因子,也是介导七氟醚后处理发挥保护作用的关键靶标[2]。在心肌发生缺血再灌注损伤的情况下七氟醚后处理能够通过稳定线粒体功能发挥保护作用[3,4]。但是HIF-1α在七氟醚后处理减轻心肌缺血再灌注损伤中对线粒体功能有何影响尚不清楚。本研究旨在探讨HIF-1α在七氟醚后处理减轻大鼠心肌缺血再灌注致线粒体功能损伤中的作用,为围术期应用七氟醚后处理提供理论依据。
1 材料与方法
1.1 离体心脏灌注模型的制备清洁级健康成年雄性SD大鼠88只,体重250~300 g,16~20周龄,由新疆医科大学第一附属医院动物实验中心提供。参照文献[5]建立Langendorff离体心脏灌注模型:腹腔注射250 U/kg肝素抗凝和1%戊巴比妥钠40 mg/kg麻醉后仰卧位固定,消毒胸腹部皮肤后沿肋缘下横向剪开腹前壁,再沿腹中线向头端剪至剑突,切开膈肌后暴露胸腔,分离纵隔前组织,暴露心脏及心底部大血管,于心脏根部快速剪下心脏,保留主动脉3~4 mm,即刻放入预冷的4℃ K-H液中。使用眼科镊夹住主动脉两侧,4号手术线固定心脏于Langendorff灌注针上,用预先平衡的37℃ K-H液行主动脉逆行灌注。将肺动脉及左心耳剪开,以自制橡胶球囊沿左心耳经二尖瓣口插入左心室,连接Powerlab/8SP生物机能实验压力换能器系统,维持灌注压力60~70 mmHg,调节球囊大小和位置,保持左心室舒张末期压(LVEDP) 0~10 mmHg。上述步骤2 min内完成。纳入标准:离体心脏平衡20 min后,心衰(HR)>250 次/min、左心室舒张最低压(LVDP)>80 mmHg、室性早搏<2 次/min。
1.2 实验分组采用随机数字表法将88个离体灌注心脏分为4组(n=22),对照组(C组)、缺血再灌注组(I/R组)、七氟醚后处理组(Spost组)和HIF-1α抑制剂2ME2组(2ME2组)。C组持续灌注K-H液180 min;I/R组平衡20 min,缺血40 min,再灌注120 min;在缺血末复灌即刻,Spost组灌注经2.4%七氟醚(批号:67081,Maruishi Pharmaceutical公司,日本)饱和的K-H液15 min后续灌正常K-H液105 min;2ME2组复灌含2ME2(批号:S1233,Selleck公司,美国)+2.4%七氟醚饱和的K-H液15 min后续灌正常K-H液105 min。
1.3 方法
1.3.1 采用汉莎氧电极法测定线粒体State3、RCR参照文献[6],提取心肌线粒体后,按照Bradford蛋白浓度定量试剂盒(碧云天生物技术研究所)说明进行线粒体蛋白定量,并根据标准曲线计算样品蛋白浓度。参照文献[7],采用汉莎氧电极(英国,Hansatech Ltd公司)在配有磁力搅拌温控测氧池内测定(3 ml)线粒体3态、4态呼吸。反应液总体积为1000 μl,温度37℃,预先加入900 μl线粒体呼吸测定介质,平衡15 min后加入蛋白定量终浓度为1 mg/ml的线粒体悬液50 μl,记录20~30 s氧耗曲线,曲线基本平稳后,加入5 mmol/L琥珀酸10 μl和2 μmol/L鱼藤酮1 μl,进入4态呼吸,记录1 min,再加入100 μmol/L ADP 9 μl,进入3态呼吸;记录耗氧曲线变化情况,当ADP全部磷酸化转变为ATP后,线粒体进入4态呼吸。RCR=3态呼吸氧耗速率÷4态呼吸氧耗速率。
1.3.2 ATP含量采用ATP检测试剂盒(S0026,碧云天,中国)测定ATP含量,参照文献[8],20毫克心肌组织加入200 μl裂解液,然后用玻璃匀浆器充分匀浆确保组织被完全裂解。裂解后4℃12 000 g离心5 min,取上清用于后续的测定。100微升ATP检测工作液加到检测孔,室温放置3~5 min后各孔再加入20 μl样品,至少间隔2 s后用多功能酶标仪测定RLU值。
1.3.3 膜电位检测采用线粒体膜电位检测试剂盒(JC-1)测定膜电位(C2006,碧云天,中国)参照文献[9],将10 μl纯化的线粒体和90 μl稀释5倍的JC-1染色溶液加入到96孔板的每个孔中并混匀,在多功能酶标仪上以525 nm激发光/590 nm发射光测量JC-1聚合物荧光,490 nm激发光/530 nm发射光测量JC-1单体荧光,分别代表红色荧光和绿色荧光强度。数据表示为红/绿荧光单位(R/G FLU)的比率。
1.3.4 心肌细胞线粒体超微结构透射电镜观察心肌超微结构再灌注结束时随机取4个心脏,各组随机取1×1×1 mm左室心肌,经固定、漂洗、脱水、包埋、切片及染色后使用H-600型透射电镜(×10 000,Hitachi公司,日本)观察心肌细胞线粒体超微结构。
1.3.5 Western blot法检测HIF-1α表达复灌末随机取6个心脏,剪取左心室心肌组织,即刻置于液氮保存。提取心肌组织总蛋白,采用组织裂解液裂解,取样品30 μg,在SDS-PAGE凝胶系统中电泳、转膜,于37℃封闭2 h,加入鼠抗HIF-1α单克隆抗体(批号:ab463,Sigma公司,美国)和山羊抗GAPDH多克隆抗体(稀释度 1:1000,Sigma公司,美国),4℃孵育过夜,TBST液洗膜后加入二抗抗鼠IgG-HRP(批号:A4416,Sigma公司,美国)和抗山羊IgG-HRP(稀释度1:5000,Sigma公司,美国)室温孵育1 h。ECL显色成像,应用Quantity One图像分析系统对目的蛋白条带进行灰度值分析。
1.4 统计学处理采用SPSS 17.0软件进行分析,正态分布的计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 线粒体呼吸功能与I/R组比较,Spost组明显改善线粒体3态呼吸、RCR (P均<0.05);2ME2组与I/R组线粒体呼吸功能指标差异无统计学意义(P均>0.05)(表1)。
表1 四组心肌细胞线粒体State3(nmol/min·mg pro)及RCR的比较(n=12,±s)

表1 四组心肌细胞线粒体State3(nmol/min·mg pro)及RCR的比较(n=12,±s)
注:与C组相比,aP<0.05 ;与I/R相比,bP<0.05;与Spost相比,cP<0.05;State3:3态呼吸;RCR:呼吸控制比
指标 C组 I/R组 Spost组 2ME2组State3 146±7 70±6a 121±7ab 71±5ac RCR 2.24±0.15 1.12±0.08a 1.88±0.07ab 1.13±0.07ac
2.2 ATP含量测定与I/R组比较,Spost组ATP含量升高(P<0.05),2ME2组ATP含量差异无统计学意义(P>0.05)(图1)。
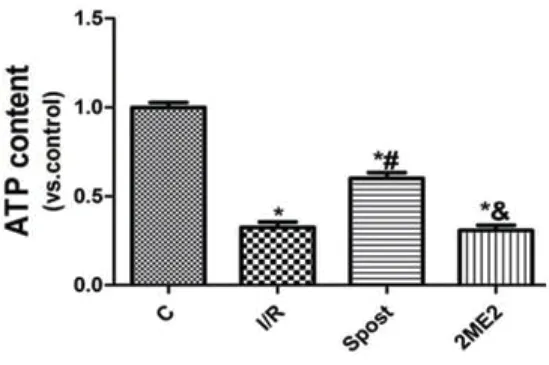
图1 各组ATP含量比较
2.3 线粒体膜电位与I/R组比较,Spost组膜电位升高(P<0.05),2ME2组膜电位差异无统计学意义(P>0.05)(图2)。

图2 各组线粒体膜电位比较
2.4 心肌线粒体超微结构与I/R组相比,Spost组心肌细胞结构受损较轻,肌丝排列尚整齐;大多线粒体形态完整,部分线粒体轻度肿胀,但未见溶解破裂;2ME2组心肌细胞结构受损程度与I/R组一致(图3)。
2.5 HIF-1α蛋白表达变化再灌注末Spost组缺血区心肌组织HIF-1α蛋白表达明显上调,与I/R组相比差异具有统计学意义(P<0.05)(图4)。
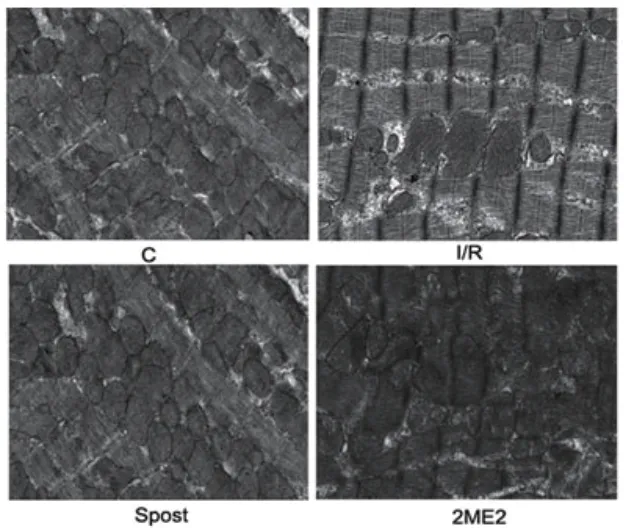
图3 电镜下各组心肌超微结构(x10000)
3 讨论
本研究采用Langendofff离体灌注模型[5],排除了体液、神经等因素的影响,便于观察药物对心脏的直接作用。本实验结果表明,大鼠离体心脏缺血再灌注后心肌超微结构破坏,提示离体心脏缺血再灌注损伤模型制备成功。参照文献[10]及预实验结果,本研究选择2.4%七氟醚饱和K-H液于缺血末至再灌注初15 min进行灌注。结果表明,Spost组心肌超微结构明显优于I/R组,这与Qi等[11]研究结果一致,表明七氟醚后处理减轻了大鼠离体心脏缺血再灌注损伤。

图4 各组HIF-1α蛋白表达
本研究中I/R组线粒体State3、RCR、ATP、膜电位明显降低,但Spost组State3、RCR、ATP、膜电位明显优于I/R组。结果说明心肌缺血再灌注导致线粒体功能受损而Spos能够改善粒体呼吸功能,增加缺血心肌能量供应,这可能归功于Spost能够有效维持线粒体结构和功能的完整[12,13]。但是有学者认为Spost可以改善缺血再灌注时线粒体功能,关键在于Spost能够促进线粒体自噬,减轻氧化应激[4]。本研究认为线粒体主要功能是通过电子传递链氧化磷酸化产生ATP,只有改善了线粒体呼吸功能,才能确保缺血心肌的能量供应。因为线粒体是真核生物细胞进行氧化磷酸化生成能量的场所,而State3、RCR是反映线粒体功能的灵敏指标,ATP是反映线粒体功能的直接指标,膜电位是反映线粒体完整性的客观指标。虽然功能完整的线粒体是细胞内各种生存信号的靶效应器,但是对缺血再灌注损伤所引起的细胞死亡信号非常敏感[14],当心肌缺血再灌注时线粒体结构及呼吸功能受损导致ATP合成减少,会进一步加重心肌损伤[15]。因此,改善线粒体呼吸功能是减轻缺血心肌损伤的关键。
本研究结果发现,Spost组HIF-1α表达上调,伴随State3、RCR明显改善且ATP、膜电位也不同程度增加。同时线粒体超微结构破坏少,比I/R组较好地维持了线粒体形态结构的完整性。提示HIF-1α表达上调可改善线粒体功能减轻心肌缺血再灌注损伤。有研究表明,HIF-1α是心肌内源性保护机制的关键靶标,缺氧情况下HIF-1α表达增加不但可调节线粒体呼吸链能量生成及维持CcO的活性,还能够减少线粒体来源的活性氧,从而避免心肌细胞损伤[16]。也有研究发现,HIF-1α表达增加可以激活VEGF表达促血管生成信号,进一步减少心肌梗死面积[17,18]。虽然以上研究都表明HIF-1α表达的增加能够减轻缺血心肌损伤,但并未阐明HIF-1α发挥心肌保护作用的分子机制。本研究重点关注Spost对抗心肌缺血再灌注时HIF-1α对线粒体功的影响,发现HIF-1α表达增加后改善线粒体呼吸功能或许是Spost发挥心肌保护作用的关键。
为进一步验证HIF-1α是介导Spost改善线粒体呼吸功能减轻心肌缺血再灌注损伤的重要靶标,本研究使用了HIF-1α的抑制剂2ME2,发现HIF-1α被抑制后上述改善消失。这说明在心肌缺血再灌注损伤时,HIF-1α是通过介导Spost稳定膜电位、改善线粒体呼吸、促进ATP生成,减轻缺血心肌损伤。但Neckář等人却认为HIF-1α是通过降解酶脯氨酰羟化酶结构域蛋白3(PHD3)来降低心肌梗死面积[19]。由此可见,HIF-1α表达增加可能通过多种途径来对抗心肌缺血再灌注损伤,但具体分子机制还有待大量的研究去阐明。
综上所述,HIF-1α表达上调后改善线粒体功能可能是七氟醚后处理发挥保护作用的内在机制。但本研究只限于离体水平,下一步还需通过在体动物实验验证HIF-1α在七氟醚后处理中的作用,并为临床麻醉中应用七氟醚后处理发挥心肌保护作用提供理论依据。

