中药外治对癌性疼痛患者血液IL-1β、TNF-α表达的影响
蔡妙国 俞慧君 张艳 邵卫 杨林 刘芳

[摘要] 目的 探讨中药外治对癌性疼痛患者血液IL-1β、TNF-α表达的影响。 方法 选择2016年10月~2017年10月台州恩泽医疗中心(集团)下属两家医院(路桥医院、恩泽医院)肿瘤内科100例癌性疼痛患者,采用自愿入组原则将患者分为对照组和观察组,每组50例;对照组给予盐酸羟考酮缓释片口服,观察组在对照组基础上给予中药穴位贴敷治疗;疗程均为2周,比较两组疼痛评分,并检测两组治疗前后血液IL-1β、TNF-α浓度变化。 结果 治疗前,两组疼痛评分比较无显著差异(t=0.23,P>0.05),治疗后第1周两组疼痛评分比较,观察组顯著低于对照组(t=4.21,P<0.01);治疗后第2周两组疼痛评分比较,观察组低于对照组更明显(t=12.83,P<0.01);疼痛评分比较,对照组随着治疗时间延长,显著降低(F=289.08,P<0.01),观察组随着治疗时间延长,降低更明显(F=452.05,P<0.01);治疗前,两组血液IL-1β、TNF-α浓度比较无显著差异(t=1.22;0.46,P>0.05);治疗第1周血液IL-1β、TNF-α浓度比较,观察组显著低于对照组(t=2.57;2.17,P<0.05),治疗第2周血液IL-1β、TNF-α浓度比较,观察组低于对照组更明显(t=6.17;3.25,P<0.01)。两组血液IL-1β、TNF-α浓度比较,对照组随着治疗时间延长差异无显著性(F=1.15;2.15,P>0.05);观察组随着治疗时间延长,显著降低(F=23.06,12.56,P<0.01)。 结论 中药外治能缓解癌性疼痛,降低癌性疼痛患者血液IL-1β、TNF-α水平。
[关键词] 中药外治;癌性疼痛;血液;IL-1β;TNF-α
[中图分类号] R259 [文献标识码] B [文章编号] 1673-9701(2020)07-0141-05
Effect of external treatment of traditional Chinese medicine on expression of IL-1β and TNF-α in blood of patients with cancer pain
CAI Miaoguo1 YU Huijun2 ZHANG Yan3 SHAO Wei1 YANG Lin1 LIU Fang1
1.Department of Oncology, Luqiao Hospital of Taizhou Enze Medical Center (Group) in Zhejiang Province, Taizhou 318050, China; 2.Department of Pediatrics, Luqiao Hospital of Taizhou Enze Medical Center(Group) in Zhejiang Province, Taizhou 318050, China; 3.Department of Traditional Chinese Medicine, Luqiao Hospital of Taizhou Enze Medical Center(Group) in Zhejiang Province, Taizhou 318050, China
[Abstract] Objective To investigate the effect of external treatment of traditional Chinese medicine on the expression of IL-1β and TNF-α in blood of patients with cancer pain. Methods From October 2016 to October 2017, 100 cancer pain patients in the oncology department of two hospitals (road and bridge hospital and Enze hospital) affiliated to Taizhou Enze Medical Center(Group) were selected. The patients were divided into control group and observation group according to the principle of voluntary admission, 50 in each group. The control group was given oxycodone hydrochloride sustained-release tablets orally, and the observation group was given traditional Chinese medicine acupoint application on the basis of treatment in the control group. The course of treatment was 2 weeks. The pain scores of the two groups were compared, and the changes of blood IL-1β and TNF-α concentrations before and after treatment were detected. Results Before treatment, there was no significant difference in pain scores between the two groups(t=0.23, P>0.05). At the first week after treatment, the pain scores of the observation group were significantly lower than those of the control group(t=4.21, P<0.01). In the second week after treatment, the pain scores of the observation group were significantly lower than those of the control group(t=12.83, P<0.01). The control group showed a significant decrease in pain score with prolonged treatment time(F=289.08, P<0.01). In the observation group, the pain score decreased more significantly with the treatment time(F=452.05, P<0.01). Before treatment, there was no significant difference in blood IL-1β and TNF-α concentrations between the two groups(t=1.22; 0.46, P>0.05). In the first week of treatment, the blood levels of IL-1β and TNF-α were significantly lower in the observation group than those in the control group(t=2.57; 2.17, P<0.05). And in the second week of treatment, the blood concentrations of IL-1β and TNF-α were significantly higher in the observation group than those in the control group(t=6.17; 3.25, P<0.01). The blood levels of IL-1β and TNF-α in the control group were not significantly different with the prolongation of treatment time(F=1.15; 2.15, P>0.05). The blood levels of IL-1β and TNF-α in the observation group decreased significantly with the prolonged treatment time(F=23.06; 12.56, P<0.01). Conclusion External treatment of traditional Chinese medicine can alleviate cancer pain and reduce the levels of IL-1β and TNF-α in patients with cancer pain.
[Key words] External treatment of traditional Chinese medicine; Cancer pain; Blood; IL-1β; TNF-α
据不完全统计[1],癌性疼痛是晚期恶性肿瘤患者的主要症状,约75%以上的患者可发生癌性疼痛。近年来,随着人口老龄化,我国癌症发病率呈增高趋势[2],甚至发病年龄逐渐年轻化[3]。如何缓解癌症患者疼痛,改善生存质量,成为医学界的共鸣。癌症三阶梯止痛法[4]是1986世界卫生组织(WHO)推荐的,是指轻度疼痛给予非阿片类(非甾类抗炎药)加减辅助止痛药;中度疼痛给予弱阿片类加减非甾类抗炎药和辅助止痛药;重度疼痛给予阿片类加减非甾类抗炎药和辅助止痛药。临床研究[5]显示,癌症三阶梯止痛法可使90%以上的癌症患者得到缓解。也有研究[6]显示,采用西药治疗不仅不能很好的控制疼痛,而且会出现如头晕、嗜睡等毒副反应。近年来,随着中医在肿瘤方面广泛应用,中药外治逐渐应用于癌性疼痛[7]。鲁玲玲等[8]研究证实,中药硬膏止痛方能有效缓解癌症疼痛。临床研究[9]显示,肿瘤组织中有20%~30%的巨噬细胞能产生肿瘤坏死因子-α(Tumor necrosis factor-α)和白细胞介素1β(Interleukin 1 beta,IL-1β)等,这些信息随后传输至中枢神经系统,即感知疼痛[10]。本研究通过检测癌症患者中药外治前后血液IL-1β、TNF-α浓度变化,进一步了解中药外治对癌性疼痛疗效及对血液IL-1β、TNF-α水平的影响,现报道如下。
1 资料与方法
1.1 一般资料
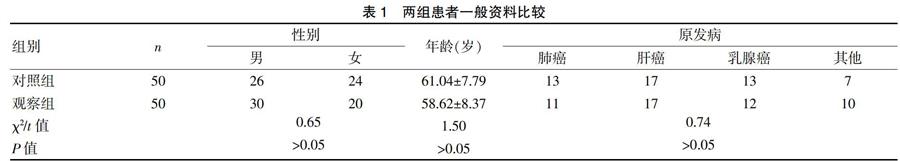
选取2016年10月~2017年10月台州恩泽医疗中心(集团)下属两家医院(路桥医院、恩泽医院)肿瘤内科100例癌性疼痛患者,其中男56例,女44例,平均年龄(59.87±8.06)岁,平均病程(2.15±0.87)年。所有患者均符合《癌症疼痛诊疗上海专家共识(2017年版)》[11]中制定的癌痛西医诊断标准。采用患者自愿入组并签署知情同意书分为对照组与观察组,各50例,对照组采用盐酸羟考酮缓释片治疗,观察组在对照组基础上给予中药穴位贴敷治疗。两组性别、年龄、原发病等一般资料比较,差异无统计学意义(P>0.05),具有可比性。见表1。
纳入标准[12]:①初治癌痛患者,均经影像学、组织病理学及细胞学等检查确诊为癌症;②癌症分期为Ⅱ~Ⅲ期;疼痛程度为中度疼痛或数字分级法(NRS)评分4~6分;③医院伦理委员会通过,且患者及家属签署知情同意书;④年龄18~75岁之間,预计生存期≥3个月;⑤近1周内未接受放疗或者神经阻断疗法及其他药物镇痛治疗者。排除标准[13]:①非癌症相关因素所致疼痛;②合并严重全身系统性疾病或严重心、肝、肾功能损害者;③对本研究中所有药物过敏者;④合并意识障碍、精神障碍、听力障碍、语言沟通障碍或认知功能障碍,无法正常交流者;⑤主动退出本研究或不能配合按规定用药者。
1.2 方法
1.2.1 血液采集与保存 所有研究对象均于治疗前、治疗第1周、第2周清晨空腹抽取静脉血10 mL,以半径为15.0 cm的离心机以转速3000 r/min进行离心15 min,取上清液置-70℃的冰箱低温保存。
1.2.2 治疗 对照组:盐酸羟考酮缓释片(10 mg,中国萌蒂制药有限公司,国药准字J20110016)1片/次,每12小时服用1次,疗程为2周。
观察组:盐酸羟考酮缓释片(10 mg,中国萌蒂制药有限公司,国药准字J20110016)1片/次,每12小时服用1次,疗程为2周;中药穴位贴敷治疗,自拟中药处方:蟾皮10 g、大腹皮12 g、桃仁12 g、大黄10 g、延胡索12 g、莪术15 g、红花10 g、青皮10 g、乳香9 g、没药9 g、水蛭9 g、冰片9 g,将上述中药成分研为细末,用酒精浸泡1个月以上,取出浸出液,将药粉调成稠糊状置于纱布上,在清洗欲敷药处皮肤之后外敷于疼痛部位,外敷厚度1~2 mm,操作完毕后用无菌敷料覆盖,每24小时更换1次。疗程为2周。
1.3 观察指标
1.3.1 疼痛强度分级标准 疼痛强度采用数字分级法(NRS法)[14]:将一条10 cm长的线段划分为10等份,从左到右依次标为0~10,其中0代表无痛,10代表最剧烈疼痛,分别于治疗前、治疗第1周和治疗第2周让患者找出一个最能代表其疼痛程度的数字,作为疼痛评分加以记录。
1.3.2 血液IL-1β和TNF-α含量检测 血液IL-1β和TNF-α含量均采用双抗体夹心法酶联免疫吸附实验(ELISA)检测,严格按照说明书进行,由基源生物科技(上海)有限公司负责操作,血液IL-1β和TNF-α试剂盒(ELISA试剂批号:201616、201654)均购自上海慧颖生物科技有限公司。
1.4 统计学方法
用SPSS17.0统计学软件进行分析,先进行正态性与方差齐性检验,计量资料以(x±s)表示,满足条件的组间比较采用单因素方差分析(one-way ANOVA),均数的两两比较采用LSD法,计数资料比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者不同治疗时间血液IL-1β和TNF-α浓度比较
治疗前两组血液IL-1β、TNF-α浓度无显著差异(t=1.22;0.46,P>0.05);治疗第1周,观察组血液IL-1β、TNF-α浓度有显著差异(t=2.57;2.17,P<0.05),治疗第2周,两组血液IL-1β、TNF-α浓度差异更显著(t=6.17;3.25,P<0.01)。两组不同治疗时间血液IL-1β、TNF-α浓度比较,对照组差异无显著性(F=1.15;2.15,P>0.05);观察组差异有显著性(F=23.06;12.56,P<0.01),且随着治疗时间延长,血液IL-1β、TNF-α浓度越低。见表2。
2.2 两组患者不同治疗时间疼痛评分比较
两组治疗前后疼痛评分(NRS评分)比较,治疗前无显著差异(t=0.23,P>0.05),治疗第1周有显著差异(t=4.21,P<0.01);治疗第2周更显著(t=12.83,P<0.01);不同治疗时间疼痛评分(NRS评分)比较,对照组有显著差异(F=289.08,P<0.01),观察组有显著差异(F=452.65,P<0.01)。见表3。
3 讨论
流行病学研究[15]显示,癌症发病率在多数国家呈明显上升趋势,癌性疼痛会对患者的身心健康、社会人际关系及总体生活质量等各方面产生深刻的影响。现代医学研究[16]认为,由于肿瘤的恶性生长直接压迫或浸润周围神经组织,癌组织的pH值变化、肿瘤疼痛物质的释放、细胞因子的释放等使得肿瘤神经周围环境的变化而引起疼痛。值得注意的是,早期非甾类抗炎药使用并不能有效缓解癌性疼痛。李鹏涛等[17]研究显示,细胞因子TNF-α、IL-1β不仅在外周神经系统参与痛觉传导通路的调节,目前预测细胞因子TNF-α、IL-1β可能参与了伤害性信息的传递,发挥调节疼痛的作用。依据疼痛评分给予三阶梯药物治疗,有效避免临床阿片类药物滥用现象[18]。目前在临床上已将癌症三阶梯止痛法应用于癌性疼痛的治疗,而且癌性疼痛也得到了极大的改善,但随着在临床上的广泛使用,其显示出的疼痛耐受问题也逐渐引起了临床医师的关注。尽管随着医学的进步和发展,癌症的治疗手段在不断地更新,但疼痛仍然是腫瘤患者需要面对的一个普遍问题。中医学将癌性疼痛称为癌瘤痛,是指由癌瘤侵犯脏腑经络,或瘤块停滞,经络气血运行不畅而致机体局部疼痛[19]。中医学认为,癌症的病机多为外邪侵袭、情志失节、正气亏虚、脏腑失调、痰湿内聚、气机紊乱、瘀血内阻、血运不畅。目前临床上普遍采用放化疗治疗晚期癌症,但长期放化疗之后会损伤正气,出现正虚邪实[20]。中药外治是将膏药贴敷于局部肿瘤相应的体表或痛处体表,使药物从表皮吸收并刺激相应经络和穴位,调理脏腑阴阳,疏通经络气血,从而达到治疗的目的[21]。临床多中心研究显示[22],中药(延胡索、马钱子、桃仁、红花、青风藤、丹参、薄荷脑、冰片等)止痛贴联合吗啡能缓解中重度癌痛(肝癌、骨转移癌)。但中医外用治疗癌痛作用机制尚不清楚。
NRS评分主观而且方便广泛用于临床疼痛评分。本研究结果显示,中药(蟾皮、大腹皮、桃仁、大黄等)外治可显著减少癌性疼痛患者NRS评分,且随着治疗时间延长,NRS评分越低,而中药(蟾皮、大腹皮、桃仁、大黄等)等具有清热解毒,活血化瘀作用,提示中药外治可显著减轻癌性疼痛。中药外用治疗癌性疼痛疗效虽然相当可靠,但是机制仍然不清楚,如何利用现代医学实验技术深入探讨中药外治癌痛的作用机制至关重要。动物实验研究显示[23],癌症疼痛外周血趋化因子IL-1β、TNF-α的表达水平明显提高,而IL-1β、TNF-α等拮抗剂可有效地阻止痛敏反应。本研究发现,癌性疼痛患者外周血液IL-1β、TNF-α水平显著升高,由此可以认为,癌性疼痛患者外周血液IL-1β、TNF-α参与癌性疼痛的发病过程,而且外周血液IL-1β、TNF-α水平有助于预测患者疼痛程度。中药外治可显著减少癌性疼痛患者外周血液IL-1β、TNF-α水平,虽无法确定中药(蟾皮、大腹皮、桃仁、大黄等)外治缓解癌性疼痛的作用机制,但至少可以确定中药外治可能与降低血液IL-1β、TNF-α水平有关。而且随着中药外治时间延长,血液IL-1β、TNF-α水平显著下降,而且疼痛程度也进一步减轻,血液IL-1β、TNF-α水平有助于判断癌性疼痛缓解情况。代丽萍等[24]临床研究显示,蟾皮水提取物对结肠癌细胞HCT-8、肺癌细胞A-549生长均有明显的抑制作用,而且体外研究发现[25],蟾皮提物也可以诱导癌细胞凋亡,并随着药物浓度梯度的增加,凋亡细胞数明显增加。大腹皮水煎液可减少炎症而促组织的修复作用[26],张晶等[27]研究显示,大黄可减少肿瘤血管形成,促进肿瘤细胞凋亡,抑制小鼠癌细胞的生长。推测蟾皮和大黄等外治可能通过减少肿瘤血管形成从而加速癌细胞凋亡,同时减少痛觉刺激而降低血液IL-1β、TNF-α水平,从而在一定程度上发挥减轻疼痛的作用。以敏等[28]研究显示,桃仁提取物能显著降低血黏度,抑制微血栓形成。从这个意义上来看,中药桃仁外用缓解癌性疼痛可能通过改善局部循环而发挥作用。由此可见,中药外治治疗癌性疼痛通过多种中药综合作用,蟾皮和大黄促进癌细胞凋亡,大腹皮减轻局部炎症,桃仁改善局部循环,诸药各司其职共同作用,从而减少局部痛觉刺激而降低细胞因子IL-1β、TNF-α水平释放。本研究相对病例较少,这种现象是否真实,或者仅仅是一个巧合,还需要更多的资料来进一步的研究。
综上所述,中药(蟾皮、大腹皮、桃仁、大黄等)外治癌性疼痛短期疗效肯定,细胞因子IL-1β和TNF-α参与癌性疼痛发病机理。中药外治癌性疼痛可能通过诸中药综合作用,促进局部癌细胞凋亡,减轻局部炎症,同时改善局部循环,从而降低血液IL-1β、TNF-α水平,减少痛觉信息的传递,达到减轻疼痛的治疗效果。尽管没有更多的资料进行有效的统计学分析和进一步的研究,但中药外治对癌性疼痛在理论上是合理的。在癌性疼痛治疗过程中,中药外治仍不失为可以考虑的一种治疗方法。
[参考文献]
[1] 华红伟,姜峰,程志军,等. 癌性疼痛多学科诊疗模式对晚期肿瘤患者姑息治疗的影响及思考[J]. 中国医学伦理学,2016,29(5):804-806.
[2] 丁贤彬,吕晓燕. 2006-2014年重庆市甲状腺癌发病率及趋势变化[J]. 中国慢性病预防与控制,2016,24(5):321-324.
[3] 谢珊艳,任鹏. 宫颈癌发病年轻化的趋势分析与相应对策[J]. 中医药管理杂志,2018,26(5): 10-12.
[4] 苟兰琼. 三阶梯镇痛原则在癌症减痛药物治疗中的应用研究[J]. 实用癌症杂志,2015,30(11): 1744-1746.
[5] 胡兰兰,吴洁,孔飞飞. 2014-2016年某院中心药房麻醉药品使用情况的调查与分析[J]. 中国医院药学杂志,2018,38(11):1231-1235.
[6] 杨建刚,陈继正,钱仲,等. 中西医结合治疗老年肿瘤化疗患者消化道毒副反应的疗效观察[J]. 现代肿瘤医学,2018,26(1):94-98.
[7] 张天博,张培彤. 癌痛中医外治法研究进展[J]. 长春中医药大学学报,2016,32(2):430-433.
[8] 鲁玲玲,孙亚波,马亚丽,等. 中药硬膏止痛方治疗癌症轻、中度疼痛80例观察[J]. 中医临床研究,2014,6(29):70-71.
[9] 申维玺,孙燕,张叔人. 肺癌细胞IL-1β、IL-6、TNFα、IFN-γ与肺癌阴虚证相关的免疫组化研究[J]. 中国中医基础医学杂志,2000,(12):28-31.
[10] 游恩丽,周于然,余守洋,等. 氯胺酮鞘内给药对神经病理性痛大鼠脊髓背角小胶质细胞活化、TNF-α和IL-1β产生的影响[J]. 神经解剖学杂志,2017,33(4): 459-463.
[11] 胡夕春,王杰军,常建华,等. 癌症疼痛诊疗上海专家共识(2017年版)[J]. 中国癌症杂志,2017,27(4):312-320.
[12] 华宇,钟宁,王海琴,等. 蟾乌凝胶膏穴位贴敷配合五音疗法缓解癌性疼痛的临床研究[J]. 上海针灸杂志,2015,34(11):1053-1055.
[13] 余慧青,冯道春,田玲,等. 硬膜外注射与鞘内注射吗啡治疗老年晚期癌症重度癌性疼痛的临床疗效及对生活质量评分的影响[J]. 中国老年学志,2017,37(24):6122-6125.
[14] 李春蕊,张雯,樊碧发. 数字评分法(NRS)与口述评分法(VRS)在老年慢性疼痛患者中的比较[J]. 中国疼痛医学杂志,2016,22(9):683-686.
[15] 刘红,蒋远静,刘水霞. 癌痛规范化治疗提高中重度癌痛患者生活质量的临床及护理分析[J]. 第三军医大学学报,2018,40(10):934-938.
[16] 颜芳,黄成成,路富民,等. 癌痛的分子机理研究进展[J].生物技术通讯,2016,27(5):711-715.
[17] 李鹏涛,肖智. 癌性疼痛相关离子通道的研究进展[J]. 医学研究生学报,2018,31(7):756-761.
[18] 郑儒君,陈林,李俊英. 我国肿瘤疼痛病人心理治疗联合WHO三阶梯药物疗法效果的系统评价[J]. 循证护理,2015,1(1):7-11.
[19] 晓芬. 周维顺中医辨证治疗癌痛经验[J]. 中醫药临床杂志,2014,26(10):1002-1003.
[20] 程尧,奚胜艳,王彦晖,等. 癌性疼痛的中医再认识及临证用药规律探析[J]. 中华中医药杂志,2015,30(11):3960-3964.
[21] 陈皎皎,胡陵静,彭爽,等. 中药内服联合中医综合外治疗法在癌性疼痛中的应用[J]. 中国中医急症,2018, 27(7):1219-1221.
[22] 喻明,王华伟,王文萍,等. 中药止痛贴联合吗啡治疗中重度癌痛的多中心临床研究[J].中国新药与临床杂志,2015,34(8):617-621.
[23] 王丽娅,高坡,周晔. 趋化因子CCL2对骨癌痛大鼠痛行为的影响及其外周机制[J]. 上海交通大学学报(医学版),2019,39(5):463-468.
[24] 代丽萍,高慧敏,王智民,等. 蟾皮化学成分的分离与结构鉴定[J]. 药学学报,2007,42(8):858-861.
[25] 罗建江,李向林. 干蟾皮醇提物对A549和NCI-H460肺癌细胞活性的影响[J]. 上海中医药大学学报,2016,30(4):57-60.
[26] 廖焕兰,陈富,罗福东,等. 大腹皮水煎剂对结肠术后肠吻合组织的修复作用[J]. 临床医学工程,2015,22(1):20-22.
[27] 张晶,胡泽成,陈忠东. 大黄素抑制小鼠移植宫颈癌生长及其机制[J]. 细胞与分子免疫学杂志,2015,31(3):350-354.
[28] 以敏,徐君毅,郝二伟,等. 桃仁提取物抗血瘀证大鼠血栓形成的机制[J]. 中国实验方剂学杂志,2016,22(1):125-128.
(收稿日期:2019-07-16)

