人单核细胞和外周血单个核细胞衍生的巨噬细胞极化特性的比较
刘晔 洪润丹 王志国 刘涵云 孟琛达 王茹 徐全臣
1.青岛大学附属医院口腔内科 青岛 266003;2.青岛大学口腔医学院 青岛 266003;3.青岛大学附属医院美容整形科 青岛 266003;4.青岛大学附属医院感染性疾病科 青岛 266003
20世纪90年代,巨噬细胞(macrophages,Mφ)极化是指在极化刺激因子脂多糖(lipopolysaccharides,LPS)和干扰素-γ(interferon-γ,IFN-γ)组合诱导下,生成经典活化的M1型Mφ,即M1 Mφ[1]。后来发现,IFN-γ刺激的Mφ还能被辅助型T细胞2(T helper 2 cell,Th2)分泌的Th2型细胞因子白细胞介素(interleukin,IL)-4和IL-13所抑制,而Th2型细胞因子刺激的Mφ被命名为替代活化型Mφ,即M2 Mφ[2]。M1 Mφ可产生促炎细胞因子并诱导Th1型免疫反应;而M2 Mφ主要分泌抑制性细胞因子并介导免疫调节,清除凋亡细胞和碎片,参与组织修复[3-4]。目前,Mφ的极化状态在机体免疫反应中起着关键作用,调节炎症的发生和消退,参与获得性免疫反应,影响组织的修复进程,是当前生物治疗研究热点[5]。
外周血单个核细胞(peripheral blood mononuclear cell,PBMC)衍生的Mφ(PBMC Mφ)和人单核细胞株THP-1衍生的Mφ(THP-1 Mφ)在极化研究中常被用作体外细胞模型[6-7]。PBMC直接来源于机体组织,更能反映体内状态;然而该细胞存在提取效率低,无增殖能力,无法冻存,体外培养需要加入生长因子维持性状,供体间差异较大等诸多问题,其应用较为受限[8]。为克服这些缺点,学者们使用THP-1建立Mφ的研究模型。THP-1是人单核细胞系,易于获取,操作简便,纯度高,遗传背景相同且能无限传代,使用较为广泛[9]。但是有研究[10]指出,不同来源的Mφ在不同分化状态下的表型属性存在差异,会影响实验结果。本实验在建立PBMC体外分离和培养模型的同时,比较了THP-1 Mφ和PBMC Mφ的极化特性,为THP-1替代原代PBMC的应用提供依据。
1 材料和方法
1.1 主要试剂
RPMI 1640培养基(Hyclone公司,美国),胎牛血清(fetal bovine serum,FBS;BI公司,以色列),Trizol、逆转录试剂盒、SYBR Premix Ex Taq(Takara公司,日本),佛波酯(phorbol 12-myristate 13-acetate,PMA;Mce公司,美国),LPS(Sigma公司,美国),人重组IFN-γ(human recombinant IFN-γ,rhIFN-γ)、人重组IL-4(human recombinant IL-4,rhIL-4)(PeproTech公司,美国),人重组巨噬细胞集落刺激因子(human recombinant macrophage colony-stimulating factor,rhM-CSF)、淋巴细胞分离液Ficoll(北京索莱宝科技有限公司),CD14免疫磁珠分选试剂盒和磁极、流式抗体抗人CD86-PE和CD206-PE(Biolegend公司,美国)。
1.2 原代PBMC的分离和培养
在征得供体知情同意的条件(伦理学批号:QYFYWZLL25653)下,采集健康人新鲜外周血20 mL置于抗凝管中,并用生理盐水按体积比1:1稀释。
吸取淋巴细胞分离液Ficoll置于离心管内,将相同体积的稀释血液沿管壁缓慢叠加于分层液面上,注意保持界面清楚。在室温下以2 000 r·min-1水平离心20 min,液体可分为3层。在上层和中层间的界面处有一个以单个核细胞为主的白色云雾层狭窄带(图1)。将吸管插到云雾层,小心吸取细胞置于离心管中,并且加入5倍体积无血清RPMI 1640培养基混匀。1 500 r·min-1离心10 min后吸弃上清液,洗涤2次。随后用3 mL含10% FBS的RPMI 1640培养基将底部沉淀混匀,过滤细胞悬液并计数。根据试剂盒说明,应用免疫磁珠法分选CD14+PBMC。
洗脱的细胞使用含10% FBS以及40 ng·mL-1rhM-CSF的RPMI 1640培养基调整细胞密度,密度达到每毫升3×106个细胞后接种于6孔板,置于5%CO2、37 ℃条件下孵育7 d,获得贴壁的细胞即为PBMC Mφ。通过倒置相差显微镜(Nikon公司,日本)观察细胞形态。

图 1 密度梯度离心法中液体分为3层Fig 1 Liquid was divided into three layers in density gradient centrifugation
1.3 单核细胞株的培养
人单核细胞系THP-1购自上海中乔新舟生物有限公司,并培养在含10% FBS和1%双抗的RPMI 1640培养基中。THP-1为悬浮细胞,生长速度较快,细胞密度一般控制在每毫升0.8×106~1.0×106个,每2~3 d传代1次。收集生长状态良好的THP-1进行实验,将细胞以每孔0.5×106个细胞的密度接种于6孔板,用含10% FBS和100 nmol·L-1PMA的RPMI 1640培养基孵育24 h分化成初始巨噬细胞(M0 Mφ)。随后用新鲜培养基替换,静置24 h,置于显微镜下观察细胞形态。
1.4 极化模型的建立
取两种来源的静息状态下的Mφ,用LPS(50 ng·mL-1)和IFN-γ(20 ng·mL-1)进行刺激,使其向M1型极化;另外再取两种Mφ,使用IL-4(20 ng·mL-1)进行刺激,使其向M2型极化;以未加任何刺激因子的细胞作为对照,所有细胞孵育24 h后进行检测。
1.5 实时定量聚合酶链式反应检测细胞因子mRNA的表达
采用实时定量聚合酶链式反应(quantitative real time-polymerase chain reaction,qRT-PCR)法检测各组细胞因子mRNA的表达情况,包括表征M1型分化标志的IL-1β和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α),以及表征M2型分化标志的甘露糖受体C1样蛋白(mannose receptor C-type 1,MRC1)和IL-10。
收集上述6组细胞,冰磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤2次,使用Trizol法提取细胞总RNA,并逆转录成cDNA。本研究所用的PCR引物序列见表1,均由上海生工生物工程股份有限公司合成。使用LightCycler 480 qRT-PCR仪进行扩增反应。扩增程序如下:95 ℃ 30 s预变性;95 ℃ 5 s变性,60 ℃ 30 s退火和延伸,共40个循环。反应结束后,检查融解曲线以确定PCR产物的特异性。使用比较Ct值法(2-ΔΔCt)计算相对mRNA水平,管家基因甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)的平均值作为参考对结果进行校正。

表 1 qRT-PCR检测基因的引物序列Tab 1 Primer sequences of qRT-PCR analysis
1.6 流式细胞术
CD86、CD206是已被广泛接受的Mφ极化标记[11],本研究采用流式细胞术检测CD86、CD206的表达。消化并收集两种来源的细胞,分别经LPS+IFN-γ和IL-4刺激后形成M1、M2型极化细胞,密度为每毫升不少于106个,PBS洗涤2次后,根据操作说明,分别加入流式抗体CD86-PE、CD206-PE,以相应单克隆抗体作同型对照,4 ℃避光孵育30 min,洗涤3次后重悬于PBS中,用流式细胞仪检测,使用FlowJo软件分析数据。
1.7 酶联免疫吸附实验
收集经LPS+IFN-γ和IL-4刺激后形成的各组细胞培养上清液,使用酶联免疫吸附实验(enzyme linked immunosorbent assay,ELISA)试剂盒(深圳达科为生物技术股份有限公司)严格按照操检测各组细胞IL-6、TNF-α和IL-1β的表达情况。
1.8 统计学分析
每组至少进行3次独立实验,数据结果使用Prism 6.0软件进行统计分析并作图,两样本比较采用独立样本t检验,检验水准为双侧α=0.05。
2 结果
2.1 形态学观察

图 2 两种来源Mφ的形态学变化 倒置显微镜Fig 2 Morphological changes of Mφ from two cells sources inverted microscope
倒置显微镜下观察可见,两种来源的细胞在静息状态下均黏附牢固,形态相似,呈圆形,散在分布(图2A、B)。PBMC在rhM-CSF诱导下分化培养7 d后,细胞多数为椭圆形,呈“煎蛋状”,少数呈长梭形(图2C)。THP-1在PMA诱导24 h后分化成包含圆形和纺锤形细胞的异质细胞群,细胞体积增大,伪足伸展明显(图2D)。继续向静息状态下的Mφ加入极化刺激因子后,细胞形态更为多样(图2E、F)。
2.2 qRT-PCR结果
使用qRT-PCR测定两种来源Mφ极化标记基因的相对表达量,结果见图3。
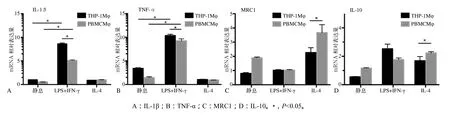
图 3 两种来源Mφ极化后细胞因子mRNA的相对表达量Fig 3 Relative expression level of cytokine mRNA after Mφ polarization from two resources of cells
与静息状态细胞相比,Mφ在接受LPS+IFN-γ刺激后,M1型相关标志基因(TNF-α、IL-1β)的表达水平显著上调(P<0.05,图3A、B)。THP-1 Mφ的IL-1β、TNF-α mRNA的相对表达量分别为8.72±1.58、10.39±1.58,高于PBMC Mφ的相对表达量(5.14±2.08、9.54±2.31),差异有统计学意义(P<0.05)。Mφ在接受IL-4刺激后,M2型相关标志基因(MRC1和IL-10)的相对表达量也明显高于对照组(P<0.05,图3C、D)。THP-1 Mφ的MRC1和IL-10 mRNA的相对表达量分别为2.32±0.32和1.74±0.33,均低于PBMC Mφ的相对表达量(3.73±0.51和2.26±0.15);其中MRC1 mRNA表达水平响应LPS+IFN-γ的极化反应较弱,但在IL-4刺激后出现高表达(P<0.05,图3C)。上述结果说明,LPS+IFN-γ可以成功诱导两种来源细胞的M1型极化反应,IL-4可以诱导M2型极化反应,THP-1对M1型极化的刺激更为敏感。
2.3 流式细胞术结果
流式细胞术检测及量化结果显示:THP-1 Mφ接受LPS+IFN-γ刺激后,M1型标记物CD86较静息状态下表达显著升高,PBMC Mφ有相似的趋势(P<0.05,图4上);PBMC Mφ接受IL-4的诱导后,M2型标记物CD206的表达明显增强(P<0.05),但THP-1 Mφ中CD206的表达则没有明显差异(P>0.05,图4下)。上述结果说明,LPS+IFN-γ可以诱导Mφ向M1方向极化,IL-4可以诱导Mφ向M2方向极化,CD206对THP-1的M2极化反应没有特异性表达。
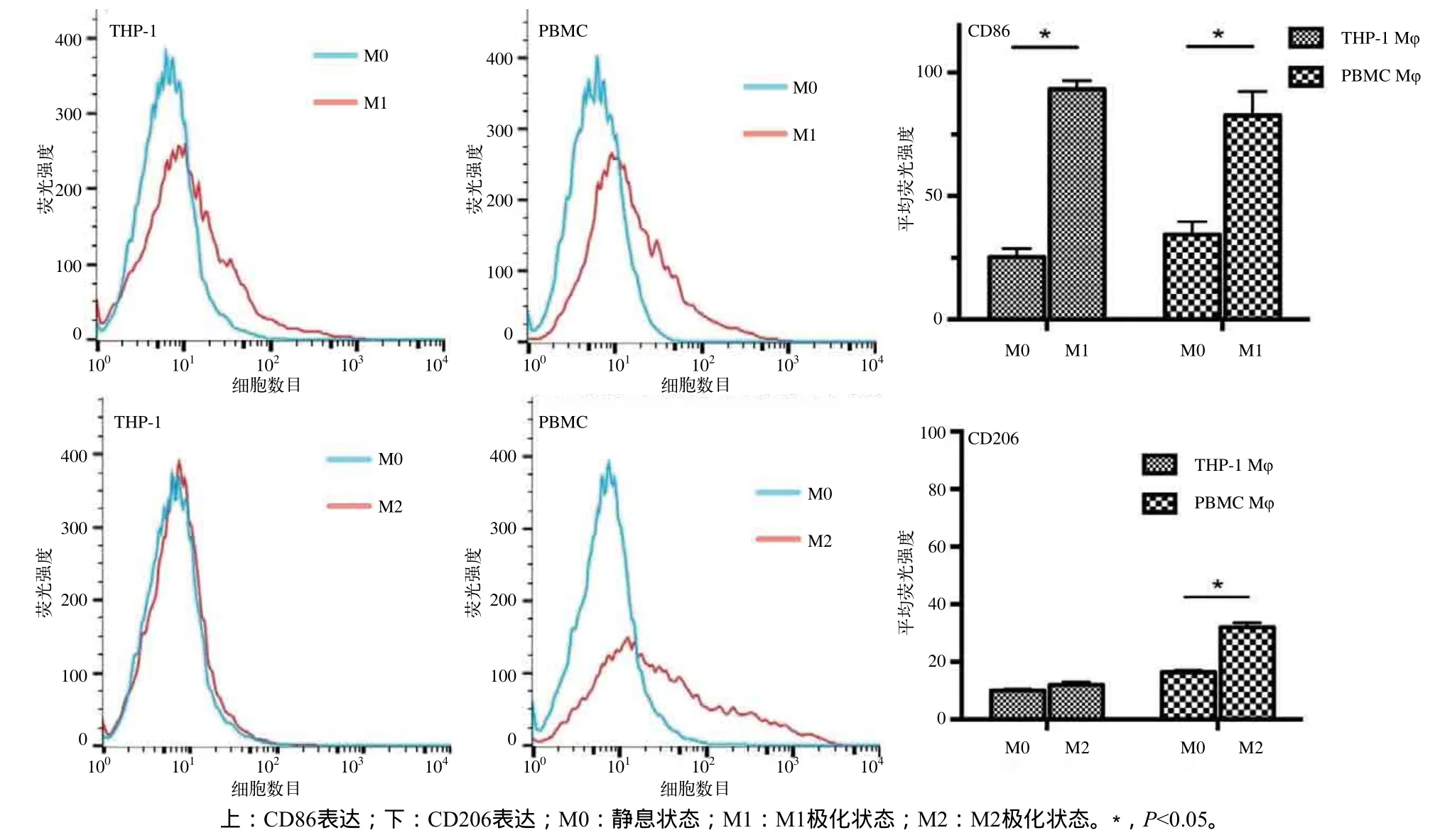
图 4 Mφ极化标记物CD86和CD206的表达Fig 4 The expression of polarization markers CD86 and CD206 from Mφ
2.4 ELISA结果
细胞培养上清液的ELISA检测结果见表2。两种来源细胞经LPS+IFN-γ刺激后分泌的细胞因子水平存在差异:IL-1β、TNF-α在THP-1 Mφ中表达更强,高于PBMC Mφ(P<0.05);相反,IL-6在PBMC Mφ中的表达较THP-1 Mφ更明显(P<0.05)。两种来源细胞经IL-4刺激后分泌的细胞因子水平的差异无统计学意义(P>0.05)。

表 2 两种来源Mφ上清液中细胞因子的表达量Tab 2 The expression levels of cytokines in Mφ supernatant from two resources of cells pg·mL-1
3 讨论
单核细胞在骨髓中产生,进入血液循环并外渗后分化为Mφ,后者在协调损伤反应中起着重要作用[12]。人白血病来源的单核细胞系THP-1克服了使用原代Mφ的限制,已在研究中广泛使用[9]。THP-1衍生的Mφ与原代人Mφ有非常相似的表型和功能特征[13],但不能简单地假设两者必然相等。因此,本研究比较了两种细胞在静息和活化状态下的基因表达、表面标志物以及细胞因子分泌等特征。
本实验结合笔者经验和先前的研究[14]为THP-1和PBMC选择了合适的培养和诱导方案。采集健康人新鲜循环外周血提取PBMC,使用免疫磁珠法捕获CD14+单核细胞。CD14是细胞表面的糖蛋白,被认为是单核巨噬细胞系统特征性的表面标记物[15]。免疫磁珠是一种细胞分选技术,可以将培养物进一步分化成高纯度的巨噬细胞,为后续实验奠定基础[16]。PMA是从THP-1获得与PBMC Mφ相似巨噬细胞的最有效的激活剂[17]。根据文献[14]报道,PMA诱导THP-1分化的最佳方案是:细胞在100 nmol·L-1的PMA诱导下孵育24 h,然后在没有PMA的培养液中静置至少24 h,以减少分化期间上调的核因子-κB表达。通过上述方法获得的两组细胞紧紧黏附在培养板内,不易被0.25%的胰酶消化,符合Mφ贴壁牢固的特点。通过倒置显微镜观察到,初始状态的两种Mφ形态相似,均为散在分布。不同极化条件下的Mφ由不同形状的细胞异质群组成。纺锤形或伪足伸展明显的Mφ被认为具有促炎性质,而圆形或触角圆钝的Mφ被认为具有抗炎特性。
本研究结果显示:在接受LPS+IFN-γ刺激时,表征M1型标志的IL-1β、TNF-α mRNA相对表达量显著增加,而接受IL-4刺激时IL-1β、TNF-α mRNA的相对表达量无明显变化,两种Mφ的极化反应相似;表征M2型标志的MRC1、IL-10 mRNA相对表达量在接受IL-4刺激时表达增强,且THP-1 Mφ的相对表达量较PBMC Mφ要低。两种Mφ的表面标志物在极化过程中也存在明显差异:表征M1型标志的表面分子CD86在两种Mφ接受M1极化因子刺激后同时增强;而表征M2型标志的CD206,接受M2极化因子刺激后仅在PBMC Mφ极化反应时变化明显。上述结果说明,M1型标志物的表达在两种Mφ极化反应之间是相似的,但是部分M2型标志物仅在PBMC Mφ的极化反应中有表达。分析两种Mφ培养上清液可以发现,在M1极化因子的刺激下,两种来源Mφ分泌的细胞因子水平明显提高,并且IL-1β、TNF-α在THP-1 Mφ中表达更强,而IL-6在PBMC Mφ中表达更强。
由本研究结果可以看出,THP-1 Mφ确实与PBMC Mφ有相似的极化表达,但THP-1 Mφ对M2表型的极化能力有限,并不能完全替代原代细胞。THP-1可能更适合进行M1极化的研究,而PBMC更适合进行M2极化的研究。当在Mφ极化模型中使用THP-1和PBMC时,需要考虑这些差异。造成这种差异的原因可能与THP-1和PBMC的生物学差异有关,例如基因表达程度和细胞因子分泌程度的差异等[18]。与THP-1相比,PBMC与组织来源的巨噬细胞可以在肥胖、慢性炎症疾病等不同的疾病中处于不同极化状态,能够产生不同的表型,从而发挥不同的促炎和抗炎作用[19]。
综上所述,人类的健康与免疫功能密切相关,而免疫功能受多种因素影响。体外细胞系的应用能够最大限度地减少培养期和遗传变异的影响、伦理问题的限制,以及供者的可获得性,在研究方面具有一定意义;但在研究中应注意,体内细胞是以交互作用的网络形式而存在,而体外共培养系统中缺乏这种交互作用,因此应明确不同细胞在不同状态下的功能及表达,以进一步模拟体内情况。

