稻草秸秆的酶解糖化及发酵生产衣康酸
刘 兰,倪 赛,任雨萍,由维清,印培民*
(1.江西省科学院微生物研究所,江西 南昌 330000;2.江西科院生物新材料有限公司,江西 南昌 330000)
我国每年产生大量的农林废弃物,一般被焚烧、填埋或作为堆肥使用,不仅浪费资源还污染环境[1]。如何有效资源化废弃物对资源利用和产业升级具有重要意义[2-3]。秸秆是我国主要的农林废弃物,经降解可转化为糖类(纤维素和半纤维素),进而转化为可被微生物利用的还原糖,用于生产各种化工产品和燃料,可解决粮食资源短缺的问题[4]。
衣康酸(itaconic acid)是第五大有机酸(前4位依次为:柠檬酸、葡萄糖酸、乳酸和苹果酸)[5]。衣康酸发酵的最适碳源是葡萄糖,其价格较淀粉等碳源要高,无法满足实际工业生产;但由于衣康酸发酵菌株缺乏能够水解糖类的酶或其酶活很低,无法直接有效利用淀粉等大分子糖类,而需要经过预处理将其转化为可被衣康酸发酵菌株利用的小分子糖类(如葡萄糖),这无疑会增加生产成本。因此,寻求非粮可再生原料生产衣康酸是降低生产成本的有效策略。1978年,Kobayashi等研究发现木材废弃物经水解后,其水解液可被利用生产衣康酸。Saha等[6]研究发现,部分土曲霉能够利用木糖等五碳糖生产衣康酸,为充分利用木质纤维素原料水解糖类奠定了基础。Saha等[7]用稀酸预处理小麦秸秆,经酶解获得酶解液,将酶解液稀释1 000倍并额外添加葡萄糖后,利用土曲霉发酵生产衣康酸的产量约为正常发酵的一半。Jimenez-Quero等[8]将麦麸和玉米芯进行水解得到水解液,发现两种土曲霉无法在稀释10倍的水解液中发酵生产衣康酸。Pedroso等[9]将米糠经磷酸预处理及脱毒处理后,利用土曲霉发酵生产衣康酸的产量为1.9 g·L-1。Krull等[10]将小麦壳进行NaOH溶液预处理后制得水解液,利用土曲霉发酵生产衣康酸的产量为0.6 g·L-1;水解液经蛋白质变性和离子交换树脂脱毒后,衣康酸产量提高到27.7 g·L-1。
作者以稻草秸秆酶解糖化液为原料,利用土曲霉KY-013发酵生产衣康酸;研究超微粉碎、高温蒸煮、稀硫酸和NaOH溶液等预处理方式对稻草秸秆酶解糖化的影响,并分析预处理前后及酶解后稻草秸秆中组分含量的变化,旨在充分利用秸秆资源,降低生产成本,为农业废弃物纤维素资源的开发利用开辟可行的途径。
1 实验
1.1 材料与仪器
稻草秸秆,取自江西省农业科学院水稻试验田;纤维素酶(酶活力为494.6 IU·g-1)、土曲霉(Aspergillusterreus)KY-013均由江西科院生物新材料有限公司提供。
UV-6000PC型紫外可见分光光度计,上海元析仪器有限公司;HPLC-20AD型液相色谱仪、TOSOh TSKgel-OApakP+Oapak A型分析柱(7.8 mm×300 mm)、RID-10A型示差检测器,日本岛津公司;MKCA6-2J型超微粉碎机,MASUKO SANGYO;PC350×500型锤式粉碎机,郑州恒星重型设备有限公司;TY36型小型盘式粉碎机,山东济宁曲阜天阳机械制造有限公司。
1.2 培养基
斜面培养基(g·L-1):葡萄糖20、玉米浆干粉8.0、NaCl 20、琼脂15。
种子培养基(g·L-1):葡萄糖55.5、玉米浆干粉1.2、NH4NO35.0、MgSO4·7H2O 2.0、pH值3.0。
发酵培养基(g·L-1):稻草秸秆水解液、葡萄糖、木糖、NH4NO33、MgSO4·7H2O 1.8、玉米浆干粉 0.48、KH2PO40.05、ZnSO40.02、pH值3.0。
1.3 稻草秸秆粉的制备
将自然风干的稻草秸秆切成1~2 cm小段,用自来水冲洗干净,室内风干后,105 ℃下干燥2 h,储于干燥器中;取1 kg干燥稻草秸秆依次经锤式粉碎机和盘式粉碎机粉碎后,过60目筛,即得稻草秸秆粉。
1.4 稻草秸秆预处理方式的筛选
1.4.1 超微粉碎预处理
称取100 g稻草秸秆粉置于2 000 mL锥形瓶中,加入1.9 kg水,混匀后得到稻草混合液。将超微粉碎机调零并设置参数为500 μm,将稻草混合液加入磨机,并不断调小磨机间距,使得稻草混合液依次通过每个节点(500 μm、300 μm、250 μm、200 μm、150 μm、100 μm),然后分别在粒径为10 μm、20 μm、30 μm、40 μm、50 μm、60 μm条件下通过10次,抽滤分离,60 ℃干燥至恒重,置于干燥器中,备用。以无处理作为空白对照。
1.4.2 高温蒸煮预处理
称取10 g稻草秸秆粉置于500 mL锥形瓶中,加入190 g水,分别经120 ℃、160 ℃、180 ℃蒸煮处理1 h,抽滤分离,60 ℃干燥至恒重,置于干燥器中,备用。以无处理作为空白对照。
1.4.3 稀硫酸预处理
称取10 g稻草秸秆粉置于250 mL锥形瓶中,按固液比1∶10(g∶mL)分别加入质量分数为1%、5%、10%、15%、20%和25%的稀硫酸,置于恒温摇床中,于60 ℃、200 r·min-1振荡处理24 h,抽滤分离,用蒸馏水洗涤至中性,60 ℃干燥至恒重,置于干燥器中,备用。以蒸馏水处理作为空白对照。
1.4.4 NaOH溶液预处理
称取10 g稻草秸秆粉置于250 mL锥形瓶中,按固液比1∶7.5(g∶mL)分别加入质量分数为0.5%、1.0%、1.5%、2.0%、3.0%、4.0%和5.0%的NaOH溶液,置于恒温摇床中,于30 ℃、200 r·min-1振荡处理24 h,抽滤分离,用蒸馏水洗涤至中性,60 ℃干燥至恒重,置于干燥器中,备用。以蒸馏水处理作为空白对照。
1.5 稻草秸秆的酶解糖化
准确称取2.5 g预处理后的稻草秸秆粉置于250 mL锥形瓶中,按固液比1∶20(g∶mL)加入pH值为4.8的柠檬酸缓冲液,然后加入一定量纤维素酶溶液,于50 ℃、200 r·min-1酶解48 h,以蒸馏水处理作为空白对照。每24 h取样测定酶解液中还原糖和总糖的含量,按式(1)计算还原糖转化率。
(1)
式中:A为酶解液中还原糖含量;B为预处理后的稻草秸秆粉质量;C为预处理前稻草秸秆粉质量;D为预处理前稻草秸秆粉中总糖含量。
采用DNS法[11]测定酶解液中还原糖含量,采用硫酸-苯酚法[12]测定酶解液中总糖含量,采用Van Soest法[13]测定NaOH溶液预处理前后以及酶解后稻草秸秆中纤维素、半纤维素和木质素的含量。
1.6 发酵生产衣康酸
参照文献[14]进行。将安瓿管保藏的土曲霉KY-013菌种接种至斜面培养基中,30 ℃恒温培养4 d后,置于4 ℃冰箱中保存,备用;用无菌水洗下斜面孢子,稀释,使菌悬液孢子浓度为4.55×107个·mL-1;按10%接种量接种于100 mL种子培养基中,于30 ℃、220 r·min-1振荡培养48 h;将培养好的种子液按10%接种量接种至40 mL发酵培养基中,于37 ℃、280 r·min-1振荡培养6 d,即得衣康酸。
糖酸转化率的测定:将发酵液经10 000 r·min-1离心10 min;取上清液,稀释,用0.22 μm聚醚水性滤膜过滤,进行HPLC分析(检测器为RID-10A型示差检测器,流动相为0.75 mmol·L-1H2SO4,流速1.0 mL·min-1,柱温45 ℃,进样量10 μL),测定发酵液中衣康酸和残糖含量,按式(2)计算糖酸转化率。

(2)
2 结果与讨论
2.1 超微粉碎预处理对稻草秸秆酶解糖化的影响(图1)
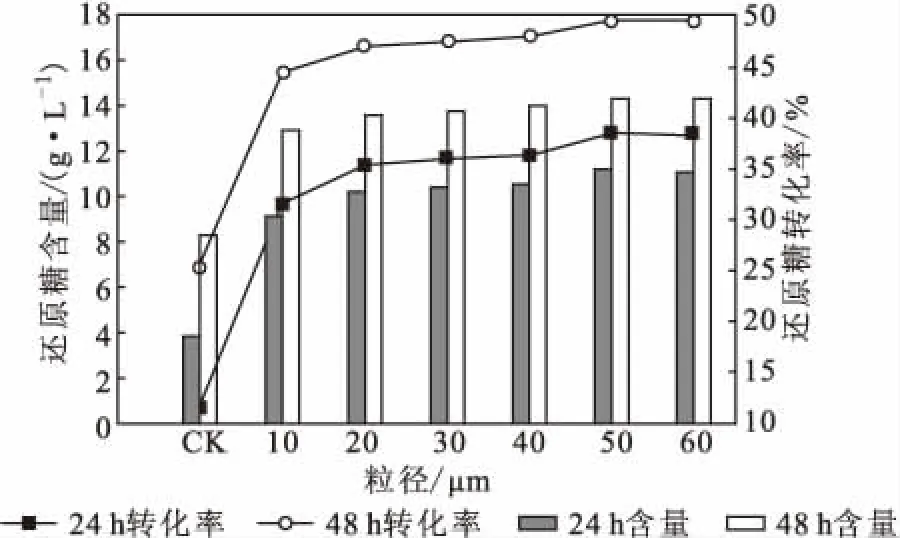
图1 超微粉碎预处理对稻草秸秆酶解糖化的影响Fig.1 Effect of superfine pulverization pretreatment on enzymatic saccharification of rice straw
从图1可知,稻草秸秆经超微粉碎预处理后进行纤维素酶酶解,粒径10~60 μm的稻草秸秆酶解24 h的还原糖转化率为31.50%~38.24%,酶解48 h的还原糖转化率为44.40%~49.50%;酶解48 h的还原糖转化率普遍高于酶解24 h的。因此,超微粉碎预处理的最优方式为锤式粉碎机、盘式粉碎机依次粉碎,得到50 μm粒径的稻草秸秆酶解48 h的还原糖转化率最高,为49.50%。实验发现,50 μm和60 μm粒径的稻草秸秆与纤维素酶的接触面积最大,其纤维素的结晶度最低,在一定程度上提高了还原糖转化率,但稻草秸秆中木质素结构并未被有效破坏,木质素去除率仅2.6%。因此,超微粉碎预处理的酶解效率不够理想[15]。
2.2 高温蒸煮预处理对稻草秸秆酶解糖化的影响(图2)
从图2可知,稻草秸秆分别经120 ℃ 、160 ℃和180 ℃蒸煮预处理1 h后进行纤维素酶酶解,酶解24 h的还原糖转化率分别为48.06%、30.24%、29.16%,酶解48 h的还原糖转化率分别为52.14%、33.81%、32.16%;酶解48 h的还原糖转化率普遍高于酶解24

图2 高温蒸煮预处理对稻草秸秆酶解糖化的影响Fig.2 Effect of high temperature cooking pretreatment on enzymatic saccharification of rice straw
h的;120 ℃蒸煮预处理的酶解效果优于160 ℃和180 ℃。这是因为,高温高压会促使纤维素内部氢键断裂,其脱落的羟基会增强纤维素的吸附能力,半纤维素和木质素脱离纤维素的包裹,并进一步水解和转化,但温度过高会一定程度破坏纤维素和半纤维素的结构,导致酶解效率降低,进而影响还原糖转化率。因此,高温蒸煮预处理的最优方式为120 ℃处理1 h,得到的稻草秸秆酶解48 h的还原糖转化率最高,为52.14%。但高温高压不能改变木质素结构、有效去除木质素、降低纤维素结晶度,因此,其应用在一定程度上受到限制[16]。荆磊等[17]研究发现,稻草秸秆经160 ℃自水解预处理,在混合酶用量为40 FPU·g-1时,葡聚糖和木聚糖的总转化率分别约为68%和45%,总糖转化率近60%。
2.3 稀硫酸预处理对稻草秸秆酶解糖化的影响(图3)

图3 稀硫酸预处理对稻草秸秆酶解糖化的影响Fig.3 Effect of dilute sulfuric acid pretreatment on enzymatic saccharification of rice straw
从图3可知,稻草秸秆分别经1%、5%、10%、15%、20%、25%的稀硫酸预处理后进行纤维素酶酶解,随着稀硫酸质量分数的增加,还原糖转化率总体呈降低的趋势;在稀硫酸质量分数为1%时,酶解48 h的还原糖转化率达到最高,为37.69%。这是因为,1%稀硫酸能明显降低纤维素的平均聚合度、改变木质素的结构、增强反应能力、最大程度提高酶解效率。因此,稀硫酸预处理的最优方式为1%稀硫酸预处理稻草秸秆,酶解48 h的还原糖转化率为37.69%。但稀硫酸在处理过程中会产生多种抑制发酵的产物[15],并且稀硫酸预处理对木质素的去除率较低,只有16.67%。孙万里等[18]曾报道,经酸预处理的稻草秸秆酶解的纤维素转化率为43.4%、葡萄糖含量为24.1 g·L-1;经酸碱联合处理的稻草秸秆酶解的纤维素转化率为60.6%、葡萄糖含量为47.7 g·L-1。
2.4 NaOH溶液预处理对稻草秸秆酶解糖化的影响
经检测,稻草秸秆中纤维素含量为34.8%、半纤维素含量为23.2%、木质素+灰分含量为18.38%。NaOH溶液预处理前后及酶解后,稻草秸秆中各组分含量变化如图4所示。
从图4可知,NaOH预处理后,纤维素含量增加15.66%;半纤维素损失率为10.05%;而木质素+灰分含量明显降低,残留量只有3.93%,损失率达到85.93%;酶解后残渣中木质素+灰分含量增加48.69%。有研究报道,NaOH溶液预处理对纤维素含量变化无影响,半纤维素与木质素的损失比较大。此外,NaOH溶液预处理过程中,由于木质素、半纤维素溶出较多,使得纤维素充分暴露,增大了稻草秸秆的比表面积,提高了酶解效率[15,19]。
NaOH溶液预处理对稻草秸秆酶解糖化的影响如图5所示。
从图5可知,随着NaOH质量分数的增加,还原糖转化率呈先升高后降低的趋势;在NaOH质量分数为1.5%时,酶解24 h和48 h的还原糖转化率均达到最高,分别为61.94%和82.51%。纤维素酶会不断将纤维素和半纤维素酶解成可利用还原糖,而木质纤维素的结构对纤维的结晶度、孔隙率及木质素的含量影响很大[20]。稻草秸秆经1.5%NaOH溶液预处理后,其稻草秸秆结构发生变化,木质素-碳水化合物复合体被破坏,使部分纤维素脱出,木质纤维素的内部结构更加疏松,酶对纤维素的可及度增加,此外稻草纤维的结晶度降低,稻草秸秆膨胀、孔隙率增加,且木质素被NaOH溶解后被溶出。因此,纤维素不断被酶解糖化成葡萄糖,半纤维素被酶解成木糖和阿拉伯糖。酶解后残渣中木质素含量较高,结晶度也较高,不仅可以用来提纯木质素用作工业原料,也可以将酶解残渣直接添加至聚乳酸中,制备新型生物可降解材料,实现木质纤维的全组分利用[21]。
综上,结合李辉勇等[22]的研究结果,确定稻草秸秆的最佳预处理方式为:按固液比1∶7.5(g∶mL)加入质量分数为1.5%的NaOH溶液,于30 ℃、200 r·min-1振荡处理24 h;结合沙如意等[12]的研究结果,确定最佳酶解工艺为:按固液比1∶20(g∶mL)加入pH值4.8的柠檬酸缓冲液,加入2.5 IU·g-1纤维素酶溶液,于50 ℃、200 r·min-1酶解48 h。
2.5 稻草秸秆酶解糖化液中还原糖的含量
稻草秸秆酶解糖化液的HPLC图谱如图6所示,稻草秸秆酶解糖化液中各还原糖的含量如图7所示。
经单糖定量分析可知,稻草秸秆酶解糖化液中的还原糖主要有D-纤维二糖(16.214 min)、乳糖(17.890 min)、葡萄糖(19.026 min)、木糖(20.285 min)、阿拉伯糖(22.748 min)。其中,葡萄糖含量最高,酶解24 h的含量为17.62 g·L-1、酶解48 h的含量为23.44 g·L-1;其次为乳糖、木糖、D-纤维二糖、阿拉伯糖。据报道,稻草秸秆中主要还原糖为阿拉伯聚糖、半乳聚糖、葡聚糖和木聚糖[17]。经纤维素酶酶解后,阿拉伯聚糖被分解为阿拉伯糖,葡聚糖被完全分解为葡萄糖、不完全分解为D-纤维二糖,木聚糖被完全分解为木糖,而酶解糖化液中乳糖由半乳聚糖不完全分解得到。稻草秸秆经1.5%NaOH溶液预处理后,半纤维素和木质素脱除,因此由半纤维素水解而成的木糖含量明显偏低,而纤维素更加高效水解为葡萄糖,因此还原糖中的葡萄糖含量最高。
2.6 利用稻草秸秆酶解糖化液发酵生产衣康酸
土曲霉KY-013利用NaOH溶液预处理后的稻草秸秆酶解糖化液发酵生产衣康酸的结果如表1所示。
从表1可知:
(1)稻草秸秆酶解糖化液中未额外添加葡萄糖和木糖时(1#~5#),随着酶解糖化液中葡萄糖和木糖浓度的增加,衣康酸的产量先升高后降低;在葡萄糖浓度为30 g·L-1、木糖浓度为3.5 g·L-1时,衣康酸产量达到最高,为9.78 g·L-1,糖酸转化率为20.77%。这是因为,酶解糖化液虽然在一定条件下能被土曲霉KY-013发酵生产衣康酸,但1.5%NaOH溶液预处理稻草秸秆酶解糖化液中含有抑制土曲霉KY-013发酵的物质,使得发酵利用受阻;高浓度的酶解糖化液中抑制物浓度较高,此时虽然葡萄糖和木糖浓度高,但不足以应对抑制物的抑制作用;而低浓度的酶解糖化液中抑制物浓度较低,土曲霉KY-013对酶解糖化液中葡萄糖和木糖的发酵利用作用强于抑制物的抑制作用,因此衣康酸产量相对升高;当酶解糖化液中葡萄糖和木糖浓度很低时,又无法满足土曲霉发酵对糖的需求,因此随着酶解糖化液浓度的降低,衣康酸产量先升高后降低。另外,随着酶解糖化液中葡萄糖和木糖浓度的增加,发酵液pH值逐渐减小、菌体干重逐渐升高、糖酸转化率逐渐降低。
表1利用稻草秸秆酶解糖化液发酵生产衣康酸的结果

Tab.1 Results of production of itaconic acid by fermentation of enzymatic saccharification liquid of rice straw
(2)稻草秸秆酶解糖化液中额外添加葡萄糖和木糖时(6#~11#),随着酶解糖化液中葡萄糖和木糖浓度的增加,衣康酸产量逐渐升高;在葡萄糖浓度为80 g·L-1、木糖浓度为40 g·L-1时,衣康酸产量达到最高,为53.88 g·L-1;随着酶解糖化液中葡萄糖和木糖浓度的增加,糖酸转化率逐渐升高、发酵液pH值逐渐减小、菌体干重逐渐下降。
表明,底物浓度直接影响微生物的生长和代谢,发酵过程中碳源浓度过高或过低均会不同程度影响菌株的生长[23]。
3 结论
以稻草秸秆生物转化制备衣康酸为目标,选择稻草秸秆酶解糖化液为原料,利用土曲霉KY-013发酵生产衣康酸。研究了超微粉碎、高温蒸煮、稀硫酸和NaOH溶液等预处理方式对稻草秸秆酶解糖化的影响,确定稻草秸秆的最佳预处理方式为:按固液比1∶7.5(g∶mL)加入质量分数为1.5%的NaOH溶液,于30 ℃、200 r·min-1振荡处理24 h;最佳酶解工艺为:按固液比1∶20(g∶mL)加入pH值4.8的柠檬酸缓冲液,加入2.5 IU·g-1纤维素酶溶液,于50 ℃、200 r·min-1酶解48 h。在此条件下,还原糖转化率达到最高,为82.51%。HPLC分析表明,酶解糖化液中还原糖成分为D-纤维二糖、乳糖、葡萄糖、木糖、阿拉伯糖。在不添加葡萄糖和木糖条件下,酶解糖化液中葡萄糖浓度为30 g·L-1、木糖浓度为3.5 g·L-1时,衣康酸产量达到最高,为9.78 g·L-1;随着添加葡萄糖和木糖浓度的增加,土曲霉KY-013对稻草秸秆糖化液的利用效率逐渐升高,衣康酸产量逐渐升高,最终达53.88 g·L-1。
本研究表明土曲霉KY-013能利用合适底物浓度的酶解糖化液发酵生产衣康酸,为衣康酸工业化生产原料找到非粮的替代品,也为生物发酵行业碳源的原料供应提供了新的途径。

