miR-378a-3p靶向PKM2基因对食管鳞癌细胞Eca-109凋亡及能量代谢的影响
阿依提拉·热合麦提江,屈 园,帕力旦·艾孜提,张法煌,朱世茂,胡慧玲,李 卉
(1新疆医科大学基础医学院生物化学教研室,乌鲁木齐 830011;2新疆医科大学公共卫生学院;3新疆医科大学中心实验室;#共同第一作者;*通讯作者,E-mail:huihui922@126.com)
食管癌是近年来常见的恶性消化道肿瘤之一,报道显示全球食管癌发病率和死亡率分别位列第8位和第6位[1]。虽然目前食管癌的诊断和治疗手段已有很大的改进,但多数食管癌患者发现时已到中晚期,错过了最佳的手术时机,5年生存率低于15%[2]。
肿瘤细胞区别于正常细胞,这是因为代谢方式的不同而引起的。肿瘤细胞里将近50%的ATP是通过糖酵解途径合成的,这种即使在氧气充足下,恶性肿瘤细胞依然通过糖酵解获取能量并产生乳酸的效应方式称为Warburg效应[3]。越来越多的研究发现,丙酮酸脱氢酶(PKM2)是糖酵解途径中重要的限速酶,PKM2在增殖的细胞,尤其在肿瘤细胞中高表达,且在Warburg效应和肿瘤发生、浸润转移中发挥重要作用[4,5]。
micro-RNA是一类微小的内源表达的单链非编码RNA[6],其长度在18-24个核苷酸左右,它通过与靶基因3′-UTR区互补配对,转录后对基因的表达进行调控,进而参与调控细胞的生长、分化等多个过程。近年来研究表明[7],mi-RNA在食管癌中的异常表达具有稳定性和特异性,可以作为食管癌诊断的分子标志物。miR-378定位于人染色体5q32,在2005年被证实在肿瘤细胞株中表达[8]。
癌症越来越被视为一种代谢相关疾病,肿瘤相关的能量调节已经作为肿瘤治疗的生化途径和药物靶点。在过去的几年里,分子和细胞研究明确地强调了癌基因和肿瘤抑制因子与癌症糖酵解的关系,而且研究[9]表明mi-RNA在介导这种代谢转变中发挥重要作用。
本实验通过研究miR-378a-3p与PKM2基因的关系及其对Eca-109细胞的作用,验证miR-378a-3p调控关系,探索miR-378a-3p是否能成为未来食管癌临床治疗的靶点。
1 材料与方法
1.1 材料与试剂
RMPI1640培养基(美国Hyclone公司)、胎牛血清(FBS)(美国Hyclone公司)、胰酶细胞消化液(美国Gibco公司)、Opti-MEM(美国Gibco公司)、SanPerp柱式质粒DNA小量抽提试剂盒(上海生工)、蛋白酶抑制剂、磷酸酶抑制剂(美国Thermo公司)、BSA蛋白检测试剂盒(美国Thermo公司)、Annexin Ⅴ-FITC细胞凋亡检测试剂盒(美国BD公司)、兔抗人PKM2抗体(美国Abcam公司)、ATP检测试剂盒(中国索莱宝公司)、Western blot显色试剂盒(Invitrogen公司,美国)。
1.2 研究方法
1.2.1 细胞培养、质粒转染 将食管癌细胞株Eca-109接种于含10%胎牛血清和含青霉素与链霉素双抗的RPMI1640培养基中,置于37 ℃、CO2体积分数为5%和湿度饱和的细胞培养箱中培养,每隔48 h换液一次,待细胞贴壁80%左右时按实验要求进行传代。将实验分为4组:①空白对照组;②阴性对照组;③miR-378a-3p转染24 h组;④miR-378a-3p转染48 h组。取对数生长期的Eca-109细胞进行电转染(转染条件:电压280 V,电阻550 Ω,电容900 CF),之后每孔加2 ml接种于6孔板中。贴壁后换液,在37 ℃、5% CO2条件下常规培养,24 h及48 h后收取细胞。
1.2.2 蛋白表达量检测实验 取转染24 h和48 h后的Eca-109细胞,裂解提取总蛋白。BCA法测定细胞裂解物的蛋白含量,取等量蛋白质以10% SDS-PAGE分离并转移至PVDF膜上,单克隆抗体4 ℃孵育过夜。PBST洗去一抗,二抗室温孵育2 h。洗涤,ECL试剂盒显色,凝胶成像系统采集成像。β-actin作为内参。成像结果通过ImageJ灰度分析软件读取灰度值,以PKM2/β-actin进行分析对比。
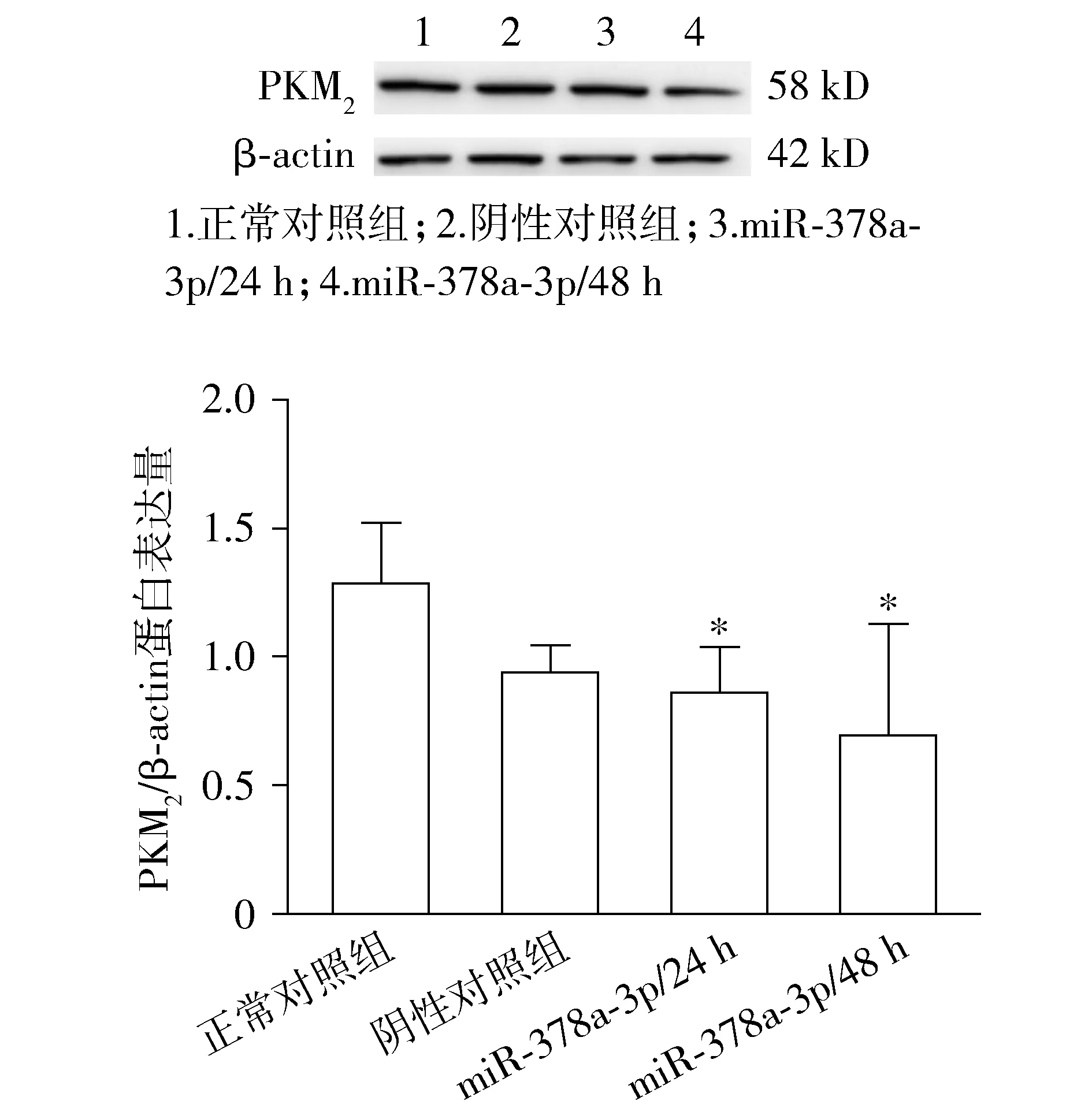
1.2.3 ATP含量检测实验 先收集细胞到离心管内,弃上清,按照细胞数量提取液体积(ml)为1 ∶500-1 ∶1 000的比例,超声波破碎1 min(冰浴,强度20%或200 W,超声2 s,停1 s),10 000g4 ℃离心3 min,取上清,置冰上测。把工作液与标准液充分混匀后,立即测定340 nm下10 s的吸光值A1,然后将比色皿连同反应液一起放入37 ℃水浴中反应3 min,拿出擦拭干净立即测定其在190 s时的吸光值A2。分别计算ΔA测定=A2测定管-A1测定管,ΔA标准=A2标准管-A1标准管。
ATP含量按如下公式计算(按细胞密度计算):
ATP含量(μmol/106cell)
=ΔA测定÷(ΔA标准÷C标准)×V提取÷5
=0.125×ΔA测定÷ΔA标准
其中,C标准管:标准浓度液,0.625 μmol/ml;V提取:加入的提取液体积,1 ml;5:细胞或细菌总数,5×106个。
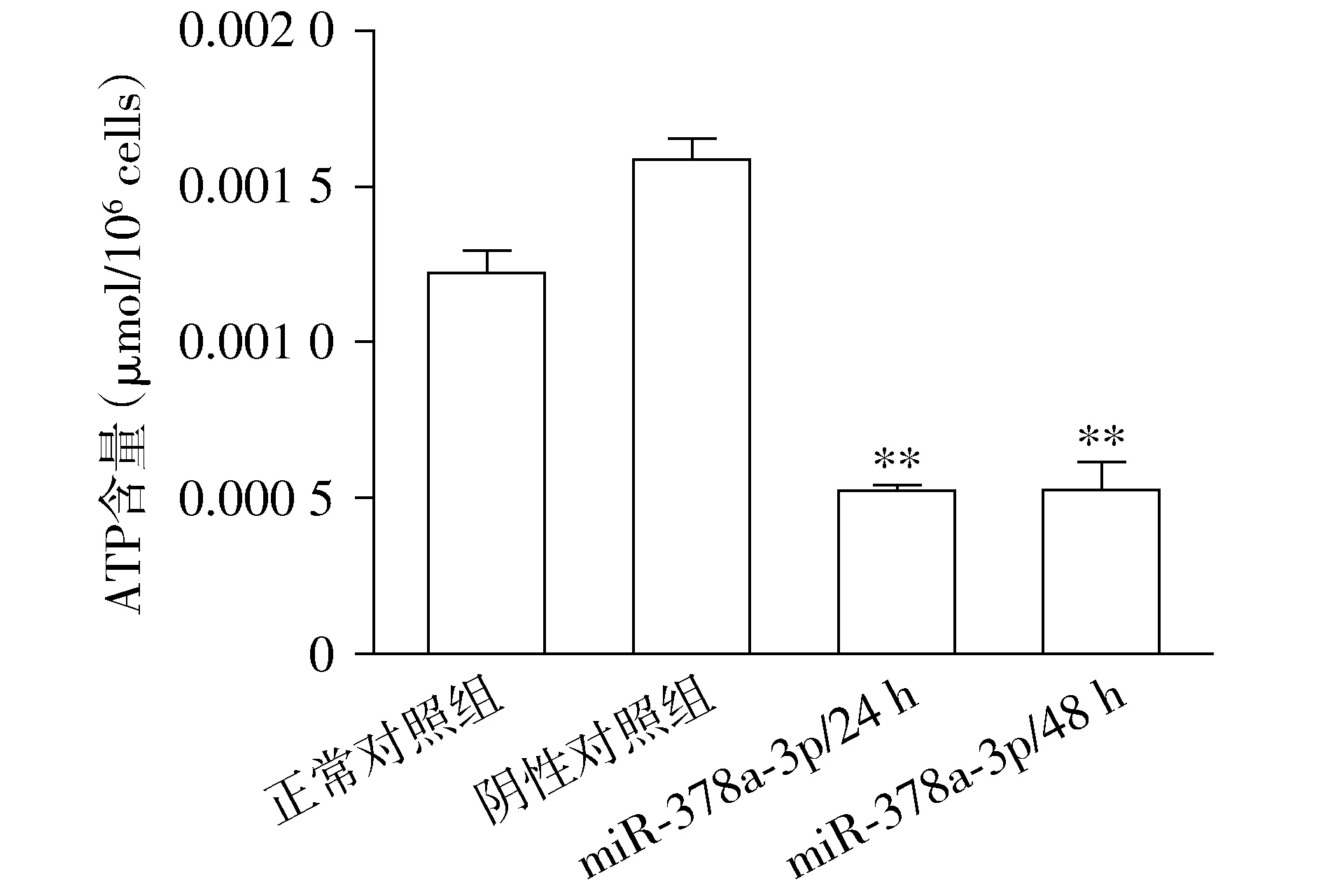
1.2.4 细胞凋亡实验 收集转染后24 h和48 h各组Eca-109细胞,消化和PBS洗涤后,加入200 μl结合缓冲液重悬细胞,经膜联蛋白-Ⅴ-异硫氰酸荧光素(Annexin Ⅴ-FITC)和碘化丙啶(PI)避光孵育15 min后,流式细胞仪检测各组细胞的凋亡率。其中,每组实验均重复3次。
1.3 统计学方法
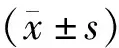
2 结果
2.1 miR-378a-3p对PKM2蛋白表达的影响
与空白对照组相比,阴性对照组PKM2相对蛋白水平无显著差异。与空白对照组和阴性对照组相比,miR-378a-3p转染后24 h及miR-378a-3p转染后48 h PKM2蛋白水平明显降低,差异有统计学意义(P<0.05,见图1),且miR-378a-3p转染后48 h较miR-378a-3p转染后24 h组下降趋势更明显。
2.2 miR-378a-3p表达对能量代谢的影响
与空白对照组相比,阴性对照组ATP产量略有增高,差异无统计学意义。与空白对照组和阴性对照组相比,miR-378a-3p转染后24 h及miR-378a-3p转染后48 h组ATP含量明显降低,差异有统计学意义(P<0.01,见图2)。
2.3 miR-378a-3p表达对食管癌细胞凋亡的影响
空白对照组、阴性对照组、miR-378a-3p转染后24 h和48 h组细胞凋亡率分别为4.05%±0.888 8%,4.63%±0.434 9%,15.65%±1.377 2%和17.10%±3.472 8%。由此可以看出:空白对照组与阴性对照组细胞凋亡率无明显变化;与空白对照组和阴性对照组相比,miR-378a-3p转染后24 h及miR-378a-3p转染后48 h细胞凋亡率显著增高,差异有统计学意义(P<0.001,见图3)。
与空白对照组和阴性对照组比较,*P<0.05
与空白对照组和阴性对照组比较,**P<0.01
3 讨论
食管癌是常见的消化道肿瘤之一。它依病理分型,主要分为食管腺癌(esophageal adenocarcinoma,EAC)和食管鳞癌(esophageal squamous cell carcinoma,ESCC)两大类[10]。全球范围内的食管癌约90%是食管鳞癌,我国是世界上食管癌高发区之一,目前,食管癌总的5年生存率仅为15%-25%,每年有超过15万人死于食管癌[11]。因此,早期诊断及有效治疗食管癌极其重要。
与空白对照组和阴性对照组比较,***P<0.001
食管癌发病原因尚不十分清楚,越来越多研究证明食管癌发生是一个多因素、多基因、多阶段共同作用的结果,是一个因许多致癌基因、抑癌基因结构与功能发生异常不断累积与协同作用的过程。因此,通过寻找新的生物标记物,提高早期诊断的精准率,揭示及干预疾病分子调控机制,是降低食管癌死亡率的有效途径[12]。
肿瘤细胞最显著的特征为代谢异常,其能量代谢与正常细胞有很大不同。研究显示,这是肿瘤细胞快速增殖并转移的分子生物学基础[13]。Warburg效应是一种低效能量产生方式。丙酮酸激酶(pyruvate kinase,PK)催化磷酸烯醇式丙酮酸(phosphoenolpyruvate,PEP)与ADP反应生成丙酮酸和ATP,是糖酵解的关键酶之一。研究表明[14],M2型丙酮酸激酶(M2 type of pyruvate kinase,PKM2)作为PK的亚型之一,在肿瘤的形成发展中起着重要的作用。PKM2作为多个mi-RNA下游共同的靶基因,通过不同的途径作用于肿瘤细胞,最终促进肿瘤的生长。Tang等[15]研究发现PKM2在多种恶性肿瘤中表达升高,且与肿瘤耐药性及预后相关,在肿瘤的发生发展中发挥重要的调控作用。
目前,miR-378的抗肿瘤作用受到广泛的关注。微小RNA(mi-RNA)是一类可调控基因表达的内源性非编码单链小分子RNA,不仅与多种肿瘤疾病的诊断、预后和治疗密切相关,还可以作为致癌或抑癌基因参与肿瘤细胞的增殖、分化和凋亡等生物学行为[16]。研究显示,miR-378在一些恶性肿瘤中如胃癌、结直肠癌、乳腺癌中表达下调,有着抑癌基因的作用;但同时miR-378在诸如白血病、肾母细胞瘤、肺癌以及胰腺肿瘤中表达却是上调的,这些研究表明了miR-378在肿瘤发生、发展的过程中发挥着重要作用,且作用机制较为复杂[17]。miR-378包括miR-378a-3p和miR-378a-5p。有研究表明,miR-378a-3p可以通过靶向GOLT1A增强他莫昔芬对乳腺癌细胞反应能力。此外,miR-378a-3p是结直肠癌的预后影响因素。王晓龙等[18]发现,食管癌细胞中miR-378a-3p的相对表达量明显低于正常细胞。大量研究发现,调控miRNA-155的表达可影响细胞的增殖及凋亡等生物学活动[19,20]。然而,关于miR-378a-3p在食管癌进展的生物学作用和潜在的分子机制尚不清楚。因此,寻找新的食管癌诊断及治疗靶点,从而提高食管癌的早诊早治非常重要[21]。
为了探讨miR-378a-3p与PKM2基因的关系,以及对食管鳞癌细胞Eca-109凋亡及能量代谢的影响,本实验将miR-378a-3p转染入Eca-109细胞24 h和48 h后,流式细胞仪检测miR-378a-3p对Eca-109细胞凋亡的影响,研究结果显示,转染miR-378a-3p组能够显著地增加Eca-109的凋亡。用紫外分光光度法检测ATP含量可见转染miR-378a-3p后ATP产量较对照组明显降低,Western blotting检测miR-378a-3p干预后PKM2蛋白水平的变化,研究结果显示,miR-378a-3p转染后PKM2表达降低。综合上述结果提示:作为有氧酵解途径中的关键酶PKM2,miR-378a-3p通过抑制其表达,从而干扰肿瘤细胞的能量代谢,进而增加肿瘤细胞的凋亡。本研究为食管癌的靶向治疗及进一步研究提供了理论依据,对miR-378a-3p功能及作用机制的研究,有助于探寻新的食管癌候选诊断,治疗靶点,并揭示食管癌进展过程中的生物学机制。

