不同碳氮比对黏性红酵母WP3生长及类胡萝卜素合成的影响*
王 蓉,曹海宁,李 娟
(湖南环境生物职业技术学院图书馆,湖南 衡阳 421005)
天然类胡萝卜素的组成单位是四萜,由其组成不饱和度很高的一类异戊二烯构成物在自然界的分布很广泛,一般为红、橙、黄等颜色[1]。四萜的化学组成为40 个碳原子构成的多烯链,末尾为一两个终止或单极循环组,主要分布在一些植物和微生物细胞中,还能存在于动物的组织中,但要经过食物链进行转化[2]。藻类、霉菌、细菌和红冬孢酵母属、红酵母属、法夫酵母属及掷孢酵母属的酵母等微生物能天然产生类胡萝卜素[3]。
类胡萝卜素对人和动物具有很重要的功效,如它能有效促进免疫应答,能清除氧自由基,能通过一系列反应生成维生素A[4]。动物自身不能生成类胡萝卜素,必须从食物中摄取,比如可将类胡萝卜素添加到饲料中被动物获取,鲑鱼就是如此[5]。人类也是从食物中摄取类胡萝卜素,一般水果、蔬菜和有色动物类食品中含丰富类胡萝卜素。
类胡萝卜素有天然品和人工合成品两类[6],可以人工合成,也可以从水果、蔬菜中提取。与这些方法比较,利用微生物进行类胡萝卜素生产更具优势,首先不受地理环境和季节气候约束,其次发酵过程利用的底物低价普遍,生产成本低廉[3]。微生物中酵母更优于霉菌和藻类,适合大型类胡萝卜素生产。酵母多为单细胞生物,培养简单[7],且生产效率高。目前国内很多学者将目光聚焦在红酵母上,红酵母生产类胡萝卜素也越来越得到广泛应用,但学者们主要围绕如何将红酵母破壁以及如何优化类胡萝卜素的提取方法,如何得到高产菌株等展开研究,而对如何促进红酵母的发酵,如其中培养基的底物组分等还未透彻研究。
本试验设置若干个碳氮比,通过单因素研究实验探究碳氮比对试验菌株类胡萝卜素质量浓度与细胞生物量的影响,以及碳氮比的改变对类胡萝卜素合成过程中葡萄糖利用、残糖比、类胡萝卜素得率的影响,探究分析得到试验菌株发酵产生类胡萝卜素的最适碳氮比,为类胡萝卜素增产提供参考。
1 不同碳氮比影响的试验材料与方法
1.1 材料与试剂
1)试验菌株。由苹果皮分离获得,保存于广西科技大学生物与化学工程学院实验室[8]的黏性红酵母 (Rhodotorula mucilaginosa)WP3。
2)试验试剂。国药集团化学试剂公司生产的分析纯葡萄糖;广东台山市粤侨试剂塑料有限公司生产的分析纯NH4NO3;上海赛弗生物科技有限公司生产的纯度99%以上的类胡萝卜素标准品;试验中还用到其他分析纯试剂。
3)培养基。一是斜面培养基:称取20 g 蛋白胨,10 g 酵母粉,20 g 琼脂,20 g 葡萄糖,补水至1 000 mL,pH 值为自然状态。二是MS3 培养基:称取1.5 g 酵母粉,30 g 葡萄糖,1 g KH2PO4,5 g NH4NO3,0.4 g NaCl,0.4 g MgSO4·7H2O,加自来水至1 000 mL[9]。三是MS3-2 培养基:称取30 g 葡萄糖,1.5 g 酵母粉,1 g KH2PO4,0.4 g NaCl,0.4 g MgSO4·7H2O,加自来水至1 000 mL。
1.2 试验仪器
麦克奥迪实业集团有限公司的DMB5Motic 数码显微镜;常熟市双杰测试仪器厂的JJ200 电子天平;广西壮族自治区医疗器械厂的LRH-250-Ⅱ生化培养箱;梅特勒-托利多仪器 (上海)有限公司的AB104-N 电子分析天平;上海智城分析仪器制造有限公司的HWY-2112 全温度恒温调速摇床柜;广西南宁融仪实验仪器有限公司的XB-K-25 血球计数板;上海美普达仪器有限公司的UV-1100 紫外可见分光光度计。
1.3 试验方法
1)保藏菌种。按配方进行斜面培养基配制,加热溶解分装到试管并灭菌,趁热将试管倾斜放置,摆出适度的斜面,将试验菌株用灭菌接种环在斜面 “Z”字划线,在恒温28 ℃条件下培养48 h,保藏于4 ℃冰箱,为了保持菌株活力,一个月转接一次[10]。
2)培养种子。在150 mL 锥形瓶中装50 mL 的MS3 培养基,取一环生命力旺盛的斜面种子接种于其中,摇床条件设置为30 ℃,150 r/min[11],将种子液置于其中培养3 d,用灭菌移液枪吸取5 mL培养液转接至内含MS3 培养基50 mL、容量为150 mL 的锥形瓶中,相同条件的摇床中继续培养3 d,取培养液离心去上清,将所得细胞加无菌水混匀,将种子液细胞计数,让接种量一致达到107个/mL。
3)摇瓶发酵。用灭菌移液枪吸取定量种子液转接至内含培养液300 mL 的500 mL 锥形瓶中,接种量为107个/mL,摇床条件设置为30 ℃,150 r/min,发酵液置于其中培养7 d,设置3 组平行试验[12]。
4)测定生物量。将发酵液摇匀,使细胞分散均匀,将其放入离心机,去上清,细胞沉淀加与上清液等量的蒸馏水重悬,将此细胞液通过分光光度计测其波长在600 nm 处的吸光度值A600nm[13]。
5)计算比生长速率。比生长速率即单位质量的菌体量增加值与时间的比值,是微生物生长快慢的参数之一,也是发酵动力学中的重要参数,计算公式[14]为
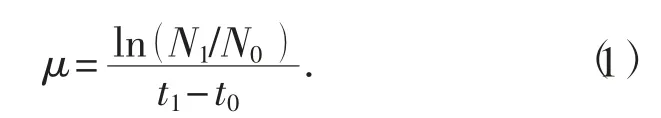
式中:μ 为一段时间内的比生长速率,h-1;N1和N0分别为当培养到t1和t0时测出的试验菌株的细胞密度,也就是细胞液的吸光度值A600nm。
6)提取类胡萝卜素的方法。将发酵7 d 的培养液量取20 mL 于6 000 r/min 的转速进行5 min 离心,除去上清液得到细胞沉淀,沉淀多次水洗,向沉淀中加入5 mol/L 盐酸4 mL,持续振荡1 h,放入沸水中水浴4 min,通过离心将盐酸除去,多次水洗沉淀,将丙酮加入细胞沉淀,充分振荡均匀,通过离心将上清液收集到棕色瓶中,这个步骤重复几次,一直到丙酮液不显色,混合几次收集的丙酮液作为提取液,在分液漏斗中加入石油醚 (60~90 ℃沸程),将提取液转移其中,为了避免乳化慢慢滴加超纯水,应用分层去除丙酮,去除水层,重复4 次此步骤,一直到丙酮层无色,得到的石油醚抽提物就是类胡萝卜素提取液[15]。
7)测定类胡萝卜素质量浓度的方法。测量石油醚抽提物在450 nm 最大吸收波长处吸光度值[16],公式[15]为

式中:ρ 为类胡萝卜素的质量浓度,μg/L;A 为提取液在450 nm 波长处测得的吸光度;V 为石油醚抽提物总体积,mL;A 为消光系数,指在450 nm 最大吸收波长处的光线在透过光径为1 cm、内装质量分数为1%类胡萝卜素标准品溶液的比色杯时的吸光度值,计算3 次平行的均值;P 为用来提取类胡萝卜素的发酵液体积,L。
2 不同碳氮比影响的试验结果
为了探究碳氮比对红酵母发酵的影响,将MS3-2 培养基作为基底,使NH4NO3与葡萄糖质量浓度不同 (见第66 页表1),pH 值为自然状态,选用500 mL 锥形瓶加入300 mL 培养基,将WP3 种子接入培养基,使接种量为107个/mL,摇床条件设置为30 ℃,150 r/min,将发酵液置于其中培养7 d。每24 h 进行取样测定葡萄糖质量浓度与生物量,培养7 d 后取样进行类胡萝卜素质量浓度的测定。
2.1 不同碳氮比对细胞生物量等的影响
观察第66 页图1 可以发现菌株WP3 在0~1 d内生物量快速增加,说明菌株的对数生长期可能为期间某段时间,细胞生长到3 d 以后生物量变化趋于平稳,说明3 d 后菌株生长进入稳定期。培养到第4 d 生物量出现下降,接着慢慢开始回升,说明生长后期菌株胞体部分自溶,进入衰亡期。
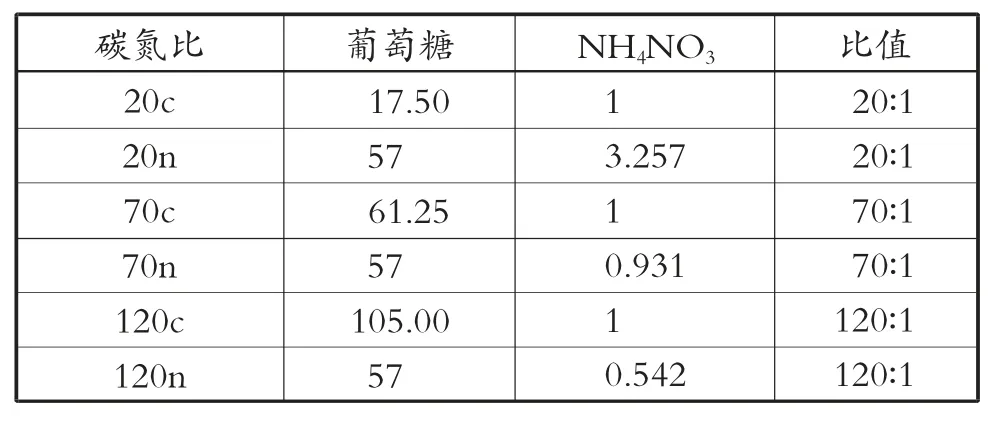
表1 试验中设置的不同碳氮比 (g/L)
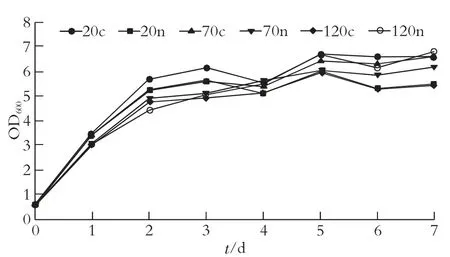
图1 不同碳氮比对黏性红酵母WP3 生物量的影响
随着碳氮比改变,菌株生物量出现不一致变化。碳氮比为20n 及120c 时,菌株生长不好,培养7 d 生物量只有5.52 和5.44,而平均比生长速率也只有0.013 6 h-1和0.012 9 h-1,这表明葡萄糖和氮源质量浓度过高对菌株生长有抑制作用;菌株生长最好时的碳氮比为20c 及120n,培养7 d 生物量已达6.64 和6.82,平均比生长速率为0.014 4 h-1和0.014 2 h-1;而碳氮比为 70c 和 70n 时,7 d 后生物量为6.63 和6.21,平均比生长速率为0.013 7 h-1和0.013 5 h-1。尽管碳氮比为20n 时,最大比生长速率已达0.076 4 h-1,比20c 时大,但从总体上看仍然比20c 生长差,这表明葡萄糖质量浓度适当及碳氮比适当促进菌株的生长。由于碳氮比为120n 时,所需葡萄糖远超于20c,而细胞生长差异并不明显,因此最利于菌株WP3 生长的碳氮比为20c。BRAUNWALD T 等[17]探究菌株生长时碳氮比的影响,观察到菌株前48 h 生长情况大体相同。碳氮比为20c 时,由于碳源含量不高,早期就被消耗,后期细胞生长停滞,碳氮比为20n 时获得最高的生物量,这和本实验碳氮比为20c 时后期细胞生长有所下降一致,但本实验碳氮比为120n 时,发酵7 d后获得最高的生物量。碳氮比较小时,因碳源缺乏,对细胞生长有一定影响[18]。
从图1 和图2 观察到碳氮比为120c 时细胞生长最差,碳氮比为20c 时最利于细胞生长,说明葡萄糖质量浓度过高对菌株生长起到抑制作用,而碳氮比为120n 与120c 时,获得最低类胡萝卜素质量浓度,分别为 251.897 0 μg/L 和 252.861 3 μg/L,表明合成类胡萝卜素一定程度上与菌株生长相关,类胡萝卜素为次级代谢产物[19]。碳氮比为70c 时,获得最高类胡萝卜素质量浓度,为399.466 3 μg/L,因此最利于类胡萝卜素合成的碳氮比为70c。ELBANNA A A 等[20]探究类胡萝卜素合成时碳氮比的影响,得出最利于类胡萝卜素合成的碳氮比为10,但本研究将碳氮比最小设置为20。LATHA B V 等[21]探究出40∶1 为最适碳氮比,不同于本试验。
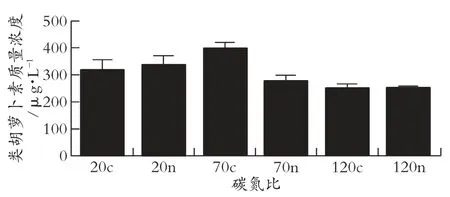
图2 不同碳氮比对类胡萝卜素含量的影响
2.2 不同碳氮比对菌株发酵过程的影响
观察图3 可以发现,碳氮比为20c 时经过4 d发酵葡萄糖消耗趋于平稳,残糖只有5.79 g/L,但其余碳氮比由于葡萄糖质量浓度较高,且没有有机氮源的加入,因此发酵7 d 后剩余残糖比较多。将葡萄糖含量控制在约57 g 时,不管设置多少的碳氮比,葡萄糖的消耗大致相同。由此可见,红酵母进行类胡萝卜素合成不能添加过高的糖量,不然造成消耗糖不充分,糖的利用降低,导致资源浪费。BRAUNWALD T 等[17]探究碳氮比对葡萄糖质量浓度变化的影响,得出碳氮比为20c 时初始葡萄糖质量浓度低,发酵后为低消耗率,但96 h 后葡萄糖已基本消耗。不同碳氮比葡萄糖初始质量浓度约57 g/L时,葡萄糖消耗情况同步,这个结论与本试验一样。而碳氮比为120c 时由于最初48 h 高葡萄糖消耗缓慢,因此之后葡萄糖消耗情况也相近。
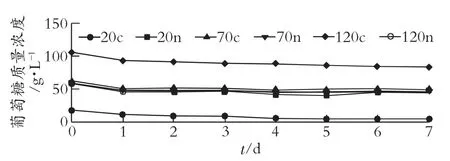
图3 不同碳氮比对葡萄糖质量浓度变化的影响
观察第67 页图4 发现碳氮比为20c 时葡萄糖消耗较彻底,但还是有较高的残糖比,高于20%,可能是由于培养基没有有机氮源的加入,只简单地加入无机氮源硝酸铵,因而葡萄糖利用率不高。碳氮比为70c 时得到最大类胡萝卜素质量浓度,但同时剩下较高残糖量,残糖比约为80%。改善类胡萝卜素合成的办法是碳氮比选取70c,适当添加有机氮源,使培养基更营养丰富,利于发酵,葡萄糖利用更充分,便于合成更多的类胡萝卜素。

图4 不同碳氮比对残糖比的影响
2.3 不同碳氮比对类胡萝卜素得率的影响
图5 的类胡萝卜素得率指的是类胡萝卜素质量浓度与初始葡萄糖质量浓度的比值[22],数量级统一为10-6。图5 中碳氮比为70c 时得到最大类胡萝卜素得率,达34.190×10-6,表明单位质量浓度的葡萄糖合成类胡萝卜素最多,即合成最多类胡萝卜素用了最低的碳源成本,而碳氮比为120c 时得到最小类胡萝卜素得率,只有11.391×10-6,表明红酵母发酵糖质量浓度不宜过高。综上所述,培养基不宜加入过高质量浓度的糖,否则抑制菌株的生长以及类胡萝卜素的合成。
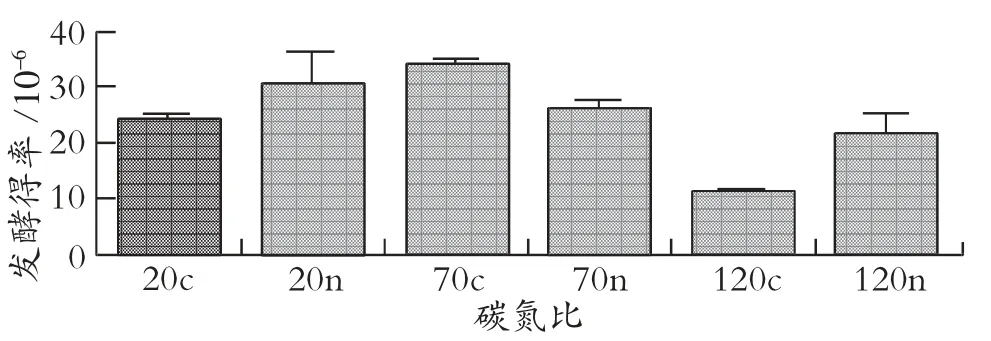
图5 不同碳氮比对类胡萝卜素得率的影响
3 结论
本研究主要探讨碳氮比对试验菌株类胡萝卜素发酵的影响,围绕生物量、类胡萝卜素质量浓度、葡萄糖质量浓度、残糖比、发酵得率5 个量开展研究,结论如下:碳氮比为20c 时最利于细胞生长,当碳氮比为70c 时最利于类胡萝卜素合成,类胡萝卜素产量为399.466 3 μg/L,其得率 (对初总糖)也最大,为34.190×10-6,但这个碳氮比葡萄糖利用不完全,发酵剩余大量残糖,所以碳氮比选择70c。为了使葡萄糖利用充分,可适当添加有机氮源,利于最大量合成类胡萝卜素。

