白藜芦醇对成年期追赶生长大鼠骨骼神经肽Y表达及骨密度的影响
王素星,杜梦颖,张华星,魏金刚,邵伟华,吕彩霞,姚丽霞*
(1河北省人民医院老年病二科,石家庄 050051;2河北省人民医院医务处;3石家庄市第五医院外科;*通讯作者,E-mail:83312832@qq.com)
追赶生长是机体在营养、疾病等不利因素影响下出现生长受抑,并在相关因素解除后出现的快速生长现象,可出现在胎儿期、婴幼儿期、青少年期和成年期[1]。已有相关研究多关注宫内发育迟缓模型(IUGR)[2,3],实际上成年期追赶生长现象更为常见[4],但对其研究并不深入,亦未引起足够重视。追赶生长的本质为能量摄入的波动,机体能量摄入的改变可被外周及中枢摄食信号传输至下丘脑,后者精细地调控能量代谢[5]。神经肽Y(neuropeptide Y,NPY)作为下丘脑刺激食欲的主要神经递质[6],与摄食密切相关,广泛分布于哺乳动物各器官,通过与靶器官上不同受体特异性结合参与调节机体多种重要的生理活动,尤其对骨代谢的调节作用较为显著[7]。其中,NPY与NPY1、NPY2受体在骨代谢中发挥重要作用。NPY2受体主要在中枢调节骨代谢,NPY过表达可明显抑制骨形成,同时NPY-/-小鼠骨生成的面积和速度明显增加[8]。NPY1受体主要存在于外周骨组织,NPY与外周成骨细胞特异性NPY1受体结合后抑制成骨细胞活性和骨生成,成骨细胞NPY1受体缺失可使股骨松质骨体积、小梁厚度和小梁数目显著增加,成骨细胞活性增强,同时皮质骨和骨膜表面的矿物质沉积率增加,股骨直径增加[9]。亦有研究显示,NPY通过中枢和外周神经组织中的NPY2受体抑制去甲肾上腺素和皮质酮的产生或释放,从而减少骨骼在慢性应激期间的丢失[10]。
白藜芦醇是一种存在于红酒中的多酚,多项研究已证实白藜芦醇与骨代谢密切相关[11,12]。白藜芦醇可提高成骨细胞碱性磷酸酶和脯氨酰羟化酶活性,增加成骨细胞的DNA合成,促进成骨细胞增殖和分化[11];亦可激活成骨转录因子CBFA-1,增强骨特异性Ⅰ型胶原的转录,刺激成骨细胞的增殖和分化,并激活沉默信息调节因子(silent information regulator 1,Sirt-1)使骨组织细胞向成骨细胞转化和成骨[12]。白藜芦醇是骨骼保护剂,NPY亦与骨代谢密切相关,在成年期追赶生长,能量的波动使NPY发生怎样的变化,白藜芦醇对NPY有何影响,目前尚无报道。本研究以成年期追赶生长大鼠为研究对象,观察白藜芦醇对股骨NPY蛋白和NPY mRNA表达的影响,探讨白藜芦醇对成年期追赶生长大鼠骨密度影响的可能机制。
1 材料与方法
1.1 药物与主要试剂
白藜芦醇,粉剂,纯度99%(Sigma,St Louis,MO,USA)。兔抗大鼠NPY抗体(Abcam Company,USA),山羊抗兔IgG(H+L,HRP);RT-PCR试剂盒和实时定量试剂盒购于大连TaKaRa公司;核糖核酸提取试剂盒(Triozol Reagent,Invitrogen Life technologies,USA),血清NPY测定ELISA试剂盒(Elabscience,武汉伊莱瑞特生物科技股份有限公司)。
1.2 实验动物
6周龄雄性SD大鼠60只,SPF级,体质量160 g±20 g,购自河北医科大学科研实验动物饲养中心。实验动物质量合格证号:SCXK(冀)2013-1-003。
1.3 动物分组与处理
60只大鼠适应性喂养1周,随机分为6组,每组10只:4周组3组(正常饮食4周组、热卡限制4周组,热卡限制白藜芦醇干预组)和12周组3组(正常饮食12周组、追赶生长组、追赶生长白藜芦醇干预组)。分别在实验第4和12周末进行相关指标检测,统计学分析仅限于相同时间点组别之间进行。追赶生长组模型的制作参阅课题组以前模式:前4周给予正常饮食组相同体质量大鼠进食量60%的标准基础饲料,然后给予正常饮食组相同体质量大鼠进食量等量的标准基础饲料8周[1,4]。热卡限制白藜芦醇干预组为限制饮食同时予以白藜芦醇治疗4周;追赶生长组为限制饮食4周+正常饮食8周;追赶生长白藜芦醇干预组为限制饮食4周+正常饮食同时白藜芦醇干预8周。标准基础饲料购自河北医科大学实验动物学部。正常饮食4/12周组自由进食,热卡限制4周组给予正常饮食组相同体质量大鼠进食量60%的标准基础饲料。白藜芦醇用生理盐水配制成浓度15 mg/ml的悬浊液,根据体质量每天灌胃给予白藜芦醇(100 mg/kg)干预[1],热卡限制4周组和追赶生长组灌胃给与同体积生理盐水。
1.4 骨密度检测
分别在实验的第4和12周末,大鼠禁食过夜,精确称量体质量,腹腔注射戊巴比妥(30 mg/kg)麻醉,待大鼠肌力消失,呼吸平稳,仰卧位将四肢用胶带固定于硬纸板,用美国GE Lunar公司生产的DEXA仪从鼻尖扫描至尾端,行全身及多部位BMD测定[13]。所得数据左右大腿合计为大腿部,除头部外合计为全身。
1.5 Western blot测定骨骼NPY蛋白表达
取股骨,剥离肌肉和结缔组织,将骨组织在液氮中研磨成粉,参照文献[14]方法提取并定量组织蛋白。取40 μg蛋白样品行SDS-PAGE、转膜、封闭,分别用NPY、β-actin 4 ℃孵育过夜;次日洗膜、二抗孵育1 h、显影并分析。
1.6 RT-PCR测定骨骼NPY mRNA
Trizol法提取大鼠股骨头总RNA,分光光度计检测提取样品260 nm、280 nm的吸光值。计算OD260/OD280(R值),检测RNA纯度。按SYBRRR PrimeScripTMRT-PCR Kit说明进行反转录和quantitative real-time PCR扩增。RT-PCR数据收集由系统自带软件完成,通过软件计算所有样品的Ct值,以GAPDH作为内参基因进行校准。采用2-ΔΔCt方法对目标基因NPY mRNA表达进行相对定量。引物由上海生物工程技术有限公司合成。NPY引物:上游5′-TAGGTAACAAACGAATGGG GCTGTG-3′,下游5′-CGCGTCCTCGCCCG GATTGTC-3′,GAPDH引物:上游5′-TTCCTACCCCCAATGTATCCG-3′,下游5′-CCACCCTGTTG CTGTAGCCATA-3′。
1.7 血清NPY浓度测定
用酶联免疫吸附法测定血清NPY浓度,按照试剂盒说明书操作,在450 nm波长下测光密度值(OD值),计算血清NPY含量。
1.8 统计学分析
所有实验数据采用SPSS13.0软件统计分析,以单因素方差分析比较组间差异,各均数间两两比较采用SNK-q检验,数据以均数±标准差表示。P<0.05为差异有统计学意义。
2 结果
2.1 骨密度变化
热卡限制后,与正常饮食4周组相比,热卡限制4周组全身及大腿骨密度下降明显(P<0.05)。恢复饮食后,追赶生长组全身及大腿骨密度与正常饮食12周组比较,差异无统计学意义(P>0.05);与追赶生长组相比,追赶生长白藜芦醇干预组全身及大腿骨密度显著升高(P<0.05);与热卡限制组相比,热卡限制白藜芦醇干预组全身及大腿骨密度呈下降趋势(P<0.05,见图1)。
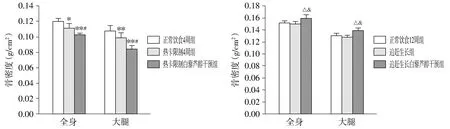
与正常饮食4周组相比,*P<0.05,**P<0.01;与热卡限制4周组相比,#P<0.05;与正常饮食12周组相比,△P<0.05;与追赶生长组相比,&P<0.05
2.2 骨骼NPY Western blot结果
与正常饮食4周组比较,热卡限制4周组股骨NPY的表达明显增加(P<0.01),重饲后,追赶生长组NPY表达有所下降,但至实验结束仍明显高于正常饮食12周组(P<0.01);热卡限制白藜芦醇干预组股骨NPY轻度下降,与热卡限制4周组差异无统计学意义,仍显著高于正常饮食4周组(P<0.01),追赶生长白藜芦醇干预组股骨NPY表达较追赶生长组显著减少(P<0.01),与正常饮食12周组差异无统计学意义(P>0.05,见图2)。
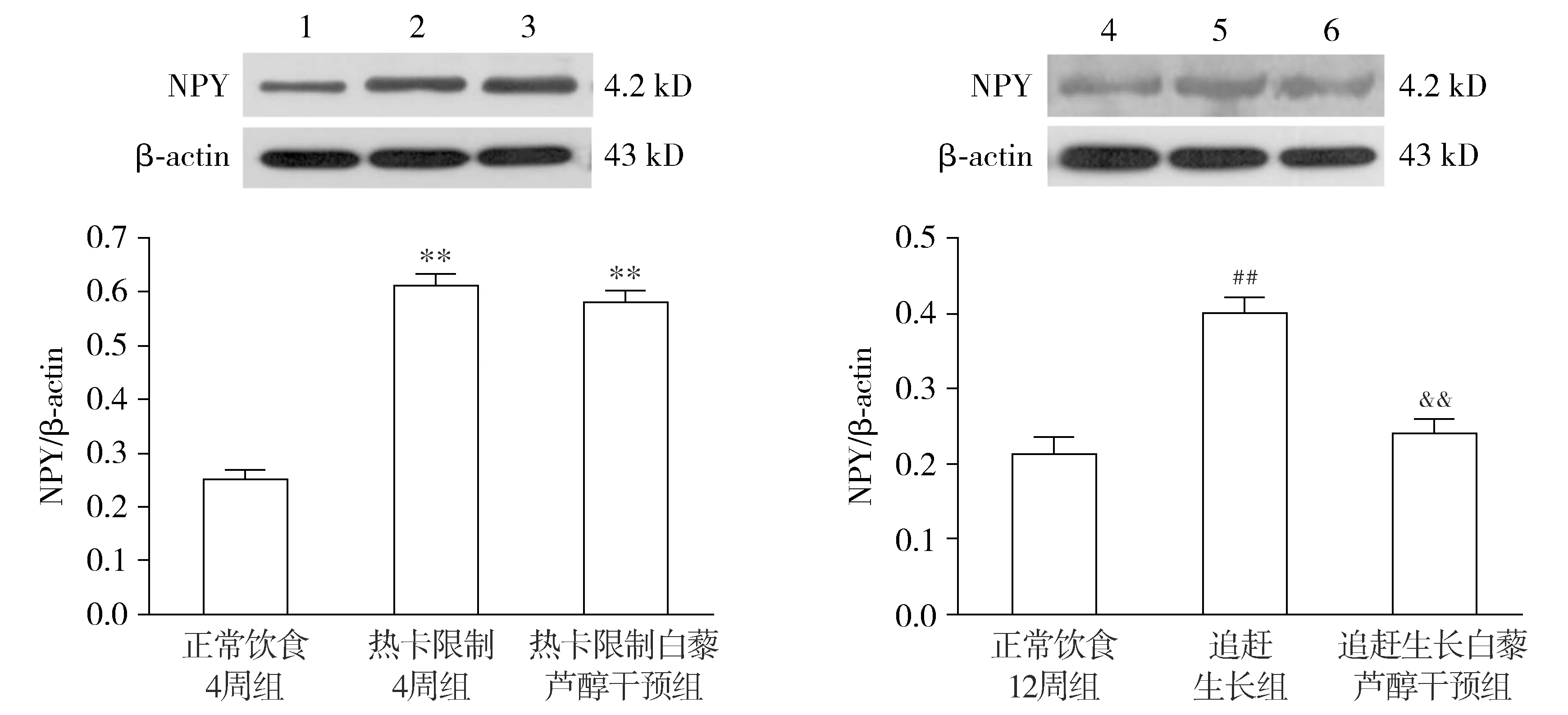
1.正常饮食4周组;2.热卡限制4周组;3.热卡限制白藜芦醇干预组;4.正常饮食12周组;5.追赶生长组;6.追赶生长白藜芦醇干预组;与正常饮食4周组相比,**P<0.01;与正常饮食12周组相比,##P<0.01;与追赶生长组相比,&&P<0.01
2.3 骨骼NPY RT-PCR结果
由2-ΔΔCt可知,与正常饮食4周组比较,热卡限制4周组骨组织中NPY mRNA表达明显上调(P<0.01);开放饮食8周后,追赶生长组股骨组织中NPY mRNA表达有所下降,但仍显著高于正常饮食12周组(P<0.01)。与热卡限制4周组相比,热卡限制白藜芦醇干预组骨组织NPY mRNA 表达轻度下降(P>0.05),但仍显著高于正常饮食4周组(P<0.01);追赶生长白藜芦醇干预组骨组织NPY mRNA表达较追赶生长组显著减少(P<0.01),达到正常饮食12周组水平(P>0.05,见图3)。
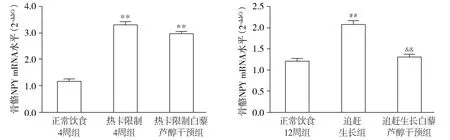
与正常饮食4周组相比,**P<0.01;与正常饮食12周组相比,##P<0.01;与追赶生长组相比,&&P<0.01
2.4 血清NPY水平比较
热卡限制4周组血清NPY明显升高,与正常饮食4周组相比,统计学差异显著(P<0.01)。实验结束时,追赶生长组血清NPY水平显著高于正常饮食12周组(P<0.01)。与追赶生长组相比,追赶生长白藜芦醇干预组血清NPY水平下降明显(P<0.01),达到正常饮食12周组水平(P>0.05),热卡限制白藜芦醇干预组NPY水平较热卡限制4周组明显下降(P<0.01),但仍较正常饮食4周组高(P<0.05,见图4)。
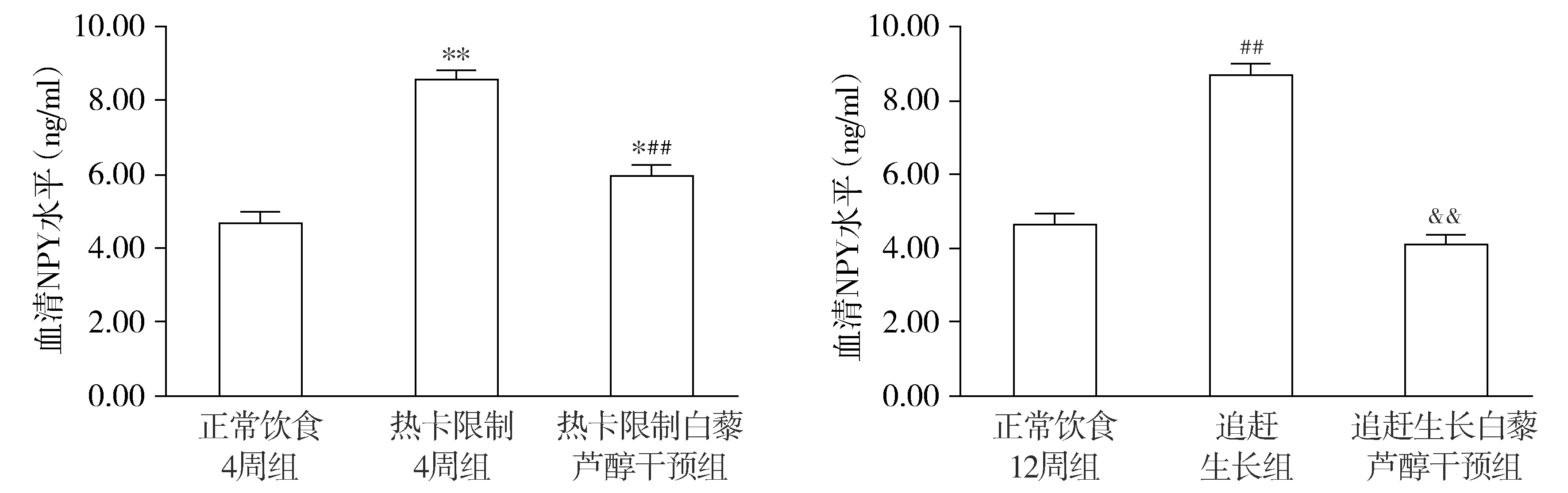
与正常饮食4周组相比,*P<0.05,**P<0.01;与热卡限制4周组相比,##P<0.01;与正常饮食12周组相比,##P<0.01;与追赶生长组相比,&&P<0.01
3 讨论
限食后重饲导致的追赶生长是短期内能量摄入的改变,NPY是对能量摄入及食欲最为敏感的神经递质[6]。NPY不仅存在于中枢神经系统中,也存在于外周骨组织、脂肪组织、血管、肾脏组织等,参与调节机体多种重要的生理活动,尤其对骨代谢的调节作用较为显著[7]。本研究结果显示,NPY在成年期追赶生长大鼠模型中,热卡限制4周末骨骼NPY表达显著增高,恢复饮食后有轻度降低,但至实验结束仍显著高于正常饮食组。同时,本研究亦显示,热卡限制可导致骨密度显著下降,恢复能量供应后的追赶生长可显著提升骨密度。既往诸多研究发现NPY与骨代谢密切相关。神经肽Y水平与成骨细胞活性呈负相关,神经肽Y缺失的小鼠显示出骨量和成骨细胞活性的增加,而下丘脑过表达神经肽Y可引起骨量的显著减少[8]。经NPY特异性受体拮抗剂治疗后骨质疏松小鼠骨矿化增强,骨丢失减少,骨密度增加[9,15]。在本研究中限食期间NPY的表达与骨密度呈相反的变化趋势,推测热卡限制导致骨骼中NPY表达增加进而抑制了成骨细胞的活性,导致骨生成减少,骨密度降低。同时在限食期间,大鼠体质量减轻,骨骼承受的机械力减小,NPY表达的增加负性调控骨生成,减少机体在骨骼生成代谢方面的能量消耗,以保障重要器官的能量供给。因此,NPY在追赶生长过程中的热卡限制阶段调节了骨稳态。
白黎芦醇是一种具有强生物活性的天然多酚类物质,具有抗炎、抗氧化、抗肿瘤等多种生物学作用。目前研究已证实,白藜芦醇与骨代谢密切相关,有抗骨质疏松作用[11,12]。本研究显示,白藜芦醇对恢复饮食后的追赶生长期的大鼠骨密度有提升作用,同时显著降低了NPY在骨组织的表达。虽然白藜芦醇与NPY均已被证实与骨代谢关系密切,但目前国内关于白藜芦醇对NPY影响的研究较少。国外研究目前主要集中在白藜芦醇对下丘脑NPY的影响,并且研究结果存在争议。其中一项研究发现,白藜芦醇可使高脂饮食的小鼠下丘脑弓状核生成NPY减少,进而影响脂肪生成,降低体质量[16]。白藜芦醇通过过表达厌食肽(前阿片蛋白)和抑制食欲肽(神经肽Y)恢复神经元中的瘦素信号,从而减少食物摄入[17]。也有研究发现,白藜芦醇能显著提高前额叶皮层神经递质多巴胺和5-羟色胺水平,增加脑内NPY的表达,对抑郁症有拮抗作用[18]。本研究中白藜芦醇对骨骼NPY的表达及血清NPY水平均有明显抑制作用。多项研究已证实NPY对骨生成存在显著的负性调节作用[8,9,15],白藜芦醇通过抑制骨骼NPY的表达,促进骨生成。另外,白藜芦醇是SIRT1的强力激活剂,有研究显示,在糖皮质激素诱导的骨质疏松小鼠模型上,沉默NPY的表达可激活SIRT1信号通路,从而改善骨骼损伤[19]。外源注射烟酰胺腺嘌呤二核苷酸可部分通过激活SITR1的表达进而抑制NPY的转录活性[20]。以上研究结果可得出,SIRT1与NPY的表达存在负性调控作用,一方表达的增强会抑制另一方的表达。本研究中,白藜芦醇亦可通过激活SIRT1抑制NPY的表达,进而提升骨密度。
需要注意的是,本研究结果显示白藜芦醇在机体不同能量供应状态下对NPY的影响程度不同。热卡限制期间,白藜芦醇使骨骼NPY的表达轻度下降,与未干预前差异无统计学意义。重饲后,白藜芦醇可使骨骼NPY表达显著下降,恢复至正常对照水平。与此同步的是,白藜芦醇仅在追赶生长白藜芦醇干预组对骨密度有提升作用,在热卡限制白藜芦醇干预组对骨密度影响不明显。研究显示食物缺乏可使成骨细胞活性受抑[21],本研究中减少40%的食物摄入使得骨形成所需的基本原料明显减少,成骨细胞活性受抑,能量分配首先确保机体的关键器官基本代谢活动。在此种情况下,即使应用骨保护剂,促进骨形成的作用可能亦不明显,对某些负性调控骨生成基因(如NPY)表达的抑制作用不会太显著。一旦能量供应恢复,在追赶生长白藜芦醇干预组,机体的饥饿应激解除,白藜芦醇对骨骼NPY表达的抑制作用得以呈现,使其骨密度显著提升。据此推论白藜芦醇的骨骼保护作用依赖于机体能量供给。
另外,血清NPY与骨骼NPY表达在追赶生长过程中的趋势不尽相同。热卡限制期间,血清NPY浓度与骨骼NPY表达均呈显著升高趋势,但开放饮食后,骨骼NPY表达呈下降趋势,但血清NPY水平变化不明显。因机体中下丘脑及其他器官都能分泌NPY[22],故推测,血清NPY来源于除骨骼以外的其他器官。同时,本研究中为了避免实验动物重饲时过饱,按体质量匹配投喂的食量对于机体饥饿后的需求相对不足,故下丘脑及受控于下丘脑的靶器官可能仍继续分泌较多的NPY。推测延长追赶时间,血清NPY水平及骨骼NPY表达应可恢复至正常对照水平。
综上,白藜芦醇可能通过降低成年期追赶生长大鼠骨组织NPY的表达,同时降低血清NPY浓度,进而提升全身和局部骨密度,发挥对追赶生长大鼠的骨保护作用。但白藜芦醇对骨骼NPY表达的抑制作用依赖于充足的营养供应。在该模型中所涉及到的其他影响骨代谢的基因改变情况需要更加深入的研究。

