卒中后抑郁患者静息态局部脑活动与默认网络功能连接改变的磁共振成像研究
朱瑞瑞,张平,闫海清,贵永堃,王昊亮,朱欣茹,张林丽,宋景贵
卒中后抑郁(post-stroke depression,PSD)指卒中后以情绪低落、兴趣减退、睡眠障碍等为表现的情感障碍,是卒中后最为常见的精神障碍[1-2]。最近的流行病学资料显示,PSD在卒中后5年内的综合发生率为31%[3]。近年来静息态功能磁共振成像(resting-state functional magnetic resonance imaging,rs-fMRI)因其无创性、无需试验任务等优势,成为研究脑功能改变的重要手段[4-5]。脑区间功能连接和局部脑活动分析是rs-fMRI常用的两种分析方法,前者包括种子点分析及独立成分分析(independent component analysis,ICA),可从全脑角度比较脑区之间神经活动。相比种子点分析,纯数据驱动的ICA不受生理因素影响可分析全脑区域,但稳定性差;后者包括局部一致性(regional homogeneity,ReHo)、低频振幅等,ReHo反映局部脑区神经元激活一致性程度,高稳定性,但无法反映空间相隔较远的脑区间的功能联系。ICA目前在PSD患者脑功能连接改变的研究中应用较少。因此,本研究应用ReHo联合ICA分析方法以互补角度探索PSD患者神经功能成像与精神状态的关联。
1 研究对象与方法
1.1 研究对象 PSD组研究对象选自2017年1月-2019年1月于新乡医学院第一附属医院就诊的首次缺血性卒中后的抑郁患者。纳入标准:①年龄≥18岁;②首次缺血性卒中患者,符合中华医学会中国第4届脑血管病学术会议制定的脑血管病诊断标准,并经CT或MRI证实;③抑郁症符合美国精神障碍诊断与统计手册第五版(DSM-5)、中国精神障碍分类与诊断标准第3版抑郁症诊断标准及《卒中后抑郁临床实践的中国专家共识》[6],且明确发生于卒中后;④神志清楚可配合各项测试和检查,MMSE:文盲>17分,小学>20分,初中及以上>24分;⑤汉密尔顿抑郁量表17项(Hamilton depression scale-17,HAMD-17)评分>7分[6];⑥入院前未曾服用抗抑郁药物;⑦右利手。
对照组研究对象选自2017年1月-2019年1月于新乡医学院第一附属医院就诊的首次缺血性卒中未抑郁患者,与PSD组在性别、年龄、受教育程度等方面基本一致。纳入标准:①年龄≥18岁;②首次缺血性卒中患者,符合中华医学会全国第四届脑血管病学术会议通过的脑梗死诊断标准,均行头颅CT或MRI检查证实;③能完成相关检查及评分;④HAMD-17评分<7分[6];⑤右利手。
排除标准:①年龄<18岁;②既往有严重躯体疾病、抑郁或伴有器质性精神类疾病;③聋、哑、失语及意识障碍、存在明显智力障碍或其他原因而无法配合检查;④酒精、药物滥用或依赖史;⑤脑出血、蛛网膜下腔出血及癫痫患者;⑥MRI扫描头动>1.5 mm或1.5 °。
本研究经新乡医学院第一附属医院伦理委员会批准(批号:2018153)。试验前向所有被试者或监护人介绍本研究内容,所有被试者均自愿参与并签署知情同意书。
1.2 资料采集 记录患者的一般资料,包括性别、年龄、受教育年限、既往史(高血压、高脂血症、糖尿病)[7-8]、吸烟(平均每天吸烟≥5支,连续≥1年)、饮酒(平均每天酒精摄入≥24 g,连续或累积≥1年)、责任病灶侧别等。
通过MMSE检查评价患者的认知水平,NIHSS评估患者的神经功能缺损程度,HAMD-17量表评估抑郁状态及程度。量表由两位专业精神科医师及神经内科医师进行盲法评估,并行一致性检验。脑萎缩、腔隙性脑梗死、脑白质脱髓鞘[9]等MRI结果判读由两名专业神经放射科医生在盲法状态下完成,判读不一致时由上级医师判读。
1.3 MRI数据采集 采用美国GE Discovery MR750 3.0 T MR扫描系统和8通道头颅线圈进行数据采集。扫描前嘱受检者静息平卧,扫描过程中保持安静清醒状态,尽量不做思考;取平行于前后联合线方向为定位线行常规MRI,以除外脑内器质性病变。rs-fMRI图像采用梯度回波的单次激发平面回波成像(gradientrecalled echo-planar imaging,GRE-EPI)序列获取,主要扫描参数为:重复时间/回波时间=2000 ms/30 ms,层厚=4 mm,视野=256 mm×256 mm,矩阵=64×64,翻转角=90 °。
数据预处理:基于MATLAB 2011a,使用DPABI软件包(http://rfmri.org/DPABI)进行数据预处理,主要步骤如下:去除前10个时间点,以保证信号的稳定性;时间及头动校正;空间标准化:采用EPI模板将个体脑功能图像配准到蒙特利尔神经病学研究所(Montreal Neurological Institute,MNI)标准脑空间;采用全宽半高(full-width of half-maximum,FWHM)值为8 mm的高斯平滑核对图像进行平滑处理(ReHo分析前不进行平滑处理),提高图像信噪比;去线性漂移;对6个头动参数、全脑白质信号、脑脊液信号和全脑均值进行回归;滤波(带宽为0.01~0.08 Hz),消除高频生理噪声影响。
ReHo分析:数据预处理后利用REST(http://www.restfmri.net/forum/REST)软件进行ReHo分析,计算全脑每个体素的肯德尔和谐系数(Kendall's coefficient of concordance,KCC),然后将每个受试者全脑每个体素的ReHo信号值除以全脑所有体素ReHo信号值的均值,得到个体标准化的ReHo图,然后再对标准化后的ReHo图进行平滑处理。
ICA分析:利用GIFT软件包(http://icatb.sourceforge.net/)将平滑后的数据进行ICA分析。估计每组成分数,分别得到PSD组38个独立成分、对照组42个独立成分。运用Informax算法对每组被试的fMRI影像进行空间ICA,得到两组默认网络(default mode network,DMN)空间分布模式。
1.4 统计学方法 采用SPSS 22.0统计软件包进行一般临床资料统计分析。计数资料用构成比(%)表示,组间比较采用χ2检验或Fisher's确切检验分析;符合正态分布的计量资料用表示,组间比较采用独立样本t检验,不符合正态分布的计量资料则用中位数(四分位数间距)表示,组间比较采用Mann-WhitneyU检验。统计结果采用双尾检验,以P<0.05为差异有统计学意义。
采用SPM 8软件对fMRI数据进行统计分析。在SPM8软件上采用独立样本t检验分析组间ReHo和DMN功能连接的差异,组间ReHo分析以P<0.001(未校正)及体素值(clusters)>20 mm3为差异有统计学意义;DMN功能连接分析以P<0.05为差异有统计学意义[校正错误发现率(false discovery rate,FDR)],Xjview软件确定有统计学意义的脑区、所在的标准的MNI系统坐标及激活强度大小(t值为改变区域内差异最明显体素的统计值)。对于PSD组患者,将组间存在显著差异的平均ReHo值或DMN功能连接值(平均z值)与量表评分进行Pearson相关性分析,以P<0.05为差异有统计学意义。
2 结果
2.1 基线资料 本研究符合PSD入组标准者23例,剔除大面积脑梗死而无法配合检查者3例,确定PSD组20例。纳入卒中未抑郁患者28例,选择性别、年龄、受教育程度等方面基本一致者,确定对照组19例。PSD组HAMD-17评分高于对照组(P<0.001),其余基线资料在两组间差异无统计学意义(P>0.05)(表1)。
2.2 两组ReHo值比较 与对照组相比,PSD组左侧小脑脚2区和右侧海马旁回的ReHo值升高(P<0.001,clusters>20 mm3,未校正)(表2、图1)。
2.3 两组DMN功能连接比较 与对照组相比,PSD组左侧楔前叶功能连接增强(P=0.011,clusters>10 mm3,FDR校正),右侧楔叶功能连接减弱(P=0.006,clusters>10 mm3,FDR校正)(表3、图2、图3)。
2.4 PSD组异常脑区ReHo值及功能连接值与抑郁量表相关性分析 PSD组右侧海马旁回ReHo值与HAMD-17评分正相关(r=0.556,P=0.011),右侧小脑脚2区ReHo值与HAMD-17评分无相关性(r=-0.161,P=0.497)。同时,PSD组右侧楔叶功能连接值与HAMD-17评分呈负相关(r=-0.574,P=0.008),左侧楔前叶功能连接值与HAMD-17评分无相关性(r=-0.080,P=0.737)。
3 讨论
目前PSD诊断主观性强,缺乏客观指标。需要具有客观信息指标的手段,以期对PSD的诊治开拓一条崭新的途径。ICA属于数据驱动模型,能分离头动或心跳呼吸等生理活动对信号产生的影响,不基于先验知识选取区域,可同时对比多个分散区域的脑活动,适合于全脑范围的探索研究。与ICA分析法不同,ReHo分析被用来研究局部区域的功能异常,稳定性较强,从而对ICA产生的结果做出补充。既往少有研究采用ICA分析法评价PSD。本研究应用ICA分析法联合ReHo分析法观察PSD患者静息态大脑功能连接的改变模式。结果发现,PSD患者DMN中左侧楔前叶功能连接增强、右侧楔叶功能连接减弱。且右楔叶的功能连接值与HAMD-17评分负相关。
Raichle等[10]提出DMN是大脑在无任务安静、清醒状态下存在有组织的功能活动,可能与自我意识、情景记忆等精神活动密切相关。包括楔前叶、楔叶、扣带回等区域。Ho等[11]研究静息态下重性抑郁症患者的DMN,发现前额叶内侧皮层与楔前叶、扣带回等功能连接增强。一项重性抑郁症患者Meta分析发现,静息态下DMN功能连接普遍增强[12]。楔前叶是DMN后部重要组成部分,对情景记忆、自我调整十分重要。相关研究认为,楔前叶在调节注意-抑制网络中起重要作用,该网络的节点与节点之间的异常变化可能是PSD患者情绪改变的又一个潜在神经机制[13]。

表1 两组基线资料比较

表2 PSD组较对照组ReHo值升高的脑区
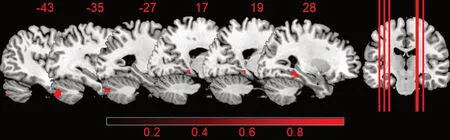
图1 PSD组较对照组ReHo值升高的脑区

表3 PSD组较对照组DMN功能连接异常的脑区

图2 PSD组与对照组比较DMN中功能连接异常脑区的三维映射图
本研究发现静息态PSD患者右侧楔叶功能连接减弱,且右楔叶的功能连接值与HAMD-17评分负相关。枕叶是视觉刺激初级加工区域。枕叶病损时也会出现记忆缺陷和运动知觉障碍等症状[14]。楔叶属于枕叶的一部分,同时为DMN的重要脑区,与视空间意象及情景记忆提取有关[15]。有研究表明,缺血性卒中急性期伴发抑郁障碍者在静息状态下右枕叶中部及距状沟等脑区存在功能异常[16]。另有研究发现,抑郁症患者枕上回活动增加[17]。提示右侧楔叶功能连接较弱可能是导致卒中患者抑郁障碍的原因之一。
同时本研究得出PSD组右侧海马旁回ReHo激活增强,且右侧海马旁回的ReHo值与HAMD-17评分呈正相关。Fang等[18]通过对抑郁症患者进行1个月的经皮迷走神经刺激治疗,发现患者DMN与海马旁回的功能连接减弱,与楔前叶连接增强。Kim等[19]发现,重性抑郁症患者静息态下双侧杏仁核与海马旁回功能激活减弱。海马旁回、海马与杏仁核等边缘系统结构,与记忆、情绪和行为等心理活动息息相关。海马旁回功能异常,可能是产生负性情绪及记忆力受损的原因之一。边缘系统是情感调节中枢,海马旁回功能损害可能是PSD的解剖基础。由此推测,右侧海马旁回神经元活动异常可能是PSD的一个神经生物学机制。
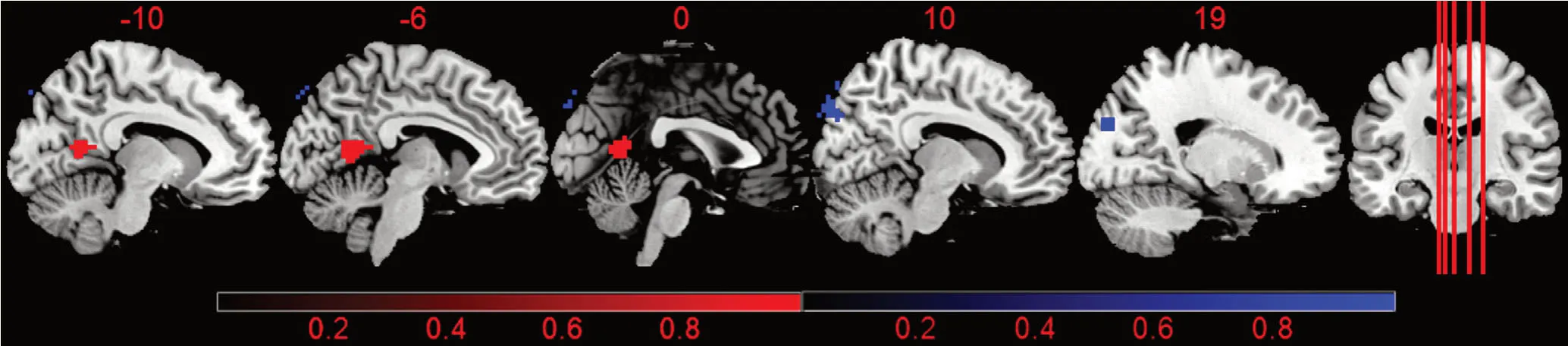
图3 PSD组与对照组比较DMN中功能连接异常脑区的矢状位示意图
本研究也发现左侧小脑脚2区ReHo激活增强。以往认为小脑仅是控制躯体平衡和调节运动的脑区,研究发现小脑除了对人体运动平衡有调控功能,也调节恐惧和愉悦反应过程[20]。另有研究表明,首发未服药的抑郁症患者右侧颞下回和右侧小脑的ReHo增强[21]。由此推测,左侧小脑脚2区功能紊乱可能是导致PSD的敏感因素之一。
本试验结果与既往研究有一定相关性,如侯晶晶等[16]发现PSD患者右角回及右小脑的ReHo值降低。小脑主要参与人体运动的起始与协调,其中小脑后叶还在感觉和情绪的初始分辨中有重要作用,因而也是调控情绪的重要部分[22]。小脑病变可引起小脑认知情感障碍,综上所述,PSD的发生发展与小脑病变有关,且小脑功能改变与抑郁的严重程度相关。此外,抑郁障碍的解剖学基础包括边缘系统、下丘脑等。抑郁的生物学基础主要为5-羟色胺失衡,而5-羟色胺能神经元的神经解剖位置即在边缘系统,而下丘脑主要调节复杂情绪。边缘系统与下丘脑存在广泛联系。本研究提示,右侧海马旁回局部脑区自发活动的时间同步性与抑郁严重程度存在相关性。因此,海马旁回功能连接改变与PSD的发生相关。本研究进一步肯定了以往的研究结果。
国内外抑郁症相关研究较多,但少有ICA研究显示PSD患者左侧楔前叶功能连接增强、右侧楔叶功能连接减弱。本研究发现,DMN部分脑区与PSD患者功能连接异常的脑区相吻合。说明DMN功能连接的变化不仅体现于抑郁症,也与PSD的发生密切相关。分析既往研究及本研究结果不完全一致的原因,可能与各个研究的样本量、病灶数目、体积、部位不同有关,也可能与疾病本身的异质性有关。
本研究利用ICA分析比较卒中后是否发生抑郁患者之间的区别,并联合ReHo分析法增强研究稳定性,确认卒中后神经功能改变与抑郁发生有关,明确了PSD患者的部分脑区功能紊乱。但本研究也存在以下局限性:未关注PSD患者大脑其他功能网络,纳入病例较少,未进行纵向比较。今后需设立多中心加大样本量,同时纵向比较PSD患者治疗前后的脑功能变化,有助于追踪PSD全程发病机制的变化。

