真菌来源的抗微生物多肽研究进展
沈秉正,李雪珂,杨海峰,喻研
(1.武汉大学人民医院药学部,湖北 武汉 430060; 2.武汉大学生命科学学院病毒学国家重点实验室,湖北 武汉 430072; 3.华中科技大学同济医学院附属同济医院消化内科,湖北 武汉 430060)
经过数千年的进化,抗微生物多肽(Antimicrobial peptides,AMPs)已成为许多生物先天免疫系统的重要成分。由于广泛的活性,使得AMPs成为抗病原微生物最有希望的候选药物之一。AMPs可通过膜裂解、非裂解方式和/或细胞内的机制进行独立或协同作用而引起微生物的死亡。AMPs又被称作宿主防御肽,在所有生命形式中几乎均可以找到。从细菌到植物、无脊椎动物和脊椎动物等所有生物均可产生AMP。
截止至2019年4月,抗菌肽数据库(The Antimicrobial Peptide Database,APD; http://aps.unmc.edu/AP/)收录了7大来源的3 065种抗菌肽[1],其中1 085种来自两栖动物,533种来自节肢动物,288种来自哺乳动物,131种人类宿主防御肽,126种来自鱼类,43来自软体动物,42种来自鸟类,40种爬行动物,17种来自真菌,6种来自原生动物以及包括人工合成/改造等其他来源的AMPs。
近几年,随着三代测序技术的普及以及四代测序技术的逐渐完善,对真菌基因组、转录组测序也逐渐增多,目前已发现17种真菌来源的AMPs,这些多肽序列、结构各异,生物活性亦有不同。本文从上述17种多肽的性质、结构特点、抗微生物活性等方面对真菌来源的抗微生物多肽进行系统总结,以期能为其进一步作为药品开发提供参考。
1 真菌来源的抗微生物肽的分类
由于真菌来源的抗微生物肽是一类独特且多样的分子,因此对其进行分类显得非常重要。目前,对于AMPs的分类方式主要是基于多肽序列、空间结构、生物活性或作用机制。由于多肽的活性取决于氨基酸残基的序列和结构,本文亦基于该特征将来源于真菌的AMPs分为线性多肽和含有分子内二硫键的多肽两个大类,见表1所示。
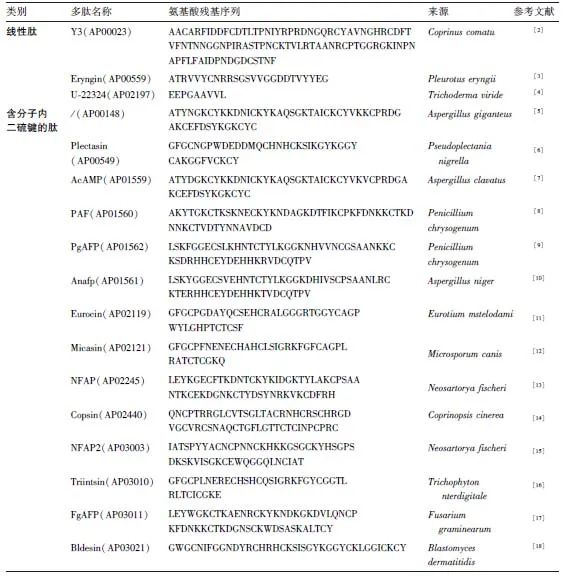
表1 真菌来源的抗微生物多肽Table 1 Fungal-derived antimicrobial peptides
注:括号内为多肽在抗菌肽数据库(http://aps.unmc.edu/AP)中多肽的编号。
2 真菌来源的线性抗微生物肽
2.1 来源于毛头鬼伞的Y3多肽
吴丽萍等[2]利用离子交换层析技术和凝胶层析法从毛头鬼伞(C.comatus)中分离提取到了抗植物病毒多肽Y3,其为含有糖基的多肽,在菌丝体和子实体中均能通过Western杂交方法检测到。当Y3质量浓度为2.0 μg/mL时,其对烟草花叶病毒侵染心叶烟的抑制率约为50%,亦可抑制宿主Nicotianatabacumvar. K326中该病毒的复制。
2.2 来源于白腐真菌杏鲍菇的Eryngin多肽
Wang等[3]从可食用的白腐真菌杏鲍菇(P.eryngii)的子实体中分离出相对分子质量为10 000的抗真菌肽,命名为Eryngin,其N末端序列与来自蘑菇Lyophyllumshimeiji的抗真菌蛋白有一些相似性。该多肽能抑制尖孢镰刀菌(Fusariumoxysporum)和花生球腔菌(Mycosphaerellaarachidicola)中的菌丝体生长,MIC值分别为1.35、3.5 μmol/L。
2.3 来源于绿色木霉菌的U-22324多肽
Meyer等[4]从绿色木霉菌(T.viride)的1 600 mL发酵液中发现并分离得到了抗菌肽U-22343,在酸性环境(pH=4.6)中沉淀活性物质,用质量浓度1%硅藻土收集沉淀物,用400 mL丙酮萃取,30 ℃浓缩除去丙酮,有机相置于4 ℃冰箱中结晶。将约2.7 g粗品于室温溶解于最小量的无水乙醇,用活性炭吸附杂质,浓缩至约25 mL,加入等体积乙醚,结晶,得产物约1.7 g,其对细菌具有较强的抑制活性,抑制S.aureusUC-76、S.aureusUC-76、S.faecalisATCC-6057、S.hemolyticusC-203、S.viridansUC-155的MIC值分别为62.5、125、31、31、31 μg/mL。对真菌的抑制作用相对较弱,抑制B.dermatitidis、N.asteroides、C.immitis、H.compactum、H.capsulatum和T.mentagrophytesUC-4860的MIC值分别为100、1 000、1 000、1 000、1 000、1 000 μg/mL。
3 真菌来源的含分子内二硫键的抗微生物肽
3.1 来源于巨大曲霉菌的抗微生物肽
Wnendt等[5]从巨大曲霉(A.giganteus)中发现了5 800的多肽,可抑制真菌生长。首先克隆编码该抗真菌多肽的cDNA,构建了cDNA表达文库,经测序发现该抗真菌多肽的cDNA序列由183个核苷酸组成,全长多肽含有60个氨基酸残基。N-末端存在9个氨基酸的前导序列,可能与多肽分泌到细胞外有关。而发挥抗真菌功能的成熟肽由51个氨基酸残基组成,并通过NMR技术解析了其空间结构(图1)。
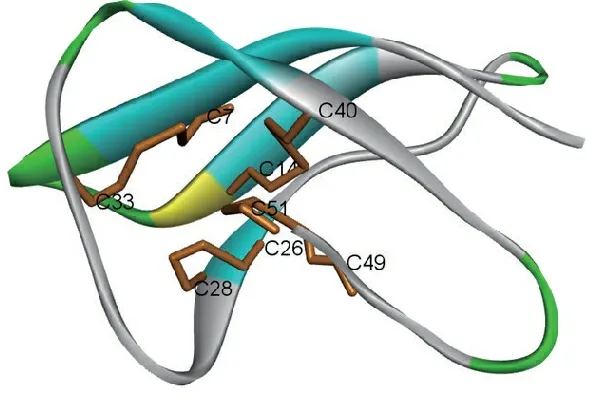
图1 来源于巨大曲霉菌的抗微生物多肽空间结构(PDB: 1AFP)
Figure 1 Structure of antimicrobial peptide derived fromA.giganteus(PDB: 1AFP)
3.2 来源于腐生子囊菌的抗微生物肽Plectasin
Mygind等[6]在2005年首次从北欧松树林中的腐生子囊菌(P.nigrella)中分离出真菌防御素类抗菌肽,命名为Plectasin,对革兰阳性细菌有较好的抑菌活性,特别是对肺炎链球菌和金黄色葡萄球菌的抗菌效果显著,对一些常规抗生素耐药的菌株亦有作用。Plectasin在体外显示出较快的杀菌速度,与临床使用的万古霉素和青霉素相当,且不易产生耐药性,因此与临床使用的传统抗生素之间不具有交叉耐药性。更值得关注的是该多肽对哺乳动物细胞没有毒害作用,且容易透过血脑屏障,在脑脊液中的渗透能力可达到30%以上,显著高于其他常规抗生素。因此,Plectasin具有进一步开发成为新型的抗菌药物的潜力,用于治疗包括中枢神经系统细菌感染在内的感染性疾病,其空间结构见图2。
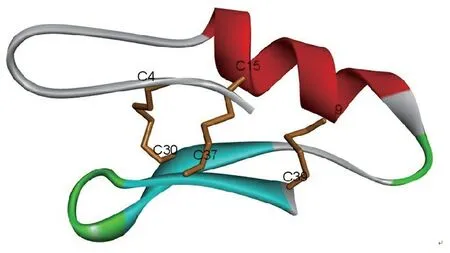
图2 来源于腐生子囊菌抗微生物多肽Plectasin的空间结构(PDB: 1ZFU)
Figure 2 Structure of antimicrobial peptide Plectasin derived fromP.nigrella(PDB: 1ZFU)
3.3 来源于棒曲霉菌的抗微生物肽AcAMP
Hajji等[7]从棒曲霉(A.clavatusES1)的发酵液中分离到了大小约为6 000的抗微生物肽,命名为AcAMP。通过分子生物学相关技术发现该基因由285个核苷酸编码。全长肽由94个氨基酸残基组成,从N端到C端分别为信号肽(1-21位氨基酸残基)、前肽(22-43位氨基酸残基)和成熟肽(44~94位氨基酸残基),为具有抗微生物活性的富含半胱氨酸的碱性多肽。AcAMP在50~200 μg/mL质量浓度范围抑制真菌(A.niger、F.solani、F.oxysporum)的抑菌圈直径在7~15 mm之间。除了抗真菌活性外,AcAMP是第一个来源于真菌的对革兰阳性和革兰阴性细菌均具有抗菌活性的多肽,其抑制细菌S.aureus、B.cereus、M.luteus、E.faecalis、E.coli及P.aeruginosa的MIC值均在10~50 μg/mL范围内。
3.4 来源于产黄青霉的抗微生物肽PAF
Kaiserer等[8]从丝状真菌产黄青霉(P.chrysogenum)培养基上清中分离得到了富含半胱氨酸的碱性多肽Penicilliumantifungalprotein(PAF)。该抗微生物多肽可抑制多种丝状真菌的生长,包括人类条件致病真菌和植物致病真菌,但不抑制细菌和酵母的生长。PAF在50 μg/mL浓度下对A.fumigatus、A.nidulans、A.niger、B.cinerea和T.koningii的抑制率>90%;对A.giganteus、C.carbonum和N.crassa的抑制率在70%~90%之间;对A.flavus、F.oxysporum、G.roseum和P.chrysogenum的抑制率在30%~70%之间。同时PAF亦具有较强的盐稳定性,其空间建构见图3。
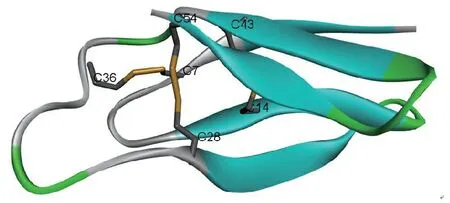
图3 来源于产黄青霉的抗微生物多肽PAF的空间结构(PDB: 2KCN)
Figure 3 Structure of antimicrobial peptide PAF derived fromP.chrysogenum(PDB: 2KCN)
3.5 来源于产黄青霉的抗微生物肽PgAFP
Rodríguez-Martín等[9]从产黄青霉RP42C(P.chrysogenum)菌株中发现了抗微生物多肽,命名为PgAFP,其能显著抑制产毒霉菌的生长。经电喷雾电离质谱(ESI-MS)测定,该多肽的分子量为6494 D,理论等电点为9.22,为阳离子多肽。PgAFP多肽的基因由404核苷酸编码,含有两个内含子(分别为63和62),cDNA序列由279核苷酸编码。PgAFP多肽前体由92个氨基酸残基组成,经剪切被加工成含有58个氨基酸残基的成熟肽。其属于由子囊菌纲产生的具有抗真菌活性的富含半胱氨酸的多肽。由于P.chrysogenum被认为是食品中常见的安全霉菌,因此PgAFP可能可以用于防止食品和农产品中产毒霉菌的生长。通过NMR技术解析PgAFP的空间三维结构见图4。

图4 来源于产黄青霉菌的抗微生物多肽PgAFP的空间结构(PDB: 2NC2)
Figure 4 Structure of antimicrobial peptide PgAFP derived fromP.chrysogenum(PDB: 2NC2)
3.6 来源于黑曲霉的抗微生物肽Anafp
Gun等[10]从丝状真菌黑曲霉(A.niger)的培养物上清液中分离出了抗真菌肽并将其命名为Anafp。该肽由58个氨基酸残基组成,其中包括6个半胱氨酸残基。Anafp抑制丝状真菌(A.flavus、A.fumigatus、F.oxysporum、F.solani、T.beigelii)的MIC值在4~15 μmol/L浓度范围内;抑制酵母类真菌的MIC值在8~15 μmol/L浓度范围内。而对细菌的抑制作用较弱,在浓度为50 μmol/L时对细菌E.coli和B.subtilis均无抑制作用。
3.7 来源于阿姆斯特丹散囊菌的抗微生物肽Eurocin
Oeemig等[11]从阿姆斯特丹散囊菌(E.amstelodami)中发现了具有抗微生物活性的真菌防御素多肽,命名为Eurocin。该多肽由90个氨基酸残基组成,包括信号肽(1~20位氨基酸残基)、前肽(21~48位氨基酸残基)和成熟肽(49~90位氨基酸残基)。成熟肽由42个氨基酸组成,相对分子质量约为4 300,且多肽序列中富含甘氨酸(24%)和半胱氨酸(14%)残基,所含的6个半胱氨酸残基,可形成分子内三对二硫键,结构见图5。

图5 来源于阿姆斯特丹散囊菌的抗微生物多肽Eurocin的空间结构(PDB: 2LT8)
Figure 5 Structure of antimicrobial peptide Eurocin derived fromP.chrysogenum(PDB: 2LT8)
对183种细菌菌株测试了Eurocin的抗微生物活性,对于人类重要的革兰阳性病原菌参考菌株的MIC值分别为:金黄色葡萄球菌(ATCC29213),16 μg/mL;表皮葡萄球菌(ATCC12228),16 μg/mL;屎肠球菌(ATCC49624),16 μg/mL;粪肠球菌(ATCC29212),2 μg/mL;肺炎链球菌(ATCC49619),0.25 μg/mL;但在所测试的革兰阴性菌中没有观察到明显的抗菌活性(MIC≥32 μg/mL)。
3.8 来源于犬小孢子菌的抗微生物肽Micasin
Zhu等[12]从犬小孢子菌(M.canis)中克隆到了真菌防御素样肽(fungal defensin-like peptide,fDLP)Micasin的基因,通过生物信息学分析确定了其成熟肽由38个氨基酸残基组成。通过以化学合成的线性多肽为原料,成功的制备了分子内二硫键定向配对的具有活性御素样肽Micasin,并利用NMR解析了空间结构(图6),其具有典型的半胱氨酸稳定的α-螺旋和β-折叠结构(CS/αβ)。
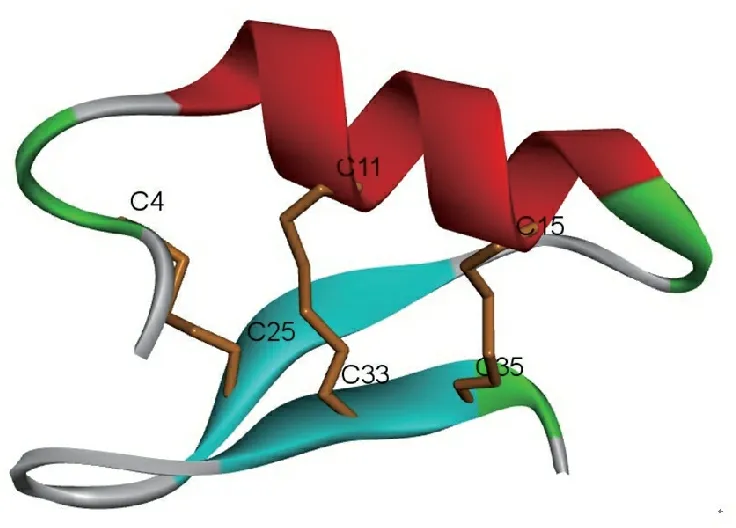
图6 来源于犬小孢子菌的抗微生物多肽Micasin的空间结构(PDB:2LR5)
Figure 6 Structure of antimicrobial peptide Micasin derived fromM.canis(PDB: 2LR5)
Micasin对革兰阳性菌和革兰阴性菌均有活性,重要的是它能以微摩尔浓度杀死2株临床分离的耐甲氧西林金黄色葡萄球菌和机会致病菌铜绿假单胞菌。以非破膜的机制在3 h内杀死几乎全部被处理过的细菌,同时显示出极低的溶血活性和高血清稳定性。
3.9 来源于海洋真菌费希新萨托菌的抗微生物肽NFAP
Kovács等[13]从费希新萨托菌(N.fischeri)培养物上清液中发现了相对分子质量约为6 600的抗微生物多肽NFAP及其编码基因,其成熟肽为由57个氨基酸残基组成的富含半胱氨酸的碱性蛋白。利用分子模拟所构建的该多肽的三级结构表明具有由3个二硫键稳定的5个反平行片的防御素样分子相似空间结构。NFAP以剂量依赖性方式表现出对丝状真菌的生长抑制作用,并且在宽pH和温度范围内保持较高的抗真菌活性。此外,它还表现出对蛋白水解酶的抗性。所有这些特征使NFAP成为可进一步进行体外和体内研究的候选药物,旨在开发成为新的抗真菌活性物质。
3.10 来源于灰盖鬼伞菌的抗微生物肽Copsin
Essig等[14]从白腐菌灰盖鬼伞菌(C.cinerea)中发现了含有6对分子内二硫键的抗微生物多肽Copsin,其成熟肽由57个氨基酸残基组成,通过NMR所解析了该多肽的空间结构(图7),其分子内二硫键的配对方式为Cys18-Cys48、Cys22-Cys50、Cys10-Cys40、Cys3-Cys32、Cys25-Cys57和Cys35-Cys54。Copsin对多种革兰阳性细菌具有杀菌作用,包括人类病原菌如屎肠球菌(E.faecium)和单核增生性李斯特菌(L.monocytogenes)。抗菌机制研究表明,Copsin可以与肽聚糖前体脂质II五肽特异性结合,从而干扰细胞壁的生物合成,该多肽的空间结构见图7。
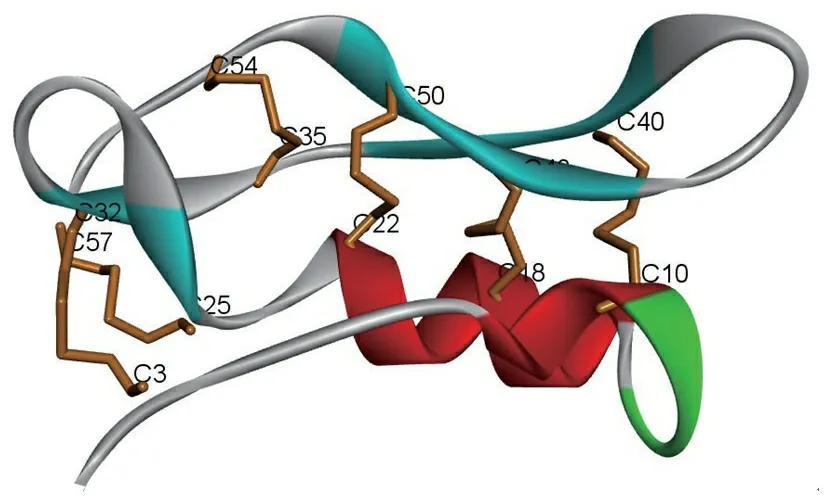
图7 来源于灰盖鬼伞菌的抗微生物多肽Copsin的空间结构(PDB:2MN5)
Figure 7 Structure of antimicrobial peptide Copsin derived fromC.cinerea(PDB: 2MN5)
3.11 来源于费希新萨托菌的抗微生物肽NFAP2
Tóth等[15]从费希新萨托菌(N.fischeri)中发现了第2个富含半胱氨酸的阳离子抗真菌多肽NFAP2(第2个多肽为NFAP[13])。基于产黄青霉(P.chrysogenum)表达系统来批量获得重组NFAP2多肽,同时应用多肽固相合成、天然化学连接以及分子内二硫键定向配对同样制备了完整的NFAP2。重组和合成NFAP2的平均产量分别比天然生产者约分别高40和16倍。两种方式制备的多肽都经过正确加工、折叠,并具有热稳定性。它们显示出与天然NFAP2相同的最小抑制浓度,MIC值分别为:C.albicansATCC10231,6.25 μg/mL;C.glabrataCBS138,1.56 μg/mL;C.guilliermondiiCBS566,1.56 μg/mL;C.kruseiCBS573,12.5 μg/mL;C.lusitaniaeCBS6936,3.125 μg/mL;C.parapsilosisCBS604,1.56 μg/mL;C.tropicalisCBS94,1.56 μg/mL;S.cerevisiaeSZMC0644,3.125 μg/mL;S.pombeSZMC0142,1.56 μg/mL。
3.12 来源于指间毛癣菌的抗微生物肽Triintsin
Shen等[16]分离自临床样本的病原真菌指间毛癣菌(T.interdigitale)中克隆了防御素类抗微生物肽Triintsin的基因,通过基因序列与cDNA序列的比对确定了该基因组织结构,即由2个内含子分隔的3个编码外显子组成。Triintsin的前体肽含有85个氨基酸残基,包括21个残基的N-末端信号肽,26个残基的前肽和38个氨基酸残基的成熟肽。通过同源建模建立的3D结构,Triintsin呈现典型的半胱氨酸稳定的α-螺旋和β-折叠结构(图8)。该肽显示出对革兰阳性和革兰阴性细菌广谱的抗菌活性,同时也显示出一定的抗真菌活性,对临床分离的病原菌亦有显著作用。
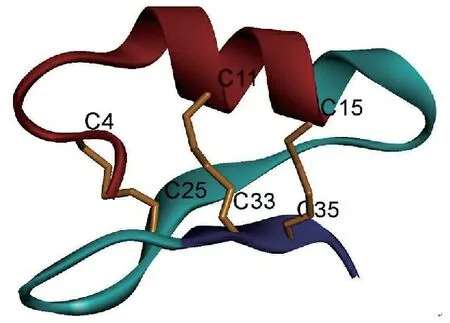
图8 来源于指间毛癣菌的抗微生物多肽Triintsin的空间结构
Figure 8 Structure of antimicrobial peptide Triintsin derived fromT.interdigitale
3.13 来源于禾谷镰孢菌的抗微生物肽FgAFP
3.14 来源于皮炎芽生菌的抗微生物肽Bldesin
Luo等[18]通过生物信息学分析发现了皮炎芽生菌(B.dermatitidis)中存在真菌防御素样抗微生物多肽,并通过生物工程技术进行了原核表达并成功制备了重组多肽Bldesin。抗菌实验测定Bldesin对革兰阳性菌(如金黄色葡萄球菌)具有良好的抑菌活性,而对革兰阴性菌如大肠杆菌等没有作用。电生理实验表明,Bldesin具有Kv1.3通道抑制活性,1 μmol/L浓度的多肽能抑制约40%的Kv1.3通道电流。丝氨酸蛋白酶抑制相关实验表明,Bldesin同时具有独特的胰凝乳蛋白酶、弹性蛋白酶和丝氨酸蛋白酶抑制活性。
4 小结与展望
因微生物感染死亡,特别是那些由耐药微生物引起的死亡,已经成为一个全球性问题,估计到2050年每年将导致1 000万人死于微生物感染[19]。真菌在地球上存在了多长时间至今还不清楚,对真菌的起源也没有确切的结论。真菌的有些特点和植物相似,然而在某些方面又和动物有相似之处。在长期的进化过程中,真菌进化出了独特的抗微生物系统,已经从真菌次生代谢产物中发现了包括青霉素在内的一系列抗生素[20]。除了小分子抗生素外,真菌亦可分泌表达抗微生物多肽,本文对目前发现的来源于真菌的抗微生物多肽进行了系统的总结,这类多肽具有广泛的抗微生物活性(抗细菌、抗真菌、抗病毒)和结构多样性(线性多条、含分子内二硫键的多肽)。希望通过进一步的研究能从中发现具有作为候选药物潜在价值的多肽分子。

