CRISPR/Cas9技术构建Vegf-b敲除斑马鱼模型和心血管发育异常的初探
宋来思,赵海山,吴文富,冯启荣,谭文
(1.广东工业大学生物医药学院,广东 广州 510006; 2.广东省人民医院医学研究部,广东 广州 510080)
血管内皮生长因子b(vascular endothelial growth factor b,Vegf-b)是Vegf家族的一员,其氨基酸序列和Vegf-a高度相似[1],因此,有人认为Vegf-b也是促血管生长因子[2-3]。但是,有人却发现Vegf-b对血管发育影响甚小[4]。事实上,与广泛分布的Vegf-a不同,Vegf-b主要分布在心脏、骨骼肌以及棕色脂肪等能量代谢活性高的组织中[5-6]。近年来,国内外研究进展表明Vegf-b与心肌细胞的存活[1]、线粒体功能[7]和能量代谢[8]有着密切的联系。Kivela等[9]证明了Vegf-b通过激活ERK及Akt信号通路提高线粒体功能,增加心脏能力。Lal等[1]认为Vegf-b一方面通过调控Vegf-a间接促进血管生成,另一面直接促进脂肪酸的代谢,保护心脏。这表明Vegf-b可能是内皮细胞与心肌细胞之间通讯的重要因子,将血管新生与心肌细胞能量代谢联系起来。但上述猜想需要进一步的实验验证。但是,Vegf-b对于能量代谢的调控尚有争议,有人认为Vegf-b使脂肪酸代谢转为糖代谢[10],而有人却认为Vegf-b提高了脂肪酸的代谢[11]。
综上所述,Vegf-b对血管发育及能量代谢的影响尚有争议,有待进一步的验证。此外,Vegf-b是保护心脏的潜在靶点,但是具体的保护机制尚未完全清楚。目前也没有针对Vegf-b靶点的药物,因此,有必要对Vegf-b的生理功能及保护心脏的作用机制进行深入研究,从而为针对Vegf-b靶点新的治疗策略和新药开发提供依据,构建Vegf-b敲除动物模型可以为这个方向的研究奠定基础。
斑马鱼 (zebrafish) 作为脊椎动物整体模型,与常见的爪蟾、小鼠、大鼠等模式动物相比,具有许多明显的优势[12],如(1)产卵多,健康的成年母鱼1周可以产200~300颗胚胎,给各种转基因品种的培育提供足够的筛选样本;(2)胚胎透明,各种器官在显微镜下直接可见,配合特异表达荧光蛋白的转基因鱼系,能够简单便捷地在基因水平进行编辑,在活体状态下观察其发育情况等。转基因斑马鱼系Tg[flk:EGFP]使用flk作为启动子驱动EGFP,以使表达flk的细胞表达绿色荧光,特异性的反映血管内皮细胞的发育情况,应用广泛。如Fernando等用Tg[flk:EGFP]斑马鱼胚胎模型证明了石杉醇提取物(IO)及其组分Ishophloroglucin A(IPA)对高糖诱导的血管生成具有抗血管生成的作用,表明它们在糖尿病相关血管生成中有潜在的治疗作用[13]。
与早期的ZFN,TALENT技术相比,CRISPR/Cas9技术通过单链sgRNA,直接识别DNA序列,并实现高效精确的DNA切割,再利用细胞的非同源末端重组或同源重组对断裂的DNA进行修复,可实现对靶基因的敲除、敲入。CRISPR/Cas9系统整体操作简单,编辑效率高,应用广泛,大大降低了基因编辑的难度[14]。该技术以广泛分布在基因组中的各种序列基因为靶点,因此可以高效的对绝大多数基因进行敲除,用于各种基因功能研究[15]。
因此,本研究中,将利用CRISPR/Cas9技术敲除转基因斑马鱼系Tg[flk:EGFP]的Vegf-b基因,以观察其对心血管发育的影响。
1 仪器与材料
PV830型皮升注射泵 (美国World Precision Instruments公司);Stemi 508型体视显微镜(德国Carl Zeiss公司);Axio Observer A1型荧光倒置显微镜(德国Carl Zeiss公司);LBI-175-N型生化培养箱(上海龙跃仪器设备有限公司)。
Holt buffer配制如下:用量筒量取2 L ddH2O,置于烧杯中,使用磁力搅拌器进行搅拌,依次加入7.000 g NaCl,0.400 g NaHCO3,0.100 g KCl和0.235 g CaCl2,用一次性真空过滤器(孔径0.22 μmol/L)过滤后常温储存备用。
实验动物为转基因斑马鱼系Tg[flk:EGFP],北京大学深圳研究生院Lin Lab慷慨赠送,年龄在3~12个月,按照国家斑马鱼资源中心指导建议饲养繁殖。
2 方法
2.1 sgRNA设计和鉴定引物设计
根据斑马鱼的Vegf-b基因序列进行sgRNA设计。本研究设计了2个sgRNA(表1),显微注射到斑马鱼胚胎,用碱裂法提基因组DNA,PCR扩增后测序评价其有效性。sgRNA 有效性鉴定及基因敲除斑马鱼筛选所需引物设计见表2。

表1 Vegf-b sgRNA靶位点核苷酸序列Table 1 Vegf-b sgRNA target nucleotide sequences

表2 Vegf-b sgRNA鉴定和筛选引物序列Table 2 Vegf-b sgRNA identification primer sequences
测序检测sgRNA有效性使用上下游引物双向测定,其余筛选只用上游引物正向测序。
2.2 斑马鱼胚胎的获取
在注射前1天下午喂食后1 h,挑选健康的转基因斑马鱼系Tg[flk:EGFP]雌雄各6条,一雄一雌置于配种缸里,中间用隔板隔开。次日上午9:00抽走隔板,让雄雌鱼自由交配0.5 h,产卵后10 min内收集胚胎,挑选200枚健康的胚胎并在单细胞阶段进行显微注射。注射结束后,置于培养皿中,加入适量Holt buffer在28.5 ℃培养箱中培养。
2.3 显微注射
将25 ng/nL sgRNA和250 ng/nL Cas9 RNA混匀,注射2 nL到斑马鱼胚胎。胚胎置于培养皿中,加适量Holt buffer水在28.5 ℃培养箱中饲养。
2.4 sgRNA有效性的鉴定和转基因斑马鱼筛选
显微注射后的胚胎F0代在24 hpf(hours post-fertilization)用碱裂法提基因组DNA,PCR扩增后测序评价sgRNA的有效性。让F0代与同品系的野生型斑马鱼杂交,胚胎测序筛选出稳定遗传的founder。让founder与同品系的野生型杂交得到F1代,待F1代成年后用碱裂法测序鉴定筛选出敲除的杂合子斑马鱼Vegf-b+/-,通过基因克隆测序鉴定杂合子F1代的基因型。让F1代杂合子与同品系的野生型杂交得到F2代,同样的方法测序鉴定筛选出基因型相同的F2代杂合子,再让其自交获得F3代,待F3代成年后用同样的方法测序鉴定,最终筛选出敲除的纯合子斑马鱼Vegf-b-/-(图1)。
2.5 基因克隆测序
用pEASY®-T1 Simple Cloning Kit(Transgen,CT111)进行克隆,常温将4 μL目的基因PCR产物和1 μL pEASY®-T1 Simple Cloning Vector混匀,置于冰上5 min,反应结束后进行转化:往连接产物中加入50 μL Trans-T1感受态细胞,轻弹混匀,置于冰上30 min。42 ℃水浴热激30 s,立即置于冰上2 min。加200 μL SOC,放置在摇床上,转速200 r/min,37 ℃培养1 h。同时,取16 μL浓度为500 mmol/L的IPTG和40 μL浓度为20 mg/mL X-gal混匀,均匀涂在Amp+平板上,37 ℃培养箱中放置1 h。待IPTG和X-gal被吸收后,取100 μL菌液均匀涂在平板上,在37 ℃培养箱中培养过夜。次日,挑选8个单克隆PCR后送测序。

图1 基因敲除斑马鱼模型的构建过程
Figure 1 Process of construction of gene knockout zebrafish model
2.6 斑马鱼胚胎心血管发育评价
为评价敲除Vegf-b对斑马鱼心血管发育的影响,将同品系的野生型(control组)和敲除Vegf-b(Vegf-b组)的F3代杂合子分别自交,收集胚胎。在24 hpf (受精后小时数)用24孔板进行铺板,每孔20枚胚胎和1 mL Holt buffer水,每组重复3孔。在96 hpf(受精后小时数),观察胚胎的发育情况。在凹面载玻片上滴加1滴4%甲基纤维素,用于固定胚胎。将胚胎固定在固定液上,在体视显微镜下调整好胚胎的位置,使两眼重合,身体保持平直,用荧光倒置显微镜EGFP通道观察血管并拍照,明场通道观察心脏并拍照。实验重复3次。
2.7 统计学分析
测序峰图用Seqscanner进行分析,序列用SerialCloner进行比对,斑马鱼图片用Photoshop进行裁剪。
3 结果
3.1 sgRNA有效性的检测
测序结果显示,sgRNA1(图2 A)出现明显的套峰,且重叠峰出现在Vegf-b靶位点(黑色线框所标注的序列)酶切位点附近,而sgRNA2为单峰(图2 B),确定sgRNA1诱导突变有效,因此,本研究使用sgRNA1进行下一步的实验。
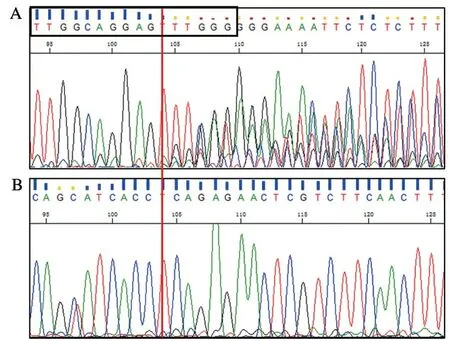
A. sgRNA1; B. sgRNA2。
图2 sgRNA有效性检测结果
Figure 2 sgRNA validity test results
3.2 Vegf-b敲除斑马鱼的构建及筛选
F0代嵌合体成年后与同品系的野生型杂交,胚胎通过碱裂法测序,不能稳定遗传的F0代只有单峰,可以稳定遗传的有明显套峰,称之为founder(图3 A)。让founder与野生型杂交获得F1代,待F1代成年后用碱裂法测序,没有基因突变的野生型只有单峰,有基因突变的斑马鱼杂合子Vegf-b+/-有明显套峰(图3 B)。对F1代敲除杂合子进行基因克隆测序,发现其基因序列缺失TC 2 bp碱基(图3 C)。让缺失TC 2 bp 的F1代杂合子和野生型杂交获得F2代,待F2代成年后用相同方法筛选出基因型相同的F2代敲除杂合子,野生型只有单峰,F2代敲除杂合子有明显套峰(图3 D)。让F2代敲除杂合子Vegf-b+/-自交,相同的方法进行筛选,发现杂合子Vegf-b+/-有明显套峰,没有基因突变的野生型或者有基因突变的纯合子Vegf-b-/-(图3 E)只有单峰,进一步通过序列比对发现,野生型碱基没有缺失,纯合子Vegf-b-/-缺失TC 2 bp碱基(图3 F)。最终获得可稳定遗传的Vegf-b敲除的斑马鱼系。

A. F0代野生型和founder; B. F1代野生型和F1代杂合子; C. F1代杂合子序列; D. F2代野生型和F2代杂合子; E. F3代杂合子、F3代野生型和 F3代纯合子; F. F3代野生型序列和 F3代纯合子序列。
图3Vegf-b敲除斑马鱼系鉴定结果
Figure 3 Identification outcome ofVegf-bknockout zebrafish line
3.3 斑马鱼胚胎心血管发育评价
control组所有胚胎血管发育正常,可观察到发育完整的血管结构。体节间血管(intersegmental blood vessels,ISVs)从背部主动脉侧(dorsal aorta,DA)延伸到纵向背侧吻合血管(dorsal longitudinal anastomotic vessels,DLAVS)。心脏呈S型,侧面观察心脏心室和心房部分重叠,心血管系统无形态学改变(图4 A)。Vegf-b组部分胚胎血管发育受损,表现为体节间血管变细,内皮细胞受损(红色箭头),严重者体节间血管发育不全,表现为体节间血管未从背部主动脉侧(DA)延伸到纵向背侧(DLAVS)吻合血管(黄色箭头)。心脏出现明显的心包膜水肿(红色箭头),卵黄囊肿大(蓝色箭头),心脏畸形且线性化,心室变小,体节间血管血流缓慢或者无血液循环等多种形态改变(图4 B)。
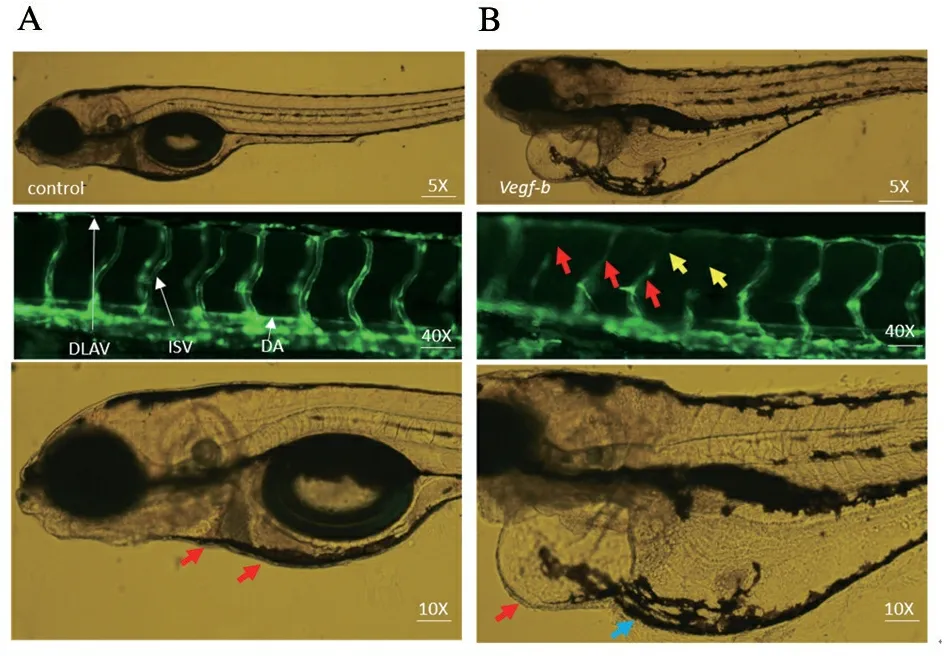
A. control组; B.Vegf-b组。
图4 敲除Vegf-b对心血管发育的影响
Figure 4 Effect of knockoutVegf-bon embryonic vascular development
4 讨论
Vegf-b是Vegf家族的一员,但不同于Vegf-a是公认的促血管生长因子,它对血管内皮细胞的影响尚未明晰。有人认为Vegf-b促进血管新生[16],尤其是冠状动脉血管的发育。Kupatt等发现过表达Vegf-b使心肌缺血或心梗的小鼠心脏毛细血管的密度增加[17]。有人却认为,Vegf-b对血管发育的影响甚小或者抑制血管,Mould等发现敲除Vegf-b的小鼠,炎症相关滑膜血管生成减少[18]。
转基因斑马鱼系Tg[flk:EGFP]内皮细胞特异性的表达绿色荧光,反映血管内皮细胞的发育情况,能够在活体状态下直接观察Vegf-b对血管发育的影响。CRISPR/Cas9系统是在原核生物CRISPR/Cas9技术基础上进行改造,从而应用于真核生物的一种基因编辑技术。与传统的TALEN和ZFN技术对比,CRISPR/Cas9具有许多优势。TALEN和ZFN都是蛋白质引导的DNA切割,但蛋白质合成、选择和验证过程复杂且耗时。CRISPR/Cas9是由sgRNA引导,短且方便设计,成本低且易于生产[19]。CRISPR/Cas9可在多个独立位点进行基因修饰[20]。目前只有morpholinos敲降Vegf-b的斑马鱼模型,认为Vegf-b对斑马鱼的视网膜血管发育有影响,但未发现其对体节间血管的发育有损伤[21]。
本研究针对Vegf-b3号外显子设计了2个sgRNA,证明了sgRNA1效率高,通过三代筛选得到缺失TC 2bp稳定遗传系,成功建立Vegf-b移码突变的敲除斑马鱼系。进一步研究发现,敲除Vegf-b会导致胚胎血管发育受损,表现为体节间血管变细,严重者发育不全,证明了Vegf-b对血管发育有重要作用。同时,这也说明了基因敲除技术和morpholinos敲降技术有不同表型,前者可以构建出稳定遗传的基因编辑斑马鱼品系,是后续研究Vegf-b功能的重要模型。
此外,本研究还意外发现敲除Vegf-b会导致心脏出现心包膜水肿,这表明Vegf-b可能对心脏的发育及功能有重要影响。有研究也发现缺失Vegf-b的小鼠心脏小于正常小鼠心脏,其心脏功能的恢复能力也弱于正常鼠[22]。这提示Vegf-b的功能不仅仅局限于血管方面,同时与心脏发育及功能有重要的关系。Mehlem等认为Vegf-b可能通过PGC-1α/ERR-α通路调控脂肪酸,影响线粒体能量代谢,从而保护心脏[23]。稳定遗传的Vegf-b敲除斑马鱼系将成为研究Vegf-b功能和分子机制的重要工具。
综上所述,本研究使用CRISPR/Cas9技术敲除转基因斑马鱼系Tg[flk:EGFP]的Vegf-b基因,成功构建Vegf-b敲除的Tg[flk:EGFP]斑马鱼系,本研究发现敲除Vegf-b导致胚胎血管发育受损以及心脏心包膜水肿,表明Vegf-b对心血管发育具有重要作用,为未来深入研究Vegf-b功能提供稳定可靠的动物模型。

