尿素包合法富集驼峰油中不饱和脂肪酸的工艺优化
张 霞,郝晓丽,何 静,吉日木图,2
(1.内蒙古农业大学 乳品生物技术与工程教育部重点实验室,呼和浩特 010018;2.内蒙古骆驼研究院,内蒙古 巴丹吉林 737300)
我国是世界上双峰骆驼主要产地之一[1],主要分布在新疆、内蒙古、青海、 甘肃等省的戈壁和草原上。研究表明,成年双峰驼驼峰占其体重的20%[2],驼峰中90%是脂肪。研究证实,驼峰脂肪中富含VA(5.6 mg/kg)和VE(19.4 mg/kg)[3],有较低含量的胆固醇[2],双峰驼较单峰驼有较高含量的α-亚麻酸,所以双峰驼的驼峰脂肪具有极高的研究价值。
骆驼脂肪营养丰富、性质稳定,是食品、化妆品及化工行业的优质资源,将精炼驼峰油进一步富集不饱和脂肪酸,可提高其经济价值。目前,研究人员对于不饱和脂肪酸的富集研究多为植物油和海洋生物油等,畜类动物油相对较少,骆驼油脂的不饱和脂肪酸富集更是少见。富集不饱和脂肪酸常用的方法有超临界流体萃取法、分子蒸馏法、柱层析法、冷冻结晶法及尿素包合法等[4-7]。尿素包合法成本低、设备简单、易操作[8-11]。因此,本研究采用尿素包合法富集精炼驼峰油中的不饱和脂肪酸,以碘值为指标,探究脲脂比、脲醇比、包合温度、包合时间对包合效果的影响,通过响应面法优化富集工艺,并对其脂肪酸组成及含量进行分析测定。
1 材料与方法
1.1 试验材料
精炼驼峰油,内蒙古骆驼研究院;95%乙醇、氢氧化钾、尿素、正己烷、环己烷、冰乙酸、浓盐酸、碘化钾、一氯化碘、氢氧化钠、氯化钠、无水硫酸钠、重铬酸钾、淀粉、硫代硫酸钠等,均为分析纯,北京索莱宝科技有限公司;37种脂肪酸甲酯混合标准品。
PL303电子天平,梅特勒-托利多仪器(上海)有限公司;JC-HH-S24恒温水浴锅;SHZ-D(Ⅲ)循环水式多用真空泵;IKA RV10旋转蒸发仪;CLT-1A型智能磁力搅拌电热套;GC7890B气相色谱仪。
1.2 试验方法
1.2.1 混合脂肪酸的制备[12]
称取100 g精炼驼峰油预热,将22.5 g KOH、175 mL 95%乙醇、87.5 mL超纯水与预热驼峰油加入三口瓶中,80℃下回流2 h,冷却至室温后用6 mol/L的HCl调pH至2~3,加入正己烷于分液漏斗中萃取两次,静置,弃水层,超纯水水洗有机相至中性,70℃旋转蒸发除去正己烷,得到混合脂肪酸。
1.2.2 不饱和脂肪酸的富集
称取20 g混合脂肪酸,加入一定比例95%乙醇和尿素,80~85℃下回流至溶液均匀混合或澄清,冷却至室温,相应温度下包合一定时间后抽滤,分离固相结晶物,将滤液用盐酸调pH至2~3,正己烷萃取有机相,5% NaCl溶液水洗至中性,旋转蒸发除去正己烷,得到富集后的不饱和脂肪酸。富集效果衡量指标为碘值和得率。碘值的测定,参照GB/T 5532—2008。不饱和脂肪酸得率按下式计算。
Y=m1/m×100%
式中:Y为不饱和脂肪酸得率;m1为尿素包合富集后不饱和脂肪酸质量,g;m为混合脂肪酸的质量,g。
1.2.3 脂肪酸组成及含量的测定
采用三氟化硼催化油脂甲酯化,以脂肪酸甲酯标样的保留时间定性,面积归一化法定量。
气相色谱条件:SP2560色谱柱(100 m×0.25 mm×0.2 μm);FID检测器;柱箱温度120℃保持5 min,以3℃/min升至230℃,保持3 min,以1.5℃/min升至240℃,保持13 min;检测器温度260℃;汽化室温度260℃;氢气流速30.0 mL/min;空气流速300.0 mL/min;氮气流速1.0 mL/min;进样量1.0 μL;分流比10∶1。
1.2.4 数据分析
利用GraphPadPrism 6作图分析并借助Design Expert8.0进行响应面优化试验及数据分析。对样品进行3次平行测定,取平均值。
2 结果与分析
2.1 单因素试验
2.1.1 脲脂比对包合效果的影响
在包合温度0℃,尿素质量与95%乙醇体积比(脲醇比,下同)3∶8,包合时间18 h,尿素与混合脂肪酸质量比(脲脂比,下同)分别为2∶1、2.5∶1、3∶1、3.5∶1、4∶1、4.5∶1的条件下考察包合效果,结果见图1。
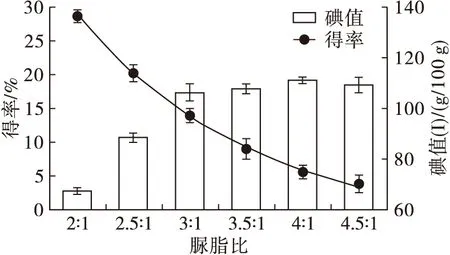
图1 脲脂比对包合效果的影响
由图1可知:随着脲脂比的增加,碘值呈上升趋势,尿素用量较少时,碘值较小,包合效果差,富集后产物常温下呈固液浑浊状;当脲脂比为3∶1时,碘值上升显著,富集后产物常温下呈澄清液态;当尿素用量继续增加时,碘值稍有增加,但是上升趋势平缓。随着脲脂比的增加,得率下降趋势显著,脲脂比2∶1时,得率为29%,但是碘值最低;脲脂比3∶1 时,得率为15%,脲脂比3.5∶1时,得率下降到10%并且仍在减少,但是碘值变化趋势平缓;由于尿素用量过多,不能够与乙醇充分溶解,抽滤过程中产物损失较大。因此,综合考虑选择脲脂比3∶1为最适条件。
2.1.2 脲醇比对包合效果的影响
在包合温度0℃,包合时间18 h,脲脂比3∶1,脲醇比分别为3∶6、3∶7、3∶8、3∶9、3∶10、3∶11条件下考察包合效果,结果见图2。
由图2可知,随着脲醇比的增加,碘值先上升后下降,当脲醇比为3∶8时,碘值达到最大。尿素包合过程中,乙醇作为溶剂,当乙醇较少时,尿素不能被充分溶解,尿素与饱和脂肪酸形成结晶体不充分,导致包合效果差;当乙醇用量过大时,尿素过度分散在乙醇中,不能很好地与饱和脂肪酸形成结晶体,导致碘值下降明显。脲醇比对于富集后得率影响较小,脲醇比为3∶6~3∶11,得率仅为10%~15%,由于乙醇的增加,油脂游离在乙醇中,有些饱和脂肪酸也不能很好地与尿素形成结晶体,导致富集后得率上升,碘值降低。综合考虑,选择脲醇比3∶8为最适条件。
2.1.3 包合温度对包合效果的影响
在脲脂比3∶1,脲醇比3∶8,包合时间18 h,包合温度分别为-20、-10、0、10、20℃条件下考察包合效果,结果见图3。

图3 包合温度对包合效果的影响
由图3可知,随着包合温度的升高碘值变化范围较小,包合温度对于包合效果影响较小。温度对尿素包合反应影响较为复杂,一方面升高温度加快反应速率,另一方面升高温度也有利于化学平衡向吸热反应方向移动[13]。当包合温度为0℃时碘值最高。尿素包合过程一般在低温状态下能够很好地形成结晶体,但是温度过低时碘值和得率偏低,当温度达到20℃时,碘值较低,富集后得率增加,此时产物呈现固液浑浊状,包合效果较差。因此,综合考虑选择0℃为最佳包合温度。
2.1.4 包合时间对包合效果的影响
在脲脂比3∶1,脲醇比3∶8,包合温度0℃,包合时间分别为6、12、18、24、30 h条件下考察包合效果,结果见图4。
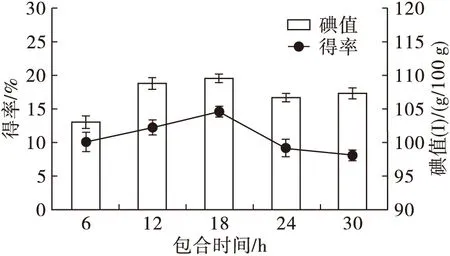
图4 包合时间对包合效果的影响
由图4可知:当包合时间为6 h时,碘值相对较低,富集后得率相对较低,产物呈浑浊状,包合不充分;包合时间为12 h时,碘值上升,18 h时碘值最高,得率也最高;之后随着包合时间的延长碘值下降不明显,但是得率呈明显下降趋势,可能部分低不饱和脂肪酸也形成包合物,从而导致得率下降。综合考虑,选择包合时间18 h为宜。
2.2 响应面优化试验
2.2.1 响应面试验设计
在单因素试验基础上,采用Box-Behnken模型,以碘值为响应值,根据单因素试验确定脲醇比为3∶8,以脲脂比、包合时间、包合温度为主要考察因素,进行响应面优化试验。响应面试验因素水平见表1,响应面试验设计和结果见表2。

表1 响应面试验因素水平
表2 响应面试验设计和结果
续表2
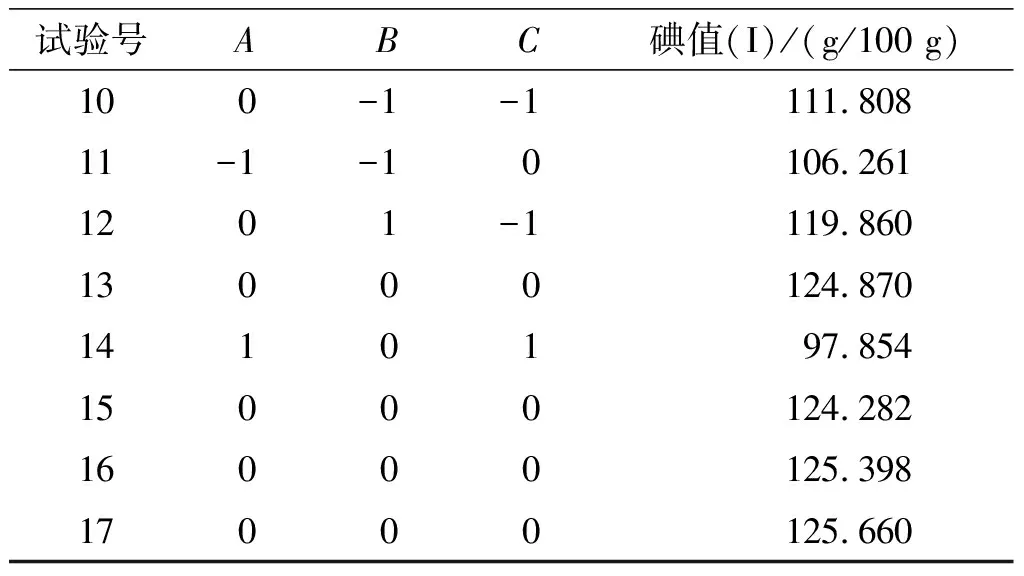
试验号ABC碘值(I)/(g/100 g)100-1-1111.80811-1-10106.2611201-1119.86013000124.8701410197.85415000124.28216000125.39817000125.660
2.2.2 模型建立及显著性分析
应用Design-Expert 8.0对试验数据进行多元回归拟合,得到碘值(Y)的回归方程为:Y=126.34+5.11A-0.66B-3.09C+1.08AB-5.38AC-2.51BC-15.47A2-3.67B2-9.02C2。
回归模型的方差分析见表3。
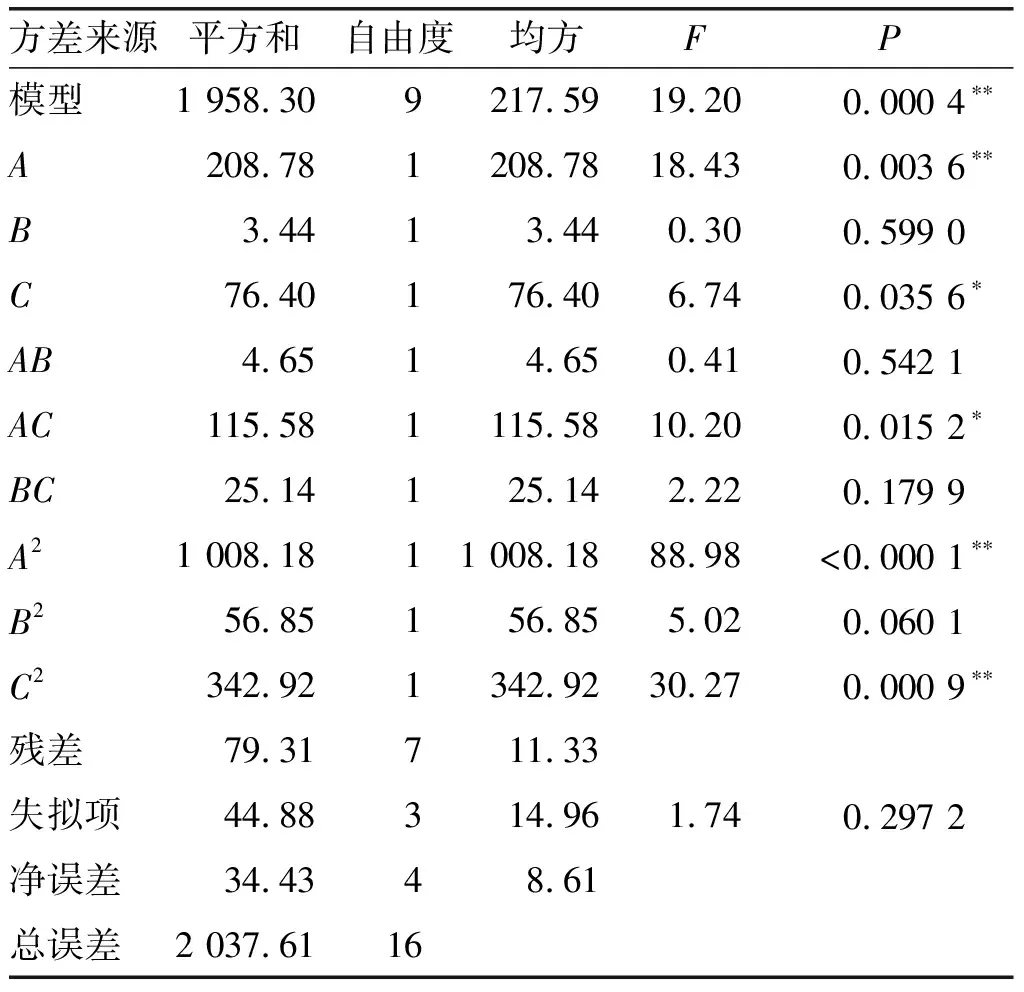
表3 回归模型的方差分析
注:差异显著P<0.05(*);差异极显著P<0.01(**)。
由表3可知:方差分析模型极显著,失拟项不显著,表明此模型与实际情况相拟合;脲脂比、包合温度对包合效果影响极显著、显著;脲脂比与包合温度交互作用影响显著;脲脂比、包合温度二次项影响极显著。由此可见各因素对产物碘值的影响顺序依次为A(脲脂比)>C(包合温度)>B(包合时间),即尿素用量影响最大,包合温度影响次之,包合时间影响最小。
2.2.3 富集工艺的优化与验证
根据回归模型分析,通过Design-Expert 8.0软件得到尿素包合法最优工艺条件为脲脂比3.315∶1、包合温度-2.37℃、包合时间18.13 h,在此条件下产物碘值(I)为127.23 g/100 g,以富集工艺优化条件进行验证试验,测定尿素包合后产物的碘值,3组试验碘值(I)的平均值为125.73 g/100 g。由于动物油脂所含不饱和脂肪酸相对较少,碘值一般较低,但是试验结果碘值相对较高,并且与预测值结果相近,说明此模型方程与实际情况拟合度较好,响应面优化尿素包合富集驼峰油中不饱和脂肪酸的方法是可行的。
2.3 尿素包合前后脂肪酸组成及含量
将包合前后脂肪酸组成及含量进行对比分析,结果见表4。
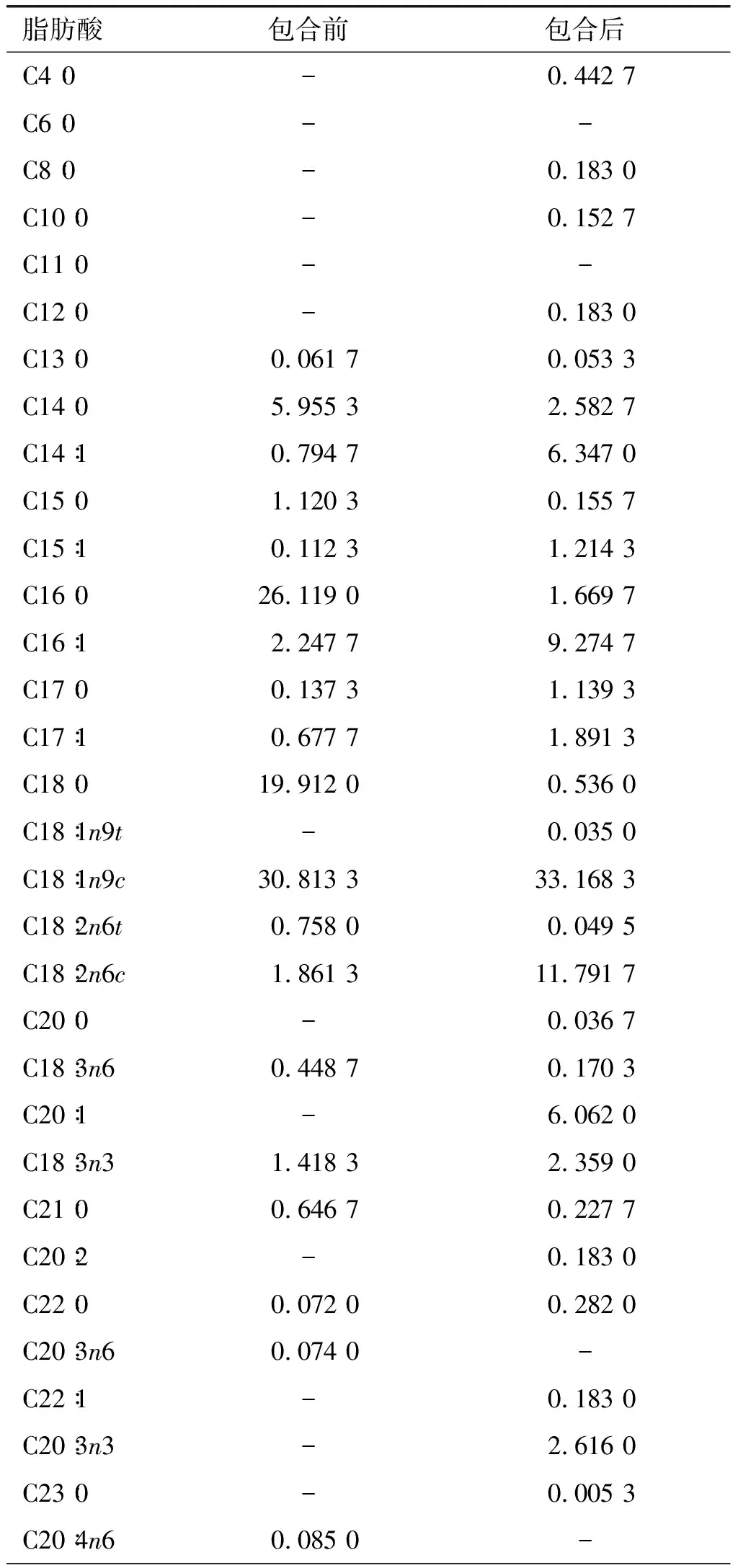
表4 尿素包合前后37种脂肪酸组成及含量 %
续表4 %
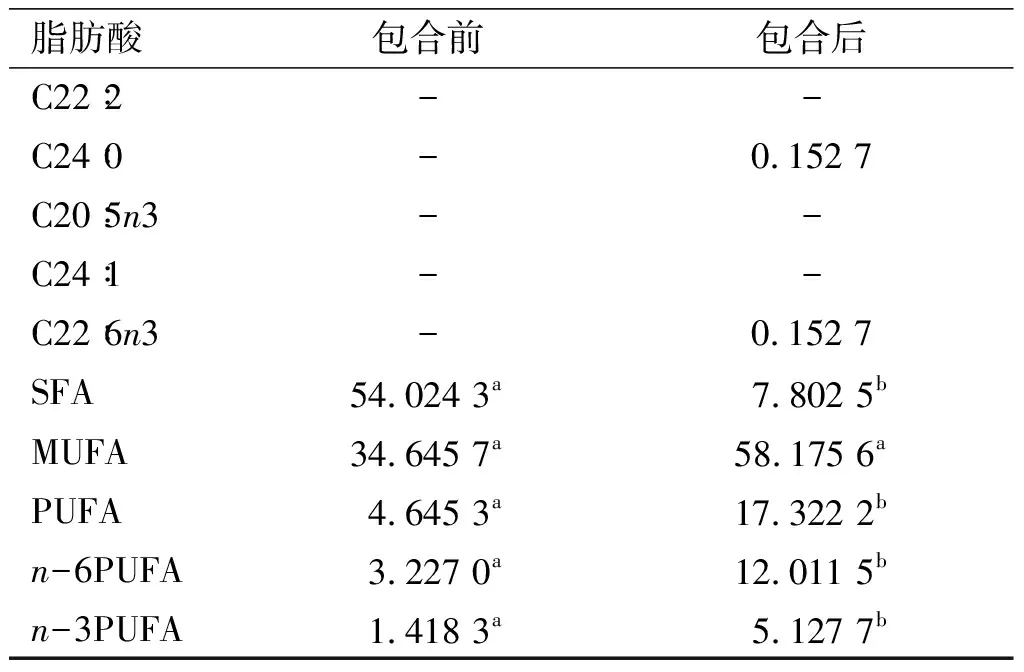
脂肪酸包合前包合后C22∶2--C24∶0-0.152 7C20∶5n3--C24∶1--C22∶6n3-0.152 7SFA54.024 3a07.802 5bMUFA34.645 7a58.175 6aPUFA04.645 3a17.322 2bn-6PUFA03.227 0a12.011 5bn-3PUFA01.418 3a05.127 7b
注:同一行不同小写字母表示差异显著(P<0.05)。
研究表明,人体过多摄入饱和脂肪酸时会导致高血脂、糖尿病、动脉粥样硬化等疾病[14]。由表4可知:尿素包合前后SFA含量分别为54.024 3%、7.802 5%,降低约46个百分点,差异显著(P<0.05),其中棕榈酸和硬脂酸含量下降极为明显;尿素包合前后MUFA含量分别为34.645 7%、58.175 6%,增加近24个百分点,其主要成分为油酸,包合后油酸含量增长约3个百分点,说明尿素包合驼峰油时降低了油酸的损耗;尿素包合前后PUFA含量分别为4.645 3%、17.322 2%,包合后增长约13个百分点,与已见报道中所测家禽类相比,接近鸡油(15.53%)[15]。包合前后PUFA/SFA分别为0.086 0、2.220 1,差异显著(P<0.05),说明包合后富集多不饱和脂肪酸效果明显。包合前后n-6PUFA含量分别为3.227 0%、12.011 5%,其中主要增长的成分为亚油酸。而包合前后n-3PUFA含量分别为1.418 3%、5.127 7%,增加近4个百分点。上述结果表明,尿素包合后产物成分多为不饱和脂肪酸,并且外观为淡黄色黏稠液态。
3 结 论
本试验在单因素试验的基础上,通过响应面分析法确定尿素包合富集驼峰油中不饱和脂肪酸的最佳工艺条件为尿素质量与95%乙醇体积比3∶8、尿素与混合脂肪酸质量比3.315∶1、包合温度-2.37℃、包合时间18.13 h,在此条件下产物中的饱和脂肪酸含量为7.802 5%,比包合前降低约46个百分点,不饱和脂肪酸含量约为75%。

