牦牛HDAC8基因特征及其在组织和卵母细胞成熟过程中的表达分析
秦文昌,殷 实,李泽沛,王 斌,杨柳青,周婧雯,李 键
(西南民族大学 生命科学与技术学院,青藏高原动物遗传资源保护与利用教育部重点实验室, 青藏高原动物遗传资源保护与利用四川省重点实验室,四川 成都 610041)
牦牛(Bosgrunniens)作为青藏高原及毗邻地区特有的牛种资源,能为当地牧民提供大量的生产生活资料。但是,牦牛存在性成熟延迟、低繁殖力及生产性能低下等缺陷[1],制约着牦牛体细胞克隆与体外受精等繁殖辅助技术的发展及应用,进而影响牦牛的种群繁殖及经济效益。因此,针对牦牛的生殖细胞特征进行研究具有重要的现实意义。
组蛋白乙酰化是由组蛋白乙酰转移酶(Histone acetyltransferase,HATs)与组蛋白去乙酰化酶(Histone deacetylase,HDAC)共同调节的可逆过程[2]。乙酰化修饰多发生于H3组蛋白和H4组蛋白的6个赖氨酸位点上(H3K9、H3K14、H4K5、H4K8、H4K12和H4K16)。HDACs是一类平衡染色质重塑中HAT乙酰化活动的酶类,在调节基因转录中发挥重要作用[3]。迄今,有4 类HDAC已在哺乳动物中被确认,Ⅰ类(HDAC1~3和HDAC8);Ⅱ类(HDAC4~6、HDAC7A、HDAC9 及HDAC1); Ⅲ类(SIRT1~7)和IV类(HDAC11)[4]。通过HDACs的作用可以将组蛋白赖氨酸上乙酰化的ε-氨基的乙酰基去除,降低体内乙酰化水平,使DNA与转录因子的结合受阻,转录过程受到抑制[5]。
组蛋白去乙酰化参与卵母细胞基因表达的调控及染色质结构的改变, 在卵母细胞的生长发育中发挥关键作用[6-7],是卵母细胞成熟及染色体正确分离的关键。卵母细胞中HDAC1和HDAC2的缺乏导致组蛋白乙酰化程度增加且卵泡发育停滞于次级卵泡阶段[8]。组蛋白去乙酰化酶对猪和小鼠卵母细胞成熟过程的正常进行是必需的,在小鼠MⅡ期卵母细胞中发生组蛋白去乙酰化,这种去乙酰化均发生于核心组蛋白特定的赖氨酸位点,组蛋白H3K9ac、H3K18ac、H4K5ac、H4K12ac及H4K16ac的水平随着卵母细胞的发育显著上调[9-10]。此外,在减数分裂过程中,抑制HDAC导致卵子的非整倍性及后续胚胎的死亡[11]。表明卵母细胞成熟过程中,正常染色体功能的维持需要HDAC的参与。在GV期卵母细胞体外培养过程中添加HDAC抑制剂TSA,卵母细胞的成熟被阻止在减数分裂前期,表明卵母细胞的成熟及后续胚胎的发育与组蛋白乙酰化修饰表达模式的改变密切相关[12]。
组蛋白去乙酰化酶8(Histone deacetylases 8,HDAC8)是Ⅰ类锌离子依赖性组蛋白去乙酰化酶,存在H4组蛋白第16位赖氨酸残基的乙酰化修饰(Histone H4 Lys16 acetylation,H4K16ac)和H4组蛋白第20位赖氨酸残基的乙酰化修饰(Histone H4 Lys20 acetylation,H4K20ac)[13-14]。对HDAC8的研究表明,其广泛参与各类生物学过程,在低等动物如血吸虫中抑制HDAC8可导致体外培养的血吸虫幼虫死亡,并使成虫的生殖器官发生改变,导致虫对分离和排卵停止[15]。HDAC8还可以调控多种细胞进程,如姐妹染色单体分离、维持微管完整性和肌肉收缩等[16]。此外,Zhang等[17]研究发现,HDAC8广泛分布于小鼠GV期卵母细胞的细胞质中。生发泡破裂(Germinal vesicle breakdown,GVBD)后,HDAC8开始积聚于染色体周围,在MⅠ和MⅡ期定位于纺锤体极,并积极参与小鼠卵母细胞中纺锤体组装和染色体排列的调控,维持减数分裂过程中卵母细胞染色体的整倍性。利用siRNA干扰HDAC8表达后,导致小鼠卵母细胞纺锤体严重缺陷、卵母细胞纺锤体向皮质迁移、染色体排列异常、卵母细胞MⅠ期阻滞及第一极体排出率下降。表明HDAC8参与卵母细胞减数分裂过程中纺锤体组装和染色体排列等过程,进而影响小鼠卵母细胞减数分裂的进程。
目前,关于HDAC8的相关研究主要集中在小鼠等模式动物上,而在牦牛组织器官及卵母细胞成熟过程中的作用研究尚未见报道。因此,本研究将牦牛作为试验对象,通过RT-PCR方法克隆牦牛HDAC8基因序列,并通过生物信息学方法分析其序列及蛋白理化性质,qRT-PCR技术检测HDAC8在牦牛组织及卵母细胞成熟过程中的表达规律,为进一步揭示该基因在牦牛生殖繁育中的调控作用提供数据支持。
1 材料和方法
1.1 试验材料
1.1.1 牦牛组织样本的采集 牦牛屠宰后立即采集其肺脏、肝脏、肌肉、卵巢、脾脏、乳腺、睾丸、肾脏、胃和心脏组织,编号后置于液氮内保存备用,组织样本均采自成都青白江区屠宰场。
1.1.2 主要试剂及器材 PrimeScriptTMRT Reagent Kit反转录试剂盒、SYBR®Premix Ex TaqTMⅡ试剂盒、DNA聚合酶Premix TaqTM、DH5α感受态细胞、pMD-19T Vector(TaKaRa,大连);TRIzol Reagent(Invitrogen,美国),DNA胶回收试剂盒(Axygen,北京);Gibco M199培养基(Gibco,澳洲);卵母细胞成熟液(M199+10%胎牛血清(Fetal bovine serum,FBS)+0.01 μg/L促卵泡生长激素(Follicle-stimulating hormone,FSH)+0.01 μg/L促黄体生成素(Luteinizing hormone,LH)+0.01 μg/L雌二醇(Estradiol,E2)+0.02 ng/L表皮细胞生长因子(Epidermal growth factor,EGF));荧光定量PCR仪(Biodine rad,美国),细胞培养箱(Thermo,美国)。
1.2 试验方法
1.2.1 牦牛卵丘-卵母细胞 (Cumulus-oocyte compplex,COCs)的成熟培养 采集的牦牛卵巢用37 ℃无菌生理盐水冲洗3次,使用10 mL注射器抽取卵巢表面直径在2~8 mm卵泡的卵泡液。抽取的卵泡液置于60 mm培养皿中,并置于体视显微镜下挑拣COCs。将挑拣的COCs置于卵母细胞成熟液中洗3次,然后转移至平衡好的卵母细胞成熟液中,在饱和湿度,5% CO2,38.5 ℃条件下进行体外培养[18]。对应培养时长分别收集GV(0 h)、MⅠ(12 h)和MⅡ期(24 h)的COCs,经0.5%透明质酸酶去除卵丘细胞,置于去RNA酶的离心管中。
1.2.2 总RNA的提取与cDNA的合成 按照TRIzol法和Single Cell-to-CtTMKit (Invitrogen,美国) 试剂盒说明书,分别提取牦牛组织和卵母细胞的总RNA,并使用核酸分析仪测定总RNA的纯度和浓度。将OD260/280比值为1.8~2.0的RNA作为模板,依照PrimeScriptTMRT Reagent Kit反转录试剂盒合成cDNA,保存于-20 ℃备用。扩增体系:5×PrimeScriptTMBuffer 4 μL,PrimeScriptRTEuzyme Mix I 1 μL,Oligo dT Primer (50 μmol/L) 1 μL,Random 6 mers(100 μmol/L)1 μL,cDNA 1 μL,RNase Free ddH2O补足至20 μL。扩增条件:15 min(37 ℃),5 s(85 ℃)。
1.2.3 引物设计 根据GenBank中黄牛(Bostaurus)HDAC8基因(GenBank No.XM_024988193.1)和β-actin基因(GenBank No.AY141970.1)的mRNA序列分别设计克隆及qRT-PCR引物,引物设计由Primer 5.0软件进行(表1),由南京金斯瑞生物科技公司合成。
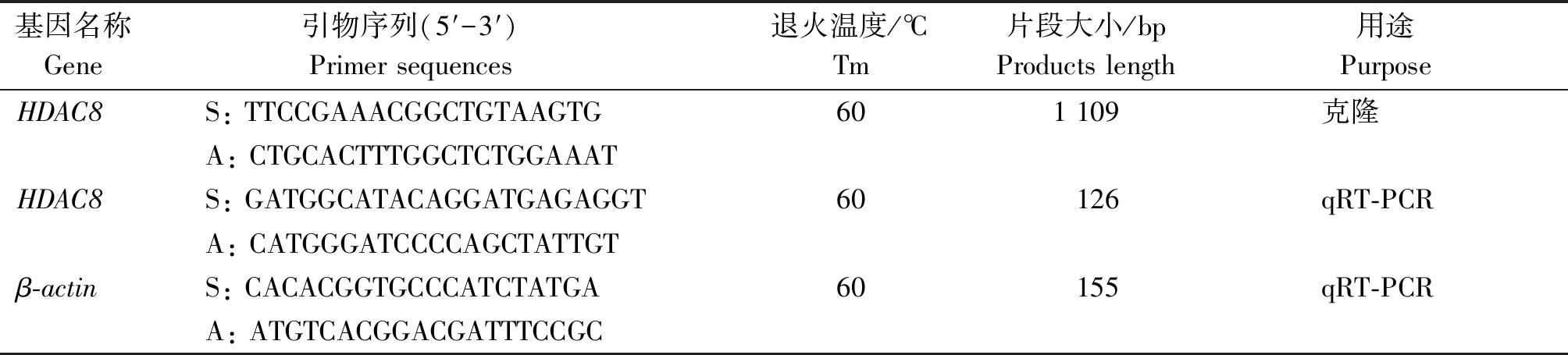
表1 引物信息Tab.1 The informations of primers
注:S.正义链引物;A.反义链引物。
Note:S.Sense primer; A.Antisense primer.
1.2.4 牦牛HDAC8基因的克隆 以牦牛肝脏cDNA为模板,PCR方法扩增HDAC8序列。扩增体系:cDNA 1 μL,Sense primer(10 μmol/L)和Antisense primer(10 μmol/L)各1 μL,Premix TaqTMDNA聚合酶12.5 μL,ddH2O 9.5 μL。扩增条件:预变性4 min(94 ℃);变性45 s(95 ℃),退火45 s(60 ℃),延伸1 min(72 ℃),35个循环;延伸10 min(72 ℃)。根据DNA胶回收试剂盒使用说明纯化扩增产物,再将其与pMD-19T Vector连接2 h(16 ℃),转化至DH5α后筛选阳性克隆并进行菌液PCR鉴定,送交生工测序。
1.2.5 牦牛HDAC8基因序列分析 根据NCBI中ORF Finder查找牦牛HDAC8序列开放阅读框;核苷酸及氨基酸序列相似性比对由NCBI中在线程序Blast分析;MEGA 7.0软件构建NJ系统进化树;通过在线软件ExPASy ProtParam、TMHMM、SignaIP 4.1 Server 、Targetp、NetPhos 3.1、NetOGlyc 4.0、NetNGlyc 1.0、Hopfield、Swiss-model和STRING 交互式数据库分别预测分析HDAC8蛋白的理化性质、跨膜结构域、信号肽、亚细胞定位、磷酸化位点、O-糖基化位点、N-糖基化位点、二级结构、三级结构和蛋白相互作用。
1.2.6 牦牛HDAC8基因组织表达差异分析 qRT-PCR方法检测HDAC8在牦牛不同组织中的表达规律。反应体系:cDNA 1 μL,上游引物(10 μmol/L)和下游引物(10 μmol/L)各0.5 μL,SYBR®Premix Ex TaqTMⅡ 7.5 μL,ddH2O 5.5 μL。反应条件:预变性3 min(95 ℃);变性10 s(95 ℃),退火30 s(60 ℃),40个循环。以β-actin为参照基因,每个组织样本设3个生物学重复。
1.2.7 牦牛HDAC8基因在卵母细胞成熟过程中的表达差异 qRT-PCR技术检测牦牛GV、MⅠ和MⅡ期卵母细胞中HDAC8的表达规律,反应体系及反应条件同1.2.6。
1.3 数据分析
通过2-ΔΔCt法将数据进行均一化处理,数据用平均值±标准误表示。显著性分析由SPSS 19.0软件中单因素方差(ANOVA)进行,P<0.05,认为差异具有统计学意义。
2 结果与分析
2.1 牦牛HDAC8基因的克隆及序列分析
经1.5%琼脂糖凝胶电泳检测发现,扩增产物为一条与预期目的产物大小一致的特异片段(图1)。牦牛HDAC8基因序列为1 109 bp,CDS区为1 008 bp,编码氨基酸335个。
利用NCBI中在线程序Blast对克隆获得的牦牛HDAC8基因序列与黄牛、绵羊、骆驼、猪、白豚、犬、猫、马、人类及黑猩猩的HDAC8基因序列进行比较分析,牦牛HDAC8基因与黄牛、绵羊和骆驼等哺乳动物的序列相似性高达94%以上(表2),表明该基因在进化过程中高度保守。同时利用邻接法(Neighbor-Joining,NJ)构建的系统进化树,聚类结果表明,牦牛与黄牛聚为一类,亲缘关系最近(图2)。
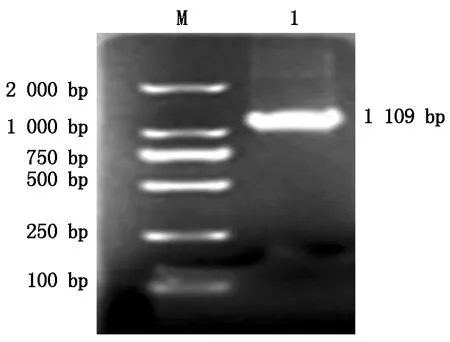
M.DL2000 DNA Marker;1.HDAC8 PCR扩增片段。 M.DL2000 DNA Marker;1.PCR product of HDAC8.
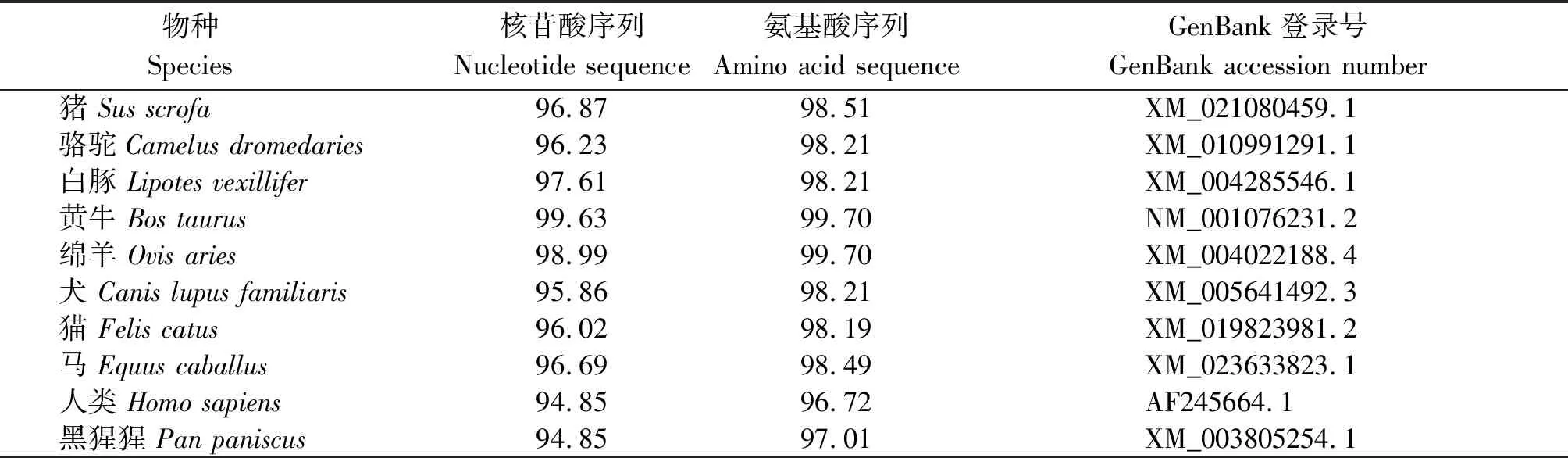
表2 牦牛HDAC8基因与其他物种的相似性比较Tab.2 Identity of yak HDAC8 gene with the corresponding sequences of various species %

图2 不同物种间HDAC8基因的进化关系分析Fig.2 Evolutionary relationship analysis of HDAC8 gene between different species
2.2 牦牛HDAC8蛋白理化性质的预测分析
牦牛HDAC8蛋白分子式为C1666H2554N436O490S17,分子质量为37.08 ku,原子总数为5 163,理论等电点(pI)为5.49,不稳定指数为37.04,亲水性总平均值为-0.101,脂肪系数为87.91,属于脂溶性蛋白。牦牛HDAC8所编码的335个氨基酸中甘氨酸(Glycine, Gly,9.6%)、亮氨酸(Leucine, Leu,9.0%)、天冬氨酸(Asparagine, Asp,7.5%)、丙氨酸(Alanine, Ala,7.5%)、缬氨酸(Valine, Val,6.9%)和异亮氨酸(Isoleucine, Ile,6.6%)出现的频率较高。同时带正电荷残基总数(Arg+Lys=29)少于带负电荷的氨基酸残基总数(Asp+Glu=41),预测该蛋白整体带负电荷。亲疏水性预测分析表明,HDAC8蛋白亲水性分值在第318处最小,亲水指数为-3.378,第261处最大,亲水指数为1.756,且较大多数氨基酸残基具有亲水性,预测该蛋白为亲水稳定蛋白。
2.3 牦牛HDAC8蛋白结构与功能的预测分析
预测分析结果表明,牦牛HDAC8蛋白无信号肽及跨膜结构域,包含17个丝氨酸磷酸化位点、15个酪氨酸磷酸化位点和10个苏氨酸磷酸化位点及3个O-糖基化位点,无N-糖基化位点。主要在细胞质(52.2%)、细胞骨架(21.7%)和细胞核(17.4%)中发挥生物学作用。二级结构预测结果表明,α-螺旋占22.09%,延伸链占28.36%,无规则卷曲占49.55%。蛋白质三级结构预测结果与二级结构预测结果基本一致(图3)。蛋白相互作用分析发现,HDAC8蛋白可能与染色体结构维持蛋白3(Structural maintenance of chromosomes protein 3,SMC3)、染色体结构维持蛋白1A(Structural maintenance of chromosomes protein 1A,SMC1A)、双链断裂修复蛋白RAD21样蛋白1(Double-strand-break repair protein rad21-like protein 1,RAD21)、半翼蛋白(Bwings apart-like protein,WAPAL)、染色质解旋酶DNA结合蛋白4(Chromodomain-helicase-DNA-binding protein 4,CHD4)、姐妹染色单体凝聚蛋白PDS5同源物A(Sister chromatid cohesion protein PDS5 homolog A,PDS5A)、姐妹染色单体凝聚蛋白PDS5同源物B(Sister chromatid cohesion protein PDS5 homolog B,PDS5B)、基质抗原1(Stromal antigen 1, STAG1)、基质抗原2(Stromal antigen 2,STAG2)及核受体辅阻抑物2(Nuclear receptor corepressor 2,NCOR2)等蛋白相互作用(图4)。
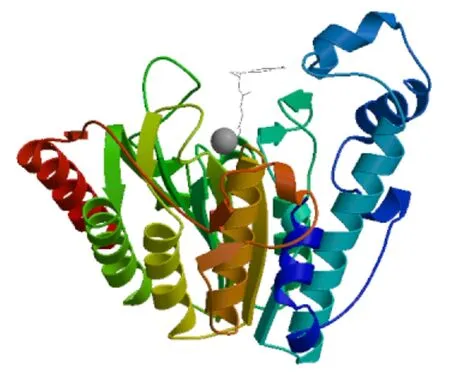
图3 牦牛HDAC8蛋白的三级结构预测Fig.3 Tertiary structure prediction of HDAC8 protein in yak
2.4 HDAC8在牦牛组织中的表达模式
通过qRT-PCR发现,牦牛HDAC8mRNA普遍表达于牦牛多个组织,高表达于肝脏组织中,极显著高于其他组织(P<0.01),肺脏和胃组织中也有较高水平的表达,极显著高于心脏、脾脏、肾脏、肌肉、乳腺、睾丸和卵巢组织(P<0.01)(图5)。
2.5 HDAC8在牦牛卵母细胞成熟过程中的表达水平分析
本试验依据牦牛卵母细胞发育的特点及西南民族大学生命科学与技术学院动物科学国家民委重点实验室前期试验选择GV、MⅠ和MⅡ期卵母细胞,检测HDAC8在牦牛卵母细胞成熟过程中的表达规律。结果表明,HDAC8表达水平随着卵母细胞成熟阶段的递增呈上升趋势,在MⅡ期表达水平最高(图6),极显著高于GV和MⅠ期(P<0.01)。

图4 HDAC8蛋白与其他蛋白的相互作用网络Fig.4 The interaction network of HDAC8 with other protein
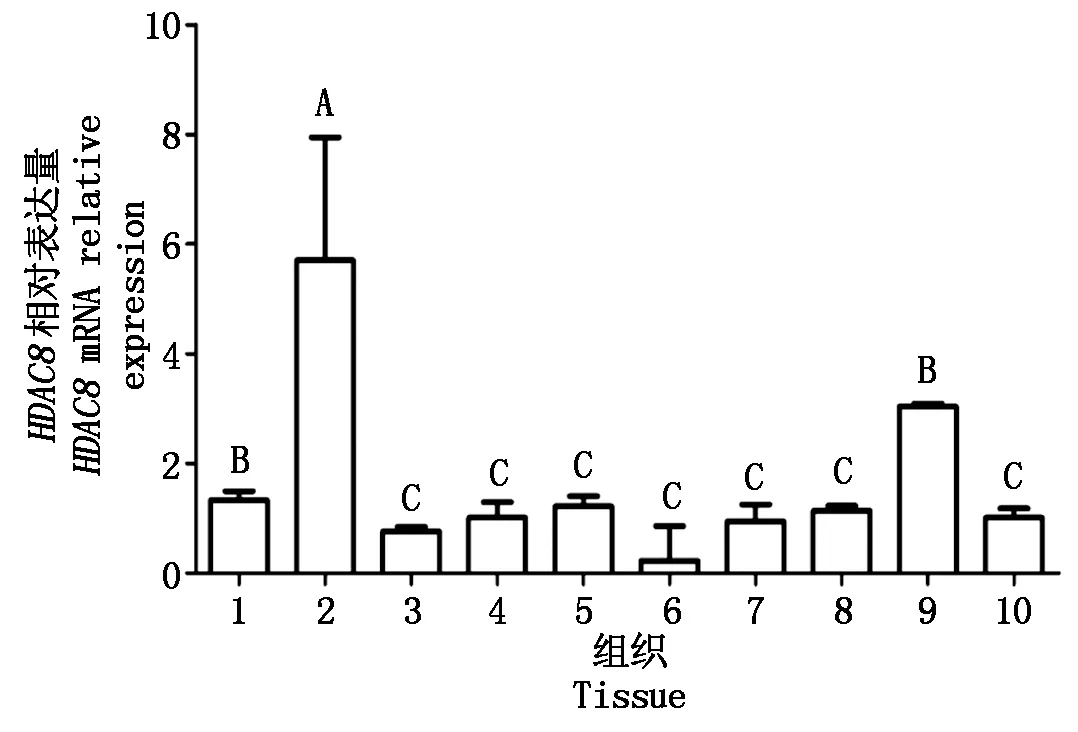
1.肺脏;2.肝脏;3.睾丸;4.肌肉;5.卵巢;6.脾脏;7.乳腺;8.肾脏;9.胃;10.心脏;n=3;内参基因.β-actin;大写字母相异表示差异极显著(P<0.01)。图6同。
1.Lung; 2.Liver; 3.Testis; 4.Muscle; 5.Ovary; 6.Spleen; 7.Mammary gland; 8.Kidney; 9.Stomach;10.Heart;n=3; Reference gene.β-actin; Different capital letters means extremely significant difference between the treatments(P<0.01).The same as Fig.6.
图5HDAC8在牦牛不同组织中的表达模式
Fig.5 Expression pattern ofHDAC8in different tissues of yak

图6 HDAC8在牦牛卵母细胞不同 发育阶段中的相对表达水平Fig.6 HDAC8 mRNA relative expression at different stages of oocytes development in yak
3 讨论与结论
组蛋白乙酰化修饰对基因表达及细胞发育的调控至关重要,其中去乙酰化酶家族与染色体易位、转录调控、基因沉默、细胞周期、细胞分化和增殖以及细胞凋亡密切相关[19]。HDAC8作为人源Ⅰ类组蛋白去乙酰化酶,其广泛分布和表达于人类细胞核内[20]。本研究克隆获得牦牛HDAC8序列,与黄牛、绵羊和人类等的序列进行比对分析发现,牦牛与上述物种有较高的序列相似性,表明HDAC8在哺乳类动物间的进化过程及蛋白质结构水平上的保守性较强。此外,HDAC8与HDAC1~3不同,其较早产生分歧进化,可能导致其不同的功能特化[21]。除催化核心结构域外,HDAC8不具有C末端的延伸区域,并且HDAC8蛋白单独具去乙酰化酶活性以及底物选择性,其可能相对独立地行使功能[22]。然而,HDAC8能够与体内某些蛋白质结合,蛋白质之间的相互作用可能影响其生物学功能和底物选择性[22]。Deardorff等[16]研究发现,HDAC8的体内底物为某些特殊的非组蛋白,其中就包括染色体结构维持蛋白SMC3;HDAC8可直接使SMC3去乙酰化,并且还可能会作为支架蛋白,以复合物方式募集底物蛋白。本研究中,蛋白相互作用分析发现,HDAC8蛋白可能与SMC3等多种蛋白相互作用,进而在细胞进程中发挥一定的调控作用。
Buggy等[20]研究发现,HDAC8在人的肺脏、心脏和肾脏中均有表达,其中在肝脏中的表达量最高。利用qRT-PCR技术测定HDAC8在牦牛各类组织中的表达规律,结果显示,HDAC8在牦牛各类组织中普遍表达,且在肝脏中的表达水平最高,与Buggy等[20]的研究结果相似。HDAC3与HDAC8同属Ⅰ类组蛋白去乙酰化酶,二者同源性较高[20]。同时,Farooq等[23]研究发现,HDAC3在维持肝脏代谢稳态的平衡中发挥着关键作用,特异性敲除成年小鼠肝脏中的HDAC3后,空腹血糖和胰岛素水平明显低于野生型。因此,推测HDAC8也有可能对牦牛肝脏的代谢发挥一定的调控作用。
细胞内组蛋白乙酰化水平由乙酰化转移酶(Histone acetyltransferase,HAT)和去乙酰化酶 (Histone deacetyltransferase,HDAC) 共同调控,二者可以改变组蛋白表面赖氨酸残基所带电荷,进而影响染色质的凝集或疏松程度并调控基因的转录[24]。组蛋白乙酰化调节在卵母细胞减数分裂过程中起重要作用,在此期间,卵母细胞中组蛋白乙酰化参与染色质结构的改变和基因表达的调控[24]。染色质的凝集是卵母细胞走向成熟过程中一个可见的生物学过程,在此过程中纤维状的染色质被包装形成染色体,并在随后的细胞分裂过程中分离进入子细胞,组蛋白去乙酰化使染色质处于凝集状态,从而抑制基因的转录[24]。qRT-PCR分析HDAC8在牦牛卵母细胞成熟阶段(GV、MⅠ和MⅡ期)中的表达规律,结果表明,HDAC8随着卵母细胞成熟阶段的递增呈上升趋势,MⅡ期极显著高于GV和 MⅠ期。有研究表明,在多种哺乳动物,如小鼠、绵羊、猪及牛的生发泡(Germinal vesicle,GV)期卵母细胞中H4组蛋白的H4K16处于高乙酰化水平,在卵母细胞生发泡破裂(Germinal vesicle breakdown,GVBD)期后,即染色质开始凝集转变成染色体的时刻会发生去乙酰化,随着减数分裂的再次激活,H4K16进行了去乙酰化,这种状态一直持续到第二次减数分裂中期(Meiotic metaphaseⅡ,MⅡ)结束[25],并且牛卵母细胞体外成熟过程中H4组蛋白乙酰化趋势与小鼠相似[26],与本试验数据基本相符合。推测在牦牛卵母细胞GV和MⅠ期中的低HDAC8mRNA水平与H4K16乙酰化有关,HDAC8可能对牦牛卵母细胞的成熟有一定的调控作用。
本研究克隆获得牦牛HDAC8基因CDS序列1 008 bp,编码335个氨基酸,序列分析表明,HDAC8在哺乳类动物间的进化过程及蛋白质结构水平上保守性较高。组织表达及卵母细胞成熟过程中的表达分析发现,HDAC8在牦牛肝脏组织中的表达量最高,随着卵母细胞成熟阶段的递增,HDAC8的表达呈上升趋势,MⅡ期极显著高于GV和 MⅠ期。本试验结果可以为进一步探索HDAC8在牦牛生殖中的调控作用提供一定的理论基础。

