腐植酸钾肥料对土壤细菌多样性和养分的影响
丁嘉宁 梁利宝 王曰鑫
山西农业大学资源环境学院 太谷 030801
腐植酸是土壤中主要的有机碳库,对土壤生物多样性的改善有明显的调控作用。腐植酸可通过改变根系分泌物(糖和有机酸)的种类和成分进而间接改变微生物群落结构[1];腐植酸和肥料配施可提高根际土壤中细菌和真菌的数量[2],不同种类的腐植酸对微生物的影响效果不同[3];腐植酸还可以提高养分的利用率[4,5]。
凌爱芬[6]采用平板培养法说明添加少量腐植酸可以促进土壤细菌数量的增加,但随着腐植酸用量增加,细菌数量开始下降,原因是腐植酸对微生物产生抑制作用。杨云马等[7]研究得出土壤细菌数量与速效N、P含量呈极显著正相关,与速效K呈显著正相关。利用高通量测序技术研究细菌多样性是一种现代的分子生物学法[8],克服了传统平板培养技术[9]的缺点,获得了一部分不能分离培养的土壤微生物信息。此方法测序量大,准确度高,而且成本低,能够大量节省试验的人力、物力。但该方法可能会高估或低估一些细菌种群的相对丰度和多样性。目前,国内采用高通量测序方法研究腐植酸肥料对土壤细菌种群影响的研究较少,因此本试验采用此法揭示腐植酸对土壤细菌种群的影响。
1 材料与方法
1.1 试验材料
1.1.1 供试作物
供试作物为油菜“四月慢”,生育期约为40天,从山西省太谷县农资市场购得。
1.1.2 供试肥料
腐植酸钾肥料从市场购得,水溶性腐植酸含量为40%,N含量为 8.8%,P2O5含量为4.5%,K2O含量为10%。
1.1.3 供试土壤
供试土壤类型为石灰性褐土,采自山西农业大学实验站,土壤的化学性质见表1。

表1 供试土壤的化学性质Tab.1 The chemical properties of tested soil
1.2 试验设计
试验在山西农业大学资源环境学院实验站内进行,采用盆栽试验,试验用塑料盆规格为高22 cm,上口径为20 cm,下口径为17 cm,每盆装入6 kg风干土。试验共设4个不同腐植酸钾肥料施用量处理,分别为0、5、10、20 g/kg土,分别用HA1、HA2、HA3、HA4表示,同时每盆施入基础肥料尿素2克/盆,磷酸二氢钾1克/盆,每个处理重复3次,采用完全随机区组设计。于2019年5月7日播种,5月12日出苗,每盆保留4棵苗,于6月20日收获,同时进行土壤样品的采集,土壤鲜样采集后立刻进行细菌多样性的测定;待土壤风干后,进行土壤有机质和养分的测定。
1.3 测定项目及方法
土壤细菌多样性采用高通量测序的方法测定(委托上海美吉生物科技有限公司测定);土壤有机质采用NY/T 85-1988土壤有机质测定法标准中的重铬酸钾容量法测定;土壤全氮采用NY/T 53-1987土壤全氮测定法标准中的半微量开氏法测定;土壤全磷采用NY/T 88-1988土壤全磷测定法标准中的氢氧化钠熔融-钼锑抗比色法测定;土壤全钾采用NY/T 87-1988土壤全钾测定法标准中氢氧化钠熔融-火焰光度法测定。
1.4 土壤DNA提取和高通量测序
采用DNA提取试剂盒E.Z.N.A.® Soil DNA Kit(Omega Bio-tek,Norcross,GA,U.S.)提取土壤总DNA,利用1%琼脂糖凝胶电泳检测抽提的基因组DNA。对16s rRNA基因高变区(V3-V4)片段进行聚合酶链式反应(PCR)扩增,引物序列[10]为 338F(5′-ACTCCTACGGGAGGCAGCA -3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)。扩增条件为:95 ℃预变性2 min,接着进行5个循环,包括95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s;循环结束后72 ℃最终延伸5 min。每个样品3次重复,将同一样品的PCR产物混合后用2%琼脂糖凝胶电泳检测,使用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物,Tris-HCl洗脱;2%琼脂糖电泳检测。参照电泳初步定量结果,将PCR产物用Quanti FluorTM-ST蓝色荧光定量系统(Promega公司)进行检测定量,按照测序量要求,之后将样品互补DNA(cDNA)模板量浓度均一化至10 nmol/L后等摩尔混合,最后将混合液逐步稀释至5 pmol/L后直接上机测序。测序在上海美吉生物科技有限公司的Illumina Miseq PE300平台进行。
1.5 高通量测序指标及意义
使用Trimmomatic软件原始测序序列进行质控,使用FLASH软件进行拼接;得到的序列用Uparse软件进行处理,根据97%的相似度对序列进行聚类,形成不同的分类单元,即为不同的OTU,使用Uchime软件剔除嵌合体;利用RDPclassif i f i er软件平台对OTU进行物种分类,从而获得每个OTU的分类学信息。
1.5.1 稀释性曲线
稀释性曲线可以用来比较测序不同的样品中物种的丰富度,也可以用来说明样品的测序数据量是否足够,是否需要加测数据。当图像变化越来越小甚至几乎不变,证明测序数据量较为合理,各样品的覆盖率均较大,没有被测出的序列概率极低,反映了本次测序结果真实度较高,具有分析意义。
1.5.2 Alpha多样性分析
(1)计算菌群丰富度的指数:包括Chao指数与Ace指数,二者均是生态学中常用于估计菌群丰富程度的指标,它们可以估计物种总数。两个指数与菌群多样性均呈正相关关系,即Chao指数值与Ace指数值越大,则所含细菌越丰富。
(2)计算菌群多样性的指数:包括Simpson指数与Shannon指数,二者均是生态学中常用于计算菌群多样性的指数。两个指数对群落种类的影响相反,即Shannon指数值越大,Simpson指数值越小,则群落种类越多。
(3)测序深度的指数:Coverage指数能够体现样品被覆盖的程度,与样品的覆盖率呈正相关关系。也就是说,Coverage指数值越高,样品的覆盖率越高,不能被检测到的样品几率就越低。
1.5.3 物种组成分析
(1)Venn图分析:可以直接通过观察图中OTU的数目和各样品之间的相似度和重叠情况,研究各样品物种组成的异同点。
(2)群落组成丰度:指群落中物种的数量多少,即细菌的丰富水平。
1.5.4 土壤养分与细菌OTU相关性分析
利用Spearman相关性热图分析土壤养分与细菌OTU的相关性,通过直接观察群落热图中各指数的颜色深浅来判断各个环境因子与细菌OTU之间的相关关系。
2 结果与分析
2.1 物种注释与评估
为了得到每个OTU对应的物种分类信息,采用RDPclassif i er贝叶斯算法对一定相似度水平的OTU代表序列进行分类学比对分析,并在门水平(phylum)统计各样品的群落组成。不同的OTU可以注释为同一物种,此时该物种的丰度为对应OUT丰度之和。
2.1.1 稀释性曲线
由图1可以看出,横坐标为随机抽取测序样品中的16s rDNA读数,即样品序列数(reads),其数值在不断增加,而纵坐标表示的OTU的数量也随之呈先快后慢的趋势增大。当序列数为0~10000时,OTU数目增加速度比较快;当序列数在10000以后,OTU数目增加的速度逐渐变得缓慢;当取样序列数达到30000以后,OTU数量的增加速度趋于平缓,其数量几乎不再改变。因而说明选取的样本数比较恰当,可以切实地反映土壤样本的细菌群落,测序深度符合要求,能够覆盖样本中的绝大部分物种。
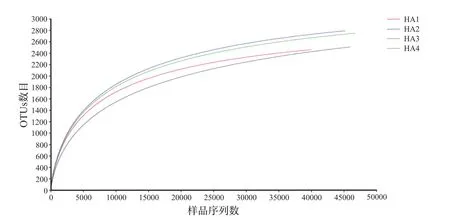
图1 样品稀释性曲线Fig.1 Rarefaction curves of the samples
2.1.2 Alpha多样性分析
表2是不同腐植酸钾肥料处理后土壤细菌Alpha多样性分析结果。可以看出HA2的Shannon指数、Ace指数和Chao指数是所有处理中最大的,而Simpson指数最小,说明了HA2的土壤细菌多样性最丰富;HA4的Ace指数和Chao指数在3个不同用量腐植酸钾肥料处理(HA2~HA4)中则是最小的,Shannon指数也较低,而Simpson指数最大,说明该处理土壤细菌多样性最差;HA3的Shannon指数,Ace指数和Chao指数与HA4相比较大,而Simpson指数比HA4小。由此说明3个不同用量腐植酸钾肥料处理土壤细菌多样性高于对照(HA1),且3个处理中细菌多样性由高到低依次为HA2〉HA3〉HA4。由此得出,腐植酸钾肥料明显提高了土壤细菌多样性。
此外,通过分析各样品Coverage指数和稀释曲线,不同用量腐植酸钾肥料处理土壤样品Coverage指数均不低于0.9808,即覆盖率均不低于98.08%,表明每个样品的细菌种类信息基本上得到充分表现。

表2 Alpha多样性分析Tab.2 Alpha diversity analysis
2.2 物种组成分析
2.2.1 Venn图分析
由图2中可以看出,4个不同用量腐植酸钾肥料处理土壤中共产生4451种OTU,其中4个不同用量腐植酸钾肥料处理共同含有2564种OTU。HA1、HA2、HA3、HA4土壤中OTU数目分别为3339、3643、3491、3650,差异并不十分明显,它们独有的OTU数量分别为101、84、76、257,差异较为明显。
综上可分析出,HA4的OTU数量和独有OTU数量均最多,HA2的OTU数量次之,但其独有OTU的数量则仅高于HA3,低于HA1,独有的OTU数量越多表示其含有独特的细菌种类也最多。
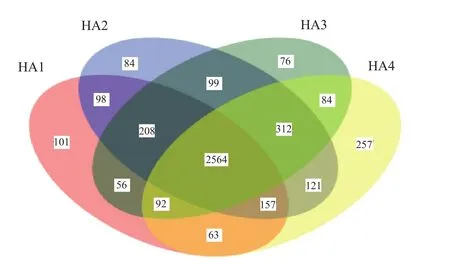
图2 OTU分布Venn图Fig.2 Venn diagram of OTU distribution
2.2.2 群落组成丰度
图3、图4分别为OTU水平和门水平的细菌群落组成图。从OTU水平来看(图3),排在前5位的OTU分别是:OTU2914、OTU3151、OTU2799、OTU3463、OTU3451。HA3中的OTU2914含量最高3.12%,但与HA1、HA2相比差异不显著。HA1、HA2中的OTU3151含量分别为2.56%、2.60%,二者之间无显著差异,但显著高于HA3和HA4。HA3中的OTU2799含量为3.60%,显著高于HA1和HA2,HA4中则没有OTU2799。HA1中的OTU3463含量显著高于其他处理,其余3个处理中的含量基本相当。

图3 细菌群落组成图(OTU水平)Fig.3 Composition of bacterial community (OTU level)
从门水平来看(图4),4个不同用量腐植酸钾肥料处理的土壤细菌群落组成是基本相同的,并且它们的优势菌门也相似,依次为:变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chlorof l exi)、拟杆菌门(Bacteroidetes)、芽单胞菌门(Gemmatimonadetes)。4个不同用量腐植酸钾肥料处理的土壤变形菌门含量37.3%~43.8%,其中HA1含量较低;HA1的酸杆菌门含量(15.0%)显著高于HA4的含量(11.1%);HA2的土壤放线菌门含量(14.4%)要显著高于HA3(10.2%)。不同用量腐植酸钾肥料处理的绿弯菌门含量差异不显著,均在10%左右;HA1的拟杆菌门含量(4.20%)则要低于其他处理(5.22%~6.35%),但差异并不显著。
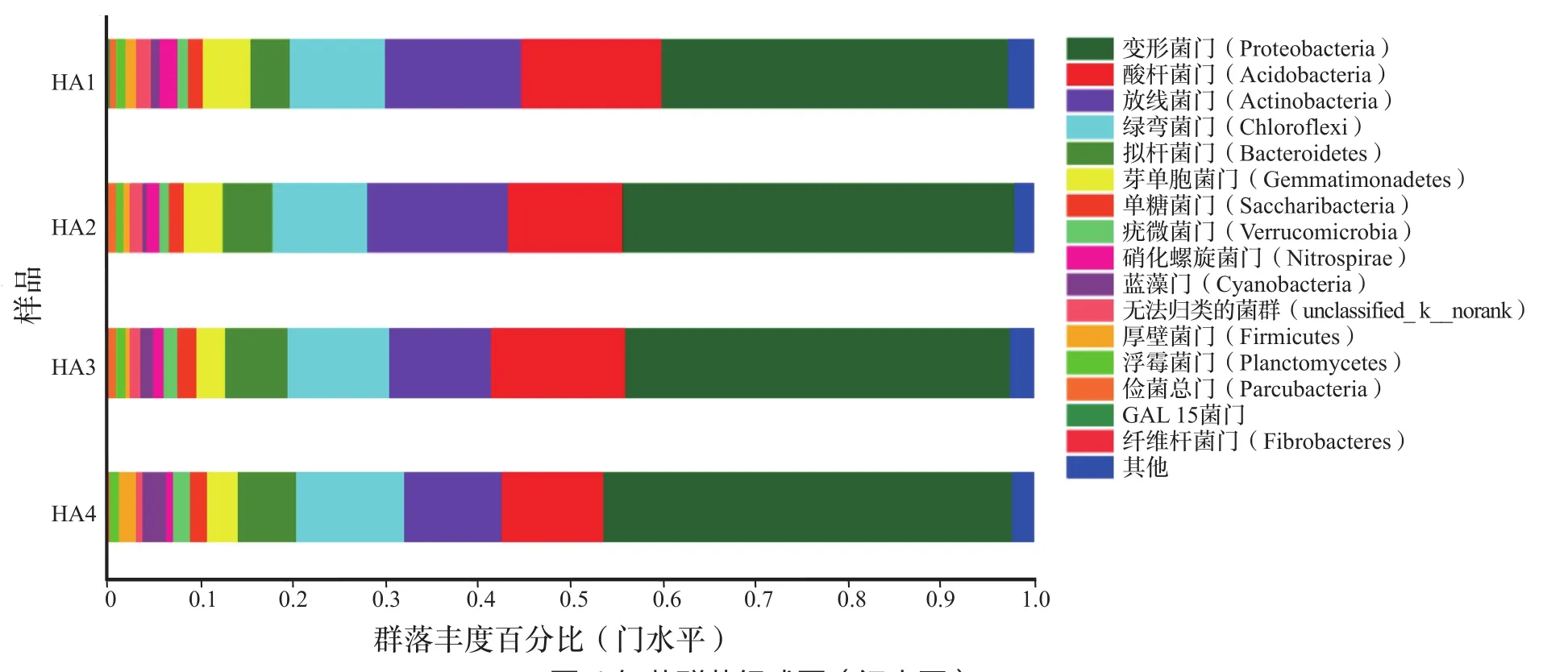
图4 细菌群落组成图(门水平)Fig.4 Composition of bacterial community (Phylum level)
随着腐植酸施用量的增加,在OTU水平上,根据一定相似度进行聚类的OTU差异显著;在门水平上,优势菌门的丰度差异不显著。综上表明:腐植酸钾肥料施入量的增加,改变了土壤菌群的结构,优势OTU含量减少,降低了相似性,丰富了多样性。
2.3 不同用量腐植酸钾肥料处理对土壤有机质和养分的影响
从表3中可以看出,随着腐植酸钾肥料施用量的增加,土壤有机质和氮、磷、钾含量也随之增加。3个不同用量腐植酸钾肥料处理间差异不明显,但与对照均达显著水平,说明腐植酸钾肥料可以显著提高土壤养分含量。
2.4 土壤养分与细菌OTU相关性分析
图5为N、P、K 3种环境因子与不同细菌OTU之间的相关性。由图可以看出,P、K 2种养分与OTU主要表现为正相关(棕色表示正相关,蓝色表示负相关,且颜色越深相关性越强)。其中,P元素与OTU1266、OTU3665、OTU835、OTU4327正相关性较为明显。K元素与多数OTU呈正相关性,其中与OTU2369和OTU329正相关性最明显;与P、K元素相比,N元素与较多OTU呈负相关性,与OTU1154、OTU1366、OTU3304和OTU3991呈显著负相关,与OTU1366和OTU3304呈极显著负相关。结果表明:土壤养分对不同处理土壤样品所含OTU的影响既有相似性,又有差异性。
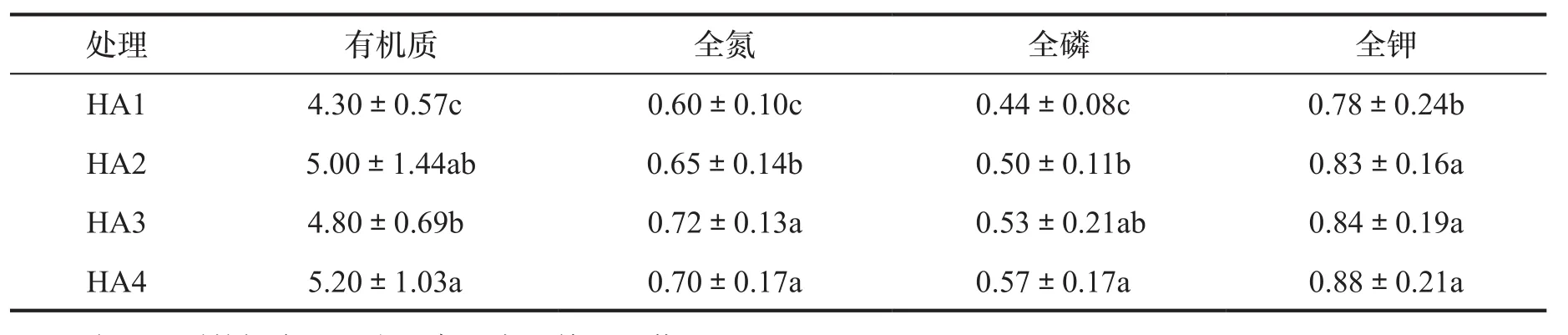
表3 不同用量腐植酸钾肥料处理土壤有机质和养分含量Tab.3 Soil organic matter and nutrient content in potassium humate fertilizer treatment with different dosage
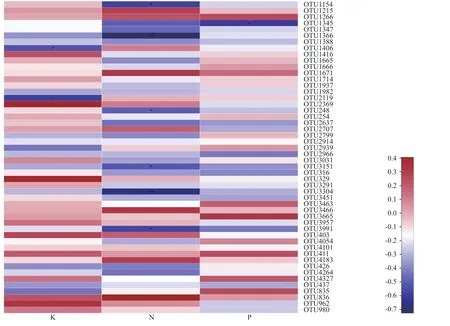
图5 土壤养分与细菌OTU的Spearman相关性热图Fig.5 Spearman correlation heatmap of soil nutrient and bacterial OTU
3 结论与讨论
(1)不同用量腐植酸钾肥料处理土壤中细菌群落组成和优势菌群均较相似,优势菌门依次为:变形菌门、酸杆菌门、放线菌门、绿弯菌门、拟杆菌门、芽单胞菌门。原始土壤中酸杆菌门含量最高,HA4的变形菌门含量最高,HA2的放线菌门含量最高。张慧等[11]研究表明,施腐植酸肥料土壤变形菌门的相对丰度分别增加2.3%和2.8%,绿弯菌门和酸杆菌门略有减少;薛超群等[12]研究得出,随腐植酸施用量增加,土壤放线菌数等微生物数量显著提高,与本文结果相似。HA3、HA4放线菌门含量比HA2低可能因为腐植酸施入过多,造成有益微生物群落营养竞争,空间占领,产生抗生素、细菌素、胞外溶解酶等抑菌物质[13]。
(2)OTU2914、OTU3151、OTU2799是不同用量腐植酸钾肥料处理土壤含量最高的OTU。HA3的OTU2914含量最高3.12%,HA1的OTU2914含量最低为1.41%。HA4的OTU数量和独有OTU数量均为最多,李想等[14]研究表明不同施肥类型土壤微生物的OTU数量差异明显,有机肥处理明显高于无机肥处理,有机肥处理土壤微生物特有OTU比化肥配施有机肥处理增加43.55%,说明有机质含量越高,微生物OUT数量也越多。而腐植酸属于有机质,因此本试验中腐植酸钾肥料施用量最高的HA4的土壤中OTU数量较其他处理高。
(3)不同用量腐植酸钾肥料处理提高了土壤有机质和养分含量,土壤中P、K 2种养分含量与OTU主要呈正相关,土壤N含量与细菌OTU主要呈负相关,尤其是N元素与OTU1366和OTU3304呈极显著负相关。袁红朝等[15]研究得出,N、P、K配施可显著提高土壤细菌多样性,与本文结果一致。试验所得结果N元素与OTU呈负相关,可能是因为氮的沉降,短期氮沉降不足以打破土壤生态系统的平衡状态[16],长期氮沉降增加能提高土壤中NH4+浓度,降低土壤pH值,提高土壤Fe、Al等盐基离子活性[17,18],致使高氮沉降量对土壤微生物群落造成一定的毒害或抑制作用[19]。
本试验只是针对土壤中细菌群落结构多样性进行了研究,并未对真菌、病毒、原生生物等进行研究,因此不能全面反映腐植酸钾肥料对土壤微生物群落结构的影响;本试验的供试植物油菜生育期较短,不能长期反映土壤微生物随时空动态变化,今后试验要补充这方面的研究。
——1月国内108项腐植酸专利授权发布

