草莓4种主要病毒检测及SVBV贵州分离物基因组测定及分析
王 廿,贾蒙骜,黄 刚,卯婷婷,赵玳琳,陶 刚*
(1. 贵州省农业科学院植物保护研究所,贵州 贵阳 550003;2. 贵州省烟草科学院,贵州 贵阳 550005;3. 黔东南州民族职业技术学院,贵州 凯里 556000)
【研究意义】草莓(Fragaria×ananassa)为蔷薇科(Rosaceae)草莓属(Fragaria)宿根性多年生草本植物,花白色,属于浆果类水果;主要分布于亚洲、南美洲、欧洲等地[1-2]。近年来随着设施农业的发展,草莓的栽培面积和产量在世界浆果类水果中跃居第2位,仅次于葡萄,贵州草莓的栽培面积也在逐渐扩大[3-4]。【前人研究进展】生产上栽种农户购买的草莓种苗后多自行繁殖2~3代,由于草莓种苗通过匍匐茎营养繁殖而来,一旦母株带毒,繁殖的后代均带毒。单一病毒对草莓生长和产量无明显影响,2种以上病毒复合侵染常导致草莓产量逐年递减,成为草莓生产的巨大隐患[5]。在我国露地常规繁殖的草莓种苗,其病毒感染率为每年20 %~30 %,导致产量降低20 %~50 %[6]。植物病毒病害一旦发生难以控制,造成植株的长势减弱,从而增加了其他病害的侵染几率,若从根本上解决病毒病的危害,需将病毒的检测和预防提前到草莓组培苗和种苗圃草莓病毒病的检测与及时清除,从而可保证在生产田使用无毒种苗栽培。我国草莓种植中有4种常见的病毒病害,分别是草莓镶脉病毒(Strawberryveinbandingvirus,SVBV)、草莓斑驳病毒(Strawberrymottleirus,SMoV)、草毒皱缩病毒(Strawberrycrinklevirus,SCV)和草莓轻型黄边病毒(Strawberrymildyellowedgevirus,SMYEV)[5-6]。目前颁发的中华人民共和国农业行业标准NY/T303《草莓脱毒种苗生产技术规程》将脱毒种苗分为脱毒原原种苗、脱毒原种苗和脱毒种苗三级,规范中明确种苗病毒的检测方法为RT-PCR,包括SVBV、SMoV和SMYEV等3种病毒的检测,均为阴性才为合格的种苗。草莓病毒最早的检测依赖于比较复杂的电镜技术和接种指示植物方法,这些方法特异性周期长,不易掌握[6-7]。随着分子生物技术的发展,草莓病毒的检测也从单个病毒的检测,逐渐发展为多重RT-PCR方法[8]和实时荧光定量PCR的方法[9],提高了检测效率和检测灵敏度和重复性。利用Illumina测序技术能同时发现多种病毒,如李伟佳等[10]进行转录组测序在疑似病毒症状的草莓叶片分析发现,草莓坏死休克病(Strawberrynecroticshockvirus,SNSV)、SVBV、SCV和SMYEV等4种草莓病毒,用RT-PCR技术对转录组测序结果进行了验证。Akhter等[11]研究分析侵染草莓的病毒与侵染黄瓜株系的差异,Bhagwat等[12]研究发现加拿大东部SMYEV分离物的特异性,说明一些新病毒或是草莓病毒种间变异在田间的广泛发生。为了对草莓病毒病发生的危害草莓生产,持续的监测和明确不同区域的病害发生的差异,是进行针对性防控的基础[10-12]。【本研究切入点】钟霈霖等[13]通过杂交选育出适宜在贵州地区栽培具有早熟、高产、抗病和抗逆等特点的新品种:黔莓1号、黔莓2号和黔莓3号;同时,研究人员在贵州地区也开展了茎尖组培草莓种苗的研究[14]。但贵地区的草莓病毒发生情况以及病毒的遗传关系尚未见报道。【拟解决的关键问题】因此,对贵州地区草莓病毒病害的发生情况进行调查,对生产田草莓植株和组培植株进行常见4种病毒的检测,扩增SVBV基因组全长并分别根据SVBV全基因组序列和完整CP基因序列进行系统发育分析、病毒的遗传变异分析,为无毒种苗的安全生产和田间防控提供理论基础和指导。
1 材料与方法
1.1 材料
1.1.1 植物材料 于2017年分别采集贵州省贵阳市园艺所温室大棚、黔东南州凯里市下司镇温室大棚和黔东南州民族职院组培中心的草莓植株22、23和32份,品种分别为黔莓1号、红颜和章姬。
1.1.2 菌株及载体 大肠杆菌(Escherichiacoli)DH5α菌株和克隆载体pMD-19T等购自天根生化科技(北京)有限公司,内标基因、SVBV、SCV、SMoV和SMYEV等片段构建的基因阳性质粒由北京市植物保护站席昕助理研究员提供。
1.1.3 分子生物学常用酶及试剂盒 EASY spin植物RNA快速提取试剂盒和植物基因组DNA快速提取试剂盒等购自北京艾德莱生物科技有限公司,琼脂糖凝胶回收试剂盒、质粒小提试剂盒和PCR Master mix购自天根生化科技(北京)有限公司,RNA Inhibitor和LATaqDNA Polymerase购自宝生物工程(大连)有限公司,M-MLV Reverse Transcriptase购自普洛麦格(北京)生物技术有限公司,dNTP和引物合成购自生工生物工程(上海)股份有限公司,DNA Marker购自天根生化科技(北京)有限公司。
1.2 方法
1.2.1 引物设计 参考文献[15-16]研究草莓病毒检测的引物进行PCR扩增;已检测到SVBVCP基因片段的样品cDNA为模板,进行SVBV全长序列的扩增和SVBVCP基因的扩增引物参考引物见表1[16-17],其中部分引物根据NCBI上登录的SVBV-SY(GenBank登录号:KP311681)、SVBV-BJ(GenBank登录号:KR080547)和SVBV-AH(GenBank登录号:KX787430)等分离物序列比对后,根据保守的核苷酸序列重新设计。
1.2.2 总RNA提取及RT-PCR扩增 采用试剂盒提取草莓叶片总RNA,反转录反应体系为25 μl:在1.5 mL管中加入2 μl总RNA(约1 μg)、随机引物N(6)和Oligo d(T)18引物各0.5 μl、0.5 μl RNase Inhibitor和15 μl去RNA酶ddH2O,70 ℃加热5 min,立即至于冰上,3 min后加入5 μl 10×M-MLV buffer和1 μl M-MLV反转录酶,42 ℃反应60 min;72 ℃反应10 min。RT-PCR反应条件:94 ℃预变性5 min;94 ℃变性30 s,53 ℃退火30 s,72 ℃延伸45 s或3 min(扩增SVBV全长),循环30次;72 ℃延伸5 min,20 ℃保存5 min。反应结束后取3 μl PCR产物用1.2 %琼脂糖凝胶电泳检测,将阳性产物送至上海生工测序。

表1 草莓SVBV CP基因及全长基因组扩增的引物Table 1 Primers for amplication of CP and genomic sequence of SVBV
注:*为参考序列:SVBV-BJ,GenBank: KR080547.1。#为新设计的引物。
Note: * Reference sequence: SVBV-BJ, GenBank: KR080547.1. # newly designed primers.
1.2.3 SVBV 3个片段PCR扩增及克隆 采用试剂盒提取草莓叶片DNA,将SVBV全长分为3个片段扩增,其中1对引物参考FENG等[17]研究,根据全基因组比对后进行设计另外2对引物(表1)。PCR产物电泳后切出单一目标条带,用凝胶回收试剂盒进行回收,具体方法参照试剂盒说明书。回收后连接到pMD-19T vector,连接产物转到DH5α感受态细胞中,涂布于含氨苄(50 mg/L)的固体LB培养基上,经过37 ℃培养16 h。挑取单菌落至于含氨苄(50 mg/L)的液体LB培养基于转速为180 r/min振荡培养箱中过夜。取1 μl菌液通过PCR鉴定,挑选出阳性克隆,送至上海生工进行测序。
1.2.4 SVBV CP基因的扩增及克隆 采用试剂盒提取草莓叶片DNA,通过引物SVBV CP F和SVBV CP R引物对扩增SVBV的CP基因全长,将获得的PCR产物参考1.2.3的方法构建到载体上,送阳性克隆到上海生工进行测序。
1.2.5 扩增序列分析 扩增的SVBV3个片段阳性克隆测序结果,经DNAman软件进行拼接;GenBank中下载已经可获得的5条SVBV基因组序列和试验获得的贵州分离物全长,采用软件Clustalx进行序列比对,在GenBank下载22条SVBV CP核苷酸序列和测序获得的CP核苷酸序列采用软件Clustalx进行比对;将比对文件导入MEGA7.0采用邻接法进行1000次bootstrap重复计算遗传距离[18]。
2 结果与分析
2.1 常见4种草莓病毒的RT-PCR检测
经检测,77份样品均可扩增获得内标基因的片段,说明检测样品的RNA提取、cDNA合成均良好。以cDNA为模板以SVBV引物对进行RT-PCR,在7株样品中扩增到约270 bp的片段,经测序及BLAST分析发现该片段与SVBV-BJ(GenBank登录号:KR080547)同源性最高;以SMYEV引物对进行RT-PCR,在2株样品中扩增到约850 bp的片段,经测序及BLAST分析发现该片段与SMYEV(GenBank登录号:NC003794 )同源性最高。未在任何样品中扩增到SMoV和SCV的预期大小片段,其中所有检测的阳性对照和阴性对照均与预期相符。通过RT-PCR检测到SVBV和SMYEV病毒,未检测到SMoV和SCV病毒;其中SVBV检出率为19.5 %,SMYEV检出率为2.6 %(表2)。

表2 检测样品4种草莓病毒病的带毒率Table 2 The incidence of four strawberry viruses in samples
2.2 SVBV贵州分离物基因组测序及一致性
对SVBV进行PCR扩增获得与引物设计预期大小相符的条带,分别为2.8、2.9和3.3 kb(图1)。通过序列拼接后获得SVBV-GZ(GenBank登录号:MH894295)贵州分离物基因组序列,全长7859 bp。将SVBV-GZ各编码蛋白序列和核苷酸序列分别于报道的其他6个SVBV分离物进行比对(表2)。基因组核苷酸相似性在84.57 %~98.59 %,与SVBV-BJ分离物(GenBank登录号:KR080547)相似性较高,达98.78 %,与pSVBV-E3分离物(GenBank登录号:X97304)差异最大,仅84.57 %。其中SVBV-GZ的移动蛋白和病毒粒子相关蛋白的氨基酸序列与SVBV-BJ的和SVBV-AH的氨基酸相似性最高为100 %,与美国分离物蚜虫相关蛋白氨基酸序列最低,为70.19 %。目前,已获得SVBV7个分离物的全基因组序列:SVBV-GZ、SVBV-China(GenBank登录号:KR080547)、SVBV-SY、SVBV-BJ、SVBV-AH、SVBV-NS(GenBank登录号:KX950836)和pSVBV-E3等,在预测编码的6个开发读框中,蚜虫相关蛋白的核苷酸序列和氨基酸序列变化较大,分别为75.51 %~99.59 %和70.19 %~99.38 %;反转录酶的核酸序列和氨基酸相似性最高,分别为89.13 %~98.21 %和93.75 %~99.29 %。
分析SVBV-GZ序列,推测其编码7个开放阅读框(Open reading frames, ORFs),与之前报道的SVBV分离物相似,同属于花椰菜花叶病毒科(Caulimoviridae)花椰菜花叶病毒属(Caulimovirus)。开放阅读框Ⅰ(核苷酸 70~1059)推测编码移动蛋白(329 个氨基酸),开放阅读框Ⅱ(核苷酸1062~1550)推测编码蚜虫传相关蛋白(162氨基酸),开放阅读框Ⅲ(核苷酸1551~1901)推测编码病毒粒子相关蛋白(116氨基酸);开放阅读框Ⅳ(核苷酸1904~3319)推测编码外壳蛋白(471氨基酸);开放阅读框Ⅴ(核苷酸3411~5525)推测编码一个反转录酶(704氨基酸);开放阅读框Ⅵ(核苷酸5537~7099)推测编码内含体基质蛋白(520氨基酸);开放阅读框Ⅶ编码的蛋白为107氨基酸。非编码区有513 bp(核苷酸7100~7612)在开放阅读框Ⅵ和开放阅读框Ⅶ之间,该区段核苷酸序列与报道的加拿大分离物NS8的相似性达98.45 %,在这段区域中有真核生物启动子TATA框(核苷酸7217~7223)和类CAT元件(核苷酸7208~7212),转录ploy(A)信号(核苷酸7322~7328)。

M, DL5000 DNA Marker; 1, SVBV1 F/SVBV1R; 2, SVBV2 F/SVBV2new R; 3, SVBV3new F/SVBV3new R图1 SVBV-GZ全基因组序列3个片段的扩增Fig.1 Amplification of three fragments of SVBV-GZ genomic sequence
2.3 SVBV-GZ与其他分离物系统进化关系
基于SVBV基因组核酸序列构建系统发育树表明,7个分离物可分为2个亚组,pSVBV-E3分离物为其中一个亚组,其他6个分离物在另一亚组。SVBV-AH和SVBV-SY在同一分支上,SVBV-BJ和SVBV-GZ在另一分支上(图2)。对8条加拿大、8条中国和1条埃及等17条SVBV分离物CP氨基酸序列构建系统发育树(图3)表明,来自不同地区的SVBV分离物主要归为3个大类(图2),一组(Group Ⅰ)包括了来自加拿大的所有分离物,另一组(Group Ⅱ)包括了中国的所有分离物,还有一组只包括来自埃及(Group Ⅲ)的分离物。由图3表明,SVBV分离物与来自加拿大和埃及的分离物处于不同类群,结果与全长基因组序列构建的系统发育树符合;SVBV-GZZJ和SVBV-GZFLD与来自北京、安徽和沈阳的SVBV分离物较近的亲缘关系,SVBV-GZHY和SVBV-GZQ3与上分支亲缘关系相对较远。
3 讨 论
早在1995年,我国病毒学家依靠血清学反应,明确了国内草莓种苗和田间植株中带毒率较高的4种病毒。由于SVBV是DNA病毒可直接通过PCR进行检测[19],检测结果与RT-PCR检测结果无差别,为方便试验操作全部用cDNA为模板进行检测。采集时检测的样品未呈现的叶片褪绿、皱缩或植株矮小等症状,对这些植株进行草莓常见4种病毒的检测结果显示没有符合侵染的植株,与之前报道草莓病毒单独侵染不会造成明显的症状较相符[20]。草莓大棚种植一般采用上一年的匍匐茎上萌发的新苗为种苗,如果母株带毒则子代将全部为带毒苗,建议在草莓苗圃和组培苗繁殖过程加强病毒的检测[21-22]。由于SVBV和SMYEV的田间传播介体主要为蚜虫[21],因此在草莓苗圃应加强蚜虫的防控。
试验研究首次克隆了SVBV贵州分离物全基因组序列,分析其基因组结构特征。目前在NCBI的数据库中已有我国SVBV的中国分离物、北京分离物、沈阳分离物和安徽分离物的全基因组序列,将获得的贵州分离物SVBV-GZ全基因组序列、其他中国地区分离物、加拿大分离物和美国分离物进行系统发育分析。中国地区分离物与加拿大分离物聚在同一组。进一步分析基于SVBV CP氨基酸序列构建的系统进化树分析发现,SVBV-GZZJ(样品品种为章姬)和SVBV-GZFLD(样品品种为法兰蒂)与北京、安徽和沈阳的SVBV分离物亲缘关系较近,其样品采集地在凯里市下司镇大棚,主要从外省购买种苗种植;SVBV-GZHY(样品品种为红颜)和SVBV-GZQ3(样品品种为黔莓3号)与安徽和沈阳的SVBV分离物亲缘关系相对较远且为另一个分支,北京SVBV分离物较近,其样品采集地为贵阳市郊区,种苗来自贵州省园艺所,可能由于该所地理上隔离栽培、选育和繁殖草莓超过10年,SVBV经过进化与其他分离物出现更多差异。
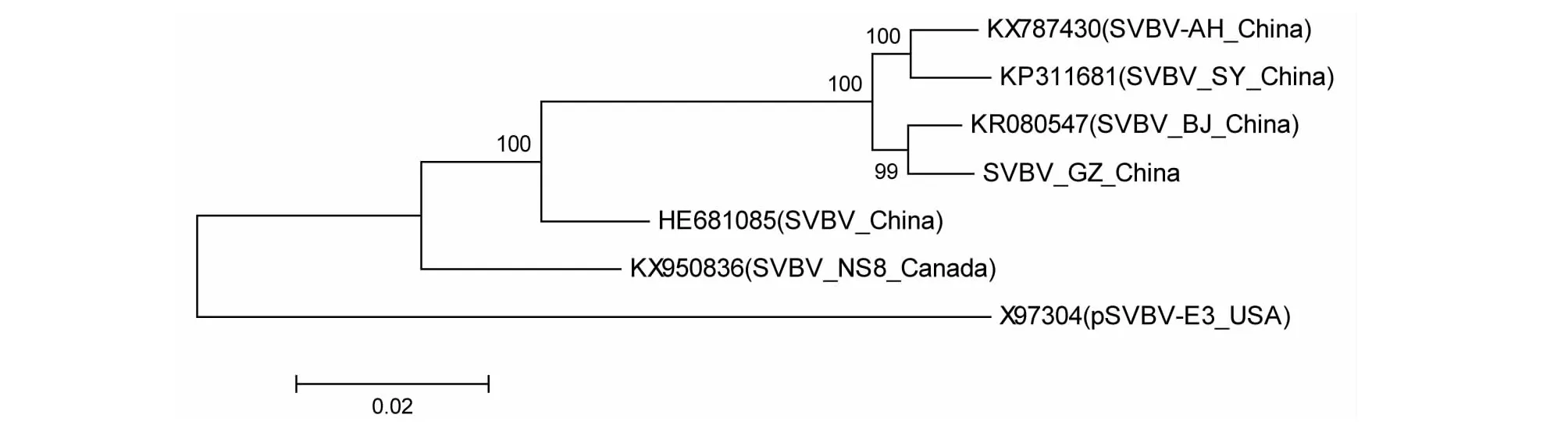
图2 基于SVBV-GZ全长基因组序列的SVBV分离物系统进化关系Fig.2 Phylogenetic relationships of SVBV-GZ with other reported isolates based on genomic

图3 基于SVBV外壳蛋白氨基酸序列的SVBV分离物之间的系统进化关系Fig.3 Phylogenetic relationships of SVBV isolates based on its coat protein amino acid sequences
4 结 论
试验通过RT-PCR检测发现贵州省草莓植株有SVBV和SMYEV 2种病毒,未发现SMoV和SCV,测定的SVBV-GZ全基因组序列与已报道的SVBV-BJ分离物的序列相似性最高。

