采后莲雾果实软腐病病原菌的分离鉴定和拮抗菌的筛选及防治机理
何文琪,王雅君,尤文静,葛春晖,邵远志
(海南大学食品科学与工程学院,海南海口 570228)
莲雾[Syzygiumsamarangense(Blume)Merr. & L.M. Perry],又称洋蒲桃,主要生长于热带,原产于马来西亚、印度,17世纪传入台湾,海南、广东、福建等沿海一带均有种植。莲雾果肉清甜多汁,具有清热解暑、调节体内酸碱平衡、减少肠道对脂肪及胆固醇的吸收等功效[1]。但由于其采收期短、呼吸强度高、果皮组织幼嫩极不耐贮藏[2],随着果实的成熟衰老,果肉出现絮状绵软并有失水现象伴随发生,极易受病菌感染,严重影响莲雾果实的食用价值和商品价值[3]。
莲雾采后病害以软腐病、炭疽病、焦腐病最为常见[4],而软腐病由于病斑扩展速度迅速,在病害中尤为突出。目前,关于莲雾采后病害报道较少,仅李杨秀等[5]、罗志文[6]对莲雾采后主要真菌病害病原菌进行了分离鉴定。目前,莲雾采后病害的防治主要依靠化学杀菌剂。但由于其农药残留对人体会造成伤害,且对环境会造成不可逆污染[7],研究人员目前研究了相对安全的防治方法,例如NO熏蒸[8]、植物精油抑菌[9],但防治效果远远低于化学杀菌剂。生物防治由于其绿色安全、不易形成抗性等优点,成为国内外果蔬采后病害研究的热点[10],已有部分拮抗菌应用于商业化生产。我国研制的有效成分为枯草芽孢杆菌B908的农药“百抗”已获得农药部登记注册[11];在澳大利亚、美国等九个国家推广应用的土壤放射杆菌K-84能抑制桃根癌病[12];哈茨木霉MAUL20是北美第一个成功的生防制剂,对香蕉炭疽病、桃和葡萄的灰霉病有明显抑制效果[13-14]。但利用拮抗微生物来抑制莲雾采后病原菌还未见报道,同时其拮抗机理的研究有助于更好地发现有效的拮抗菌和使用增效剂提高拮抗菌的效果。
本研究从莲雾软腐病病斑处分离鉴定出一株莲雾软腐病病原菌,针对该病原菌从琼海莲雾种植基地土壤中分离筛选拮抗效果较好的生防菌,并在莲雾果实上验证其活体防效和对拮抗机理的初步探究,以期对莲雾采后软腐病的生物防治研究提供参考依据。
1 材料与方法
1.1 材料与仪器
供试果实 在海南琼海莲雾种植基地选取具有典型软腐病病症的果实共30个,并于同地区采集相同品种、大小颜色均一的健康果实若干作为致病性检验和体内实验用果;拮抗菌 在海南琼海的莲雾种植基地,采取不同果树根系10 cm深处土壤,用保鲜袋标记分装,带回实验室4 ℃冰箱保藏备用;酵母提取粉 广东环凯微生物科技有限公司;细菌学蛋白胨 广东环凯微生物科技有限公司;牛肉浸膏 广东环凯微生物科技有限公司;技术琼脂粉 广东环凯微生物科技有限公司;葡萄糖 广州化学试剂厂;氯化钠 广州化学试剂厂。
BCM-1000生物净化工作台 苏州苏洁净化设备有限公司;FYL-YS-280L型恒温箱 北京福意电器有限公司;BIC-300控温控湿培养箱 上海博迅实业有限公司医疗设备厂;AL-204电子天平 梅特勒-托利多仪器(上海)有限公司;ZEALWAYGR60DA高压灭菌器 厦门致微仪器有限公司;NRY-211恒温培养摇床 上海南荣实验室设备有限公司;Nikon ECLIPSE Ci-s/Ci-L显微镜 南京衡桥仪器有限公司;TG16KR台式高速冷冻离心机 长沙东旺实验仪器有限公司;UV-1100型 紫外可见分光光度计 上海美谱达仪器有限公司。
1.2 实验方法
1.2.1 病原菌的分离及鉴定
1.2.1.1 病原菌的分离纯化 采用常规组织分离法[15]。选取新发病状态的莲雾果实,用无菌小刀切取病健交界处组织(5 mm×5 mm),用75%酒精和1%次氯酸钠溶液依次消毒30 s,随后用无菌水冲洗3次,无菌滤纸吸干水分后置于PDA培养基平板上,于28 ℃培养3~5 d,挑取边缘菌丝于新的PDA划线分离,重复直至得到纯化的病原菌。将纯化好的菌株保存于PDA斜面上,4 ℃冰箱保存备用。
1.2.1.2 形态特征观察 将纯化后的病原菌在PDA上28 ℃培养3~5 d后,观察菌落特征,在显微镜下观察菌丝和孢子的形态特征。参照《真菌鉴定手册》[16]进行初步鉴定。
1.2.1.3 致病性检验 采用科赫法则验证[17]。选取健康、大小成熟度一致的莲雾果实,用75%酒精消毒后无菌水冲洗。取PDA培养基上培养3~5 d的病原菌菌饼(8 mm×8 mm),小心置于莲雾果实表面,每果接种3个,以接种PDA培养基为对照,置于28 ℃,相对湿度90%的培养箱中培养,每天观察发病情况。
1.2.1.4 基因序列的测定 病原菌DNA由Ezup柱式真菌基因组DNA抽提试盒剂提取,采用通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATAT GC-3′)进行扩增。扩增程序:预变性94 ℃ 4 min;94 ℃ 45 s,55 ℃ 45 s,72 ℃ 1 min;循环数30。PCR产物交由上海生工股份有限公司测序。测序结果与核酸序列数据库GenBank比对。
1.2.2 拮抗菌的分离及筛选
1.2.2.1 拮抗菌分离纯化 采用稀释平板法和平板划线法[18]。将采集的样品各取10 g加入到含有90 mL无菌水的锥形瓶中,置于28 ℃、100 r/min摇床振荡2~3 h,取混匀后的样品稀释至10-3、10-4、10-5,分别涂布于YPD、NA培养基上,28 ℃培养48 h,挑取不同形态的菌落单独划线,直至得到单一菌落,4 ℃冰箱保存备用。
1.2.2.2 拮抗菌筛选 纯化后的菌株与病原菌经平板对峙实验[19]进行拮抗菌初筛,采用滤纸片法对初筛有拮抗效果的菌株重复进行复筛,并采用十字交叉法测量抑菌圈直径,每株菌3次重复。
1.2.3 拮抗菌的鉴定 取纯化后的拮抗菌于28 ℃下培养48 h后,参照《常见细菌系统鉴定手册》[20]对菌落形态进行观察,并通过革兰氏染色、碳源同化、氮源同化、接触酶、淀粉水解等生理生化特征的测定进行初步鉴定。拮抗菌D-1 DNA由Ezup 柱式细菌基因组 DNA 抽提试剂盒提取,采用通用引物7F(5′-CAGAGTTTGATCCTGGCT-3′)和1540R(5′-AGGA GGTGATCCAGCCGCA-3′)扩增。扩增程序:预变性96 ℃ 1 min;96 ℃ 10 s,50 ℃ 5 s,60 ℃ 4 min;循环数25。PCR产物交由上海生工生物工程股份有限公司测序,测序结果与核酸序列数据库GenBank比对。
1.2.4 拮抗菌对莲雾软腐病的防治效果
1.2.4.1 活体防效实验 选取大小、成熟度一致的健康果实,用75%酒精和1%次氯酸钠溶液依次浸泡3 min,随后用清水冲洗,自然风干。参照Zhou等[21]方法并做修改。用无菌打孔器于果实中线位置打孔(5 mm×3 mm),每组10个果实,分别在伤口处加入20 μL以下溶液:A:无菌水;B:病原菌孢子悬浮液;C:病原菌孢子悬浮液和D-1菌悬液。用无菌水配制浓度为1×105spores/mL病原菌孢子悬浮液浓度,1×108CFU/mL D-1菌悬液。置于25 ℃、湿度90%培养箱中培养9 d,测量其病斑直径,计算发病率。
发病率(%)=发病孔数/接种孔数×100
1.2.4.2 拮抗菌在果实伤口处的竞争作用 a. 拮抗菌生长动态:果实按照1.2.4.1的方法清洗,风干后,参照罗杨[22]的方法做了一定修改。用无菌打孔器在果实中线位置打孔(5 mm×3 mm)。每个伤口处接种20 μL D-1菌悬液(1×108CFU/mL),2 h后接10 μL 病原菌孢子悬浮液(1×105spores/mL),采用无菌水配制菌液并以无菌水作对照。单果包装于25 ℃,湿度90%的培养箱中培养,以接种后1 h为起始每12 h取样,采用涂抹平板计数法计算伤口处拮抗菌活菌数量。每处理5个果实,重复3次,结果以每伤口处细菌数量单位lg CFU/wound表示。b. 空间竞争:果实按照1.2.4.1的方法清洗,风干后,用无菌打孔器在果实中线位置打孔(5 mm×3 mm),每组10个果实,分别在伤口处加入20 μL以下溶液:A:病原菌孢子悬浮液;B:同时接入病原菌孢子悬浮液和D-1菌悬液;C:先接入病原菌孢子悬浮液,12 h后接入D-1菌悬液;D:先接D-1菌悬液,12 h后接入病原菌孢子悬浮液。用无菌水配制浓度为1×105spores/mL病原菌孢子悬浮液浓度,1×108CFU/mL D-1菌悬液。在25 ℃,湿度90%培养9 d,测量其病斑直径,计算抑制率。
抑制率(%)=未发病孔数/接种孔数×100
1.2.4.3 果实抗病相关酶活性的测定 果实按照1.2.4.1的方法清洗,风干后,用无菌打孔器在果实中线位置等距离打2个孔(5 mm×3 mm),每组30个果,分别在伤口加入20 μL以下溶液:A.无菌水;B.D-1菌悬液(1×108CFU/mL),1 h后在每个伤口处加入20 μL孢子悬浮液(1×105spores/mL)。采用无菌水配制菌液并以无菌水作对照。待菌液吸收后,单果包装贮藏于25 ℃,湿度90%培养箱中。取样方法:常温条件下,在贮藏第0、2、4、6、8、10 d,取果实伤口外直径1 cm处的健康果实组织(不包含伤口部位)。每个处理3个重复。
a. 苯丙氨酸解氨酶(PAL)活性测定:参照Yao等[23]的方法做了一定修改。取样品2 g用5 mL 0.1 mol/L pH8.8硼酸缓冲液(含1%聚乙烯吡咯烷酮K30)研磨成匀浆,再用硼酸缓冲液冲洗研钵定容至7 mL,4 ℃、8000 r/min离心20 min,上清液即为粗酶液。取一支试管中加入0.5 mL粗酶液,2 mL 0.1 mol/L pH8.8 硼酸缓冲液,最后加入1 mL 0.02 mol/L L-苯丙氨酸启动反应。以不加酶液,加缓冲液为对照。在37 ℃水浴锅中保温1 h后加入0.1 mL 6 mol/L盐酸终止反应。290 nm处测定吸光值,以吸光值变化0.01为一个酶活力单位。
b. 过氧化物酶(POD)活性测定:参照Qin等[24]的方法做了一定修改。取样品2 g用5 mL 0.05 mol/L pH7.0 磷酸盐缓冲液(含1%聚乙烯吡咯烷酮K30)研磨成匀浆,再用磷酸盐缓冲液冲洗研钵定容至7 mL,4 ℃、8000 r/min离心20 min,上清液即为粗酶液。取一支试管中加入0.5 mL粗酶液,3 mL 0.05 mol/L愈创木酚,最后加入200 μL 2%过氧化氢启动反应。以不加酶液,加0.05 mol/L pH7.0 磷酸盐缓冲液为对照。在37 ℃水浴锅中保温30 min后,每分钟在470 nm处测定吸光值,连续测定15 min。以每分钟吸光值变化0.01为一个酶活力单位。
c. 多酚氧化酶(PPO)活性测定:参照邱思鑫等[25]的方法做了一定修改。酶液提取同方法中POD活性的测定。取一支试管加入100 μL粗酶液、1 mL邻苯二酚、4 mL缓冲液。以不加酶液,加入缓冲液为对照。在37 ℃水浴锅中保温30 min后,每分钟在410 nm处测定吸光度值,连续测定15 min。以每分钟吸光值变化0.001为一个酶活力单位。
1.3 数据处理
实验数据采用Excel 2010进行计算,OriginPro 8.5进行绘图,SPSS Statistics 25软件进行统计,并采用ANOVA进行Duncan多重差异分析,P<0.05表示差异显著。
2 结果与分析
2.1 病原菌鉴定
2.1.1 病原菌形态特征观察 由图1可知,病原菌R1在PDA上近圆形(图1A),菌落出现同心轮纹,正面菌丝为白色,菌落平展,扩展迅速,培养基背面则为淡橙黄色(图1B)。而后轮纹上长出黑色小点,散生,为病原菌的分生孢子,排列疏散,但颗粒较大。显微镜下观察孢子形态,呈梭形,中间3个细胞着色,上2个细胞颜色较深,底端细胞呈无色。顶端有2~3根无色附属丝,尾部着生1根基附属丝(图1C)。菌丝着色较深,且有隔膜(图1D)。结合病原菌形态特征,根据《真菌鉴定手册》,初步判定病原菌为拟盘多毛孢属(Pestalotiopsis)。

图1 病原菌菌落形态和显微镜下孢子和菌丝形态Fig.1 Photographs of colonies and spores of the pathogen注:图A、B分别为菌落正反面特征图;图C为分生孢子(×40);图D为菌丝(×40)。
2.1.2 致病性检验 通过实验从病果病健交界处分离出3株致病真菌,采用科赫法则进行反接实验,发现在第3~4 d,接种R1的菌株莲雾表皮出现水渍状淡黄色圆斑,果实变软,多个圆斑接合内凹,圆斑中心出现白色菌丝,后期病斑处出现同心轮纹状的黑色突起小点,与莲雾软腐病发病病症相似。而空白组则在第5 d果实开始软化,第7 d发病出现淡黄色病斑。采用上述1.2.1.1实验步骤对病果进行分离,分离出病原菌的菌落形态与R1一致,属于同一菌株,所以得出R1是造成莲雾软腐病的病原菌。
2.1.3 分子生物学鉴定 病原菌R1扩增结果如图2所示。经测序得到扩增片段长度为529 bp的核苷酸序列,在GenBank数据库中通过同源性对比,结果显示病原菌与Pestalotiopsismicrospora(MH094237.1)的ITS序列同源性为100%。结合形态学特征鉴定结果,该病原菌鉴定为小孢拟盘多毛孢。

图2 病原菌ITS区PCR扩增电泳图Fig.2 PCR amplification of ITS sequence of the pathogen注:M为DNA Ladder Mix maker,A为R1的扩增产物。
2.2 拮抗菌的筛选
从琼海莲雾种植基地采取的根系土壤样品中共分离出143株菌,采用平板对峙法,得到22株对病原菌具有拮抗效果的菌株。经复筛后,共8株拮抗菌效果明显,其抑菌圈直径与抑菌率如表1所示。其中D-1的拮抗效果最佳,抑菌圈直径达到(11.10±0.45) mm,抑菌率为55.25%(如图3)。
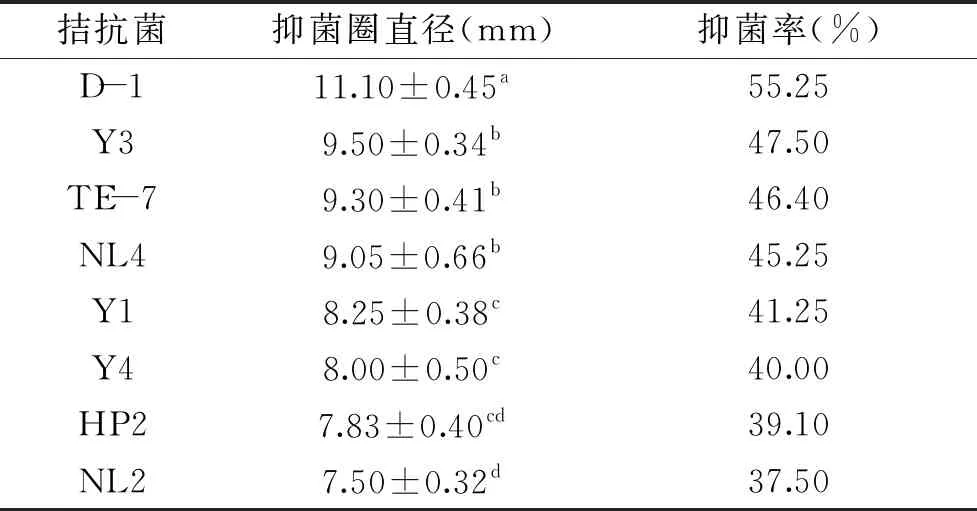
表1 拮抗菌对病原菌的抑菌效果Table 1 Bacteriostatic effect of antagonistic bacteria on pathogenic bacteria

图3 拮抗细菌D-1对病原菌的抑制效果Fig.3 Inhibitory effect of antagonistic bacteria D-1 on pathogenic bacteria
2.3 拮抗菌的鉴定
2.3.1 形态学与生理生化鉴定 拮抗菌D-1菌落呈乳白色,边缘光滑平整,中心凸起有光泽,经革兰氏染色为阳性菌,杆状有芽孢。对拮抗菌D-1进行了生理生化实验,包括:接触酶实验、碳源同化、氮源同化、耐盐性、淀粉水解、硝酸盐还原、吲哚实验、甲基红实验、V-P测定、丙二酸盐利用和糖醇发酵实验,结果见表2。由表2可知,拮抗菌D-1可利用葡萄糖、麦芽糖、蔗糖、乳糖等多种糖类,不能利用但可还原硝酸盐,耐盐性高,具有过氧化氢酶。综上可初步鉴定菌株D-1为芽孢杆菌属(Bacillussp.)。
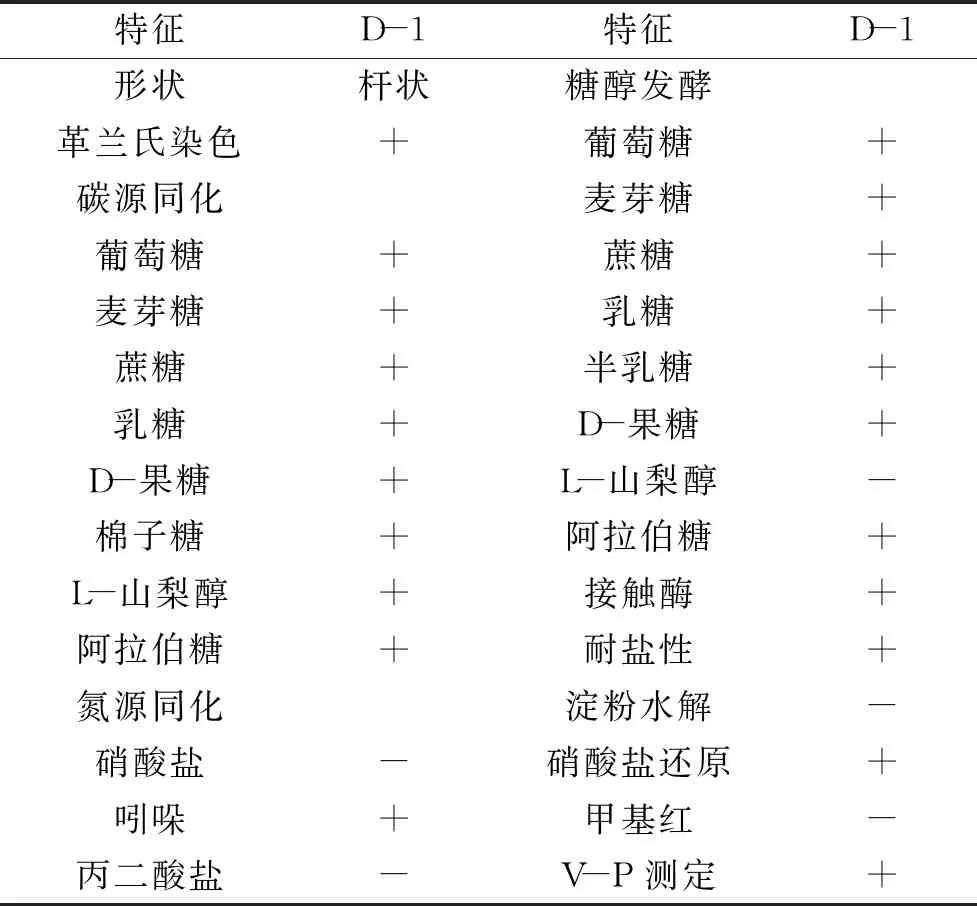
表2 拮抗菌D-1的生理生化特征Table 2 Physiological and biochemical characters of the antagonistic bacteria D-1
2.3.2 16S rDNA测序 拮抗菌D-1扩增结果如图4所示。经测序得到长度为1491 bp的核苷酸序列,通过与GenBank数据库中进行同源性对比,结果显示拮抗菌D-1与Bacillussafensis(CP018100.1)的16S rDNA同源性为100%。结合形态学特征及生理生化特征,将D-1鉴定为沙福芽孢杆菌。
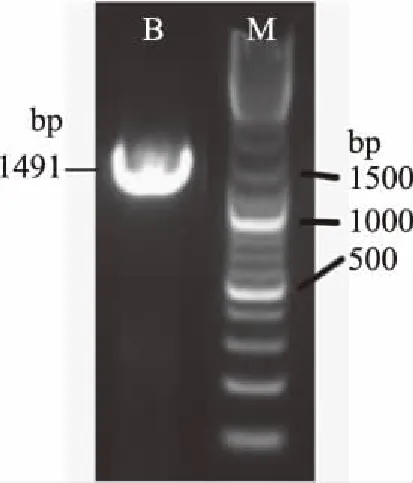
图4 拮抗菌D-1扩增电泳图Fig.4 PCR amplification of the antagonistic bacteria D-1注:M为DNA Ladder Mix maker,B为D-1扩增产物。
2.4 拮抗菌对莲雾软腐病的防治效果
2.4.1 活体防效实验 如图5所示,通过在果实伤口处同孔接种,在常温贮藏条件下,在贮藏第7 d时,莲雾开始发病,随着时间的延长,莲雾软腐病扩展迅速并至第9 d时,处理组B全部发病。处理组A虽然病斑无明显扩展,但其病斑直径与发病率始终高于处理组C。处理组B果实软腐病的发病率达到100%,病斑直径达18 mm,而处理组A、C的发病率分别为60%、50%,病斑直径分别为15.1、14.2 mm,显著低于处理组B(P<0.05)。表明当D-1与R1同孔接种时,可以有效地降低果实软腐病的发生,同时减缓果实病斑扩展(P<0.05)。

图5 常温条件下伤口处拮抗菌D-1对软腐病的控制效果Fig.5 Effects of D-1 to control soft rot disease in wounds at 25 ℃注:A:无菌水;B:R1孢子悬浮液;C:R1孢子悬浮液+D-1菌悬液。
2.4.2 拮抗菌在果实伤口处的竞争作用 如图6所示,在常温条件下,活菌数量总体呈现先上升后下降的生长趋势。前12 h拮抗菌D-1在果实伤口处迅速定殖,而后12~36 h生长速度渐缓并在36 h处达到最大值。病原菌和拮抗菌同孔接种时,D-1能在伤口处迅速生长定殖,数量明显多于未接病原菌时的情况,表明同孔接种时R1并未抑制D-1的生长,反而起到了促进作用。
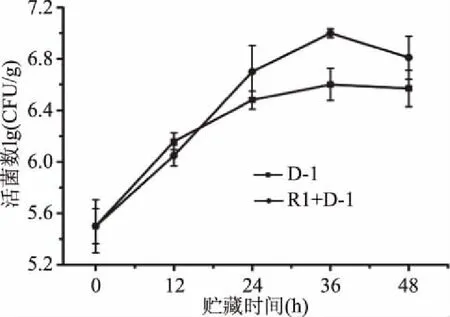
图6 常温条件下D-1与R1同孔接种在莲雾伤口处生长动态Fig.6 The growth dynamics of D-1 and R1 in the same wax apple wound at 25 ℃
如图7所示,在常温条件下,当贮藏到第9 d时处理组A全部发病,抑制率为0,病斑直径达到18 mm,而处理组B、C、D病斑直径分别为13.2、14.2和13.1 mm,抑制率分别为60%、50%、70%,均高于处理组A。综上可以看出,越早接种拮抗菌,则可提前占据有利空间,病斑直径越小,对莲雾软腐病的抑制率越高。
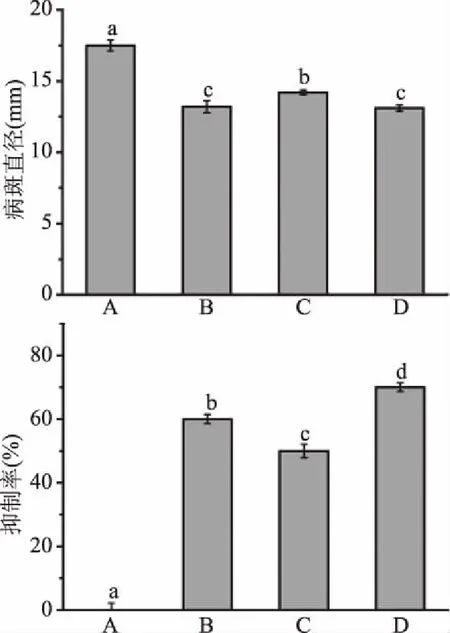
图7 接种时间对病斑直径和抑制率的影响Fig.7 Effect of inoculation time on lesion diameter and inhibition rate注:A:R1孢子悬浮液;B:R1孢子悬浮液+D-1菌悬液;C:先接R1孢子悬浮液,12 h后接D-1菌悬液;D:先接D-1菌悬液,12 h后接R1孢子悬浮液。
2.4.3 果实抗病相关酶活性变化
2.4.3.1 PAL活性 如图8所示,在常温条件下,D-1处理组与对照组果实PAL活性总体呈现先升后降的趋势。在贮藏第0~4 d,D-1处理并未对果实PAL活性产生明显影响,与对照组曲线几乎重合,而在第4~6 d,两组处理组酶活性迅速上升,并在第6 d达到最大值,且D-1处理组酶活性为对照组的1.15倍,显著高于对照组(P<0.05)。之后,两组处理酶活性又大幅下降,但D-1处理组PAL活性依旧高于对照。

图8 拮抗菌D-1处理后莲雾果实PAL活性的变化Fig.8 Dynamic changes of PAL activity in the treatments in wax apple
2.4.3.2 POD活性 如图9所示,在常温条件下,D-1处理组与对照组果实POD活性总体呈现先升后降的趋势。在贮藏第0~4 d,两组处理酶活性迅速上升,并于第4 d达到最大值,且D-1处理组酶活性为对照组的1.43倍,显著高于对照组(P<0.05)。而在第4~6 d,两组处理酶活性迅速下降,且D-1处理组下降幅度更大。尽管贮藏后期下降幅度减缓,D-1处理组有略微上升的趋势,最终两组处理POD活性依旧低于原始水平。
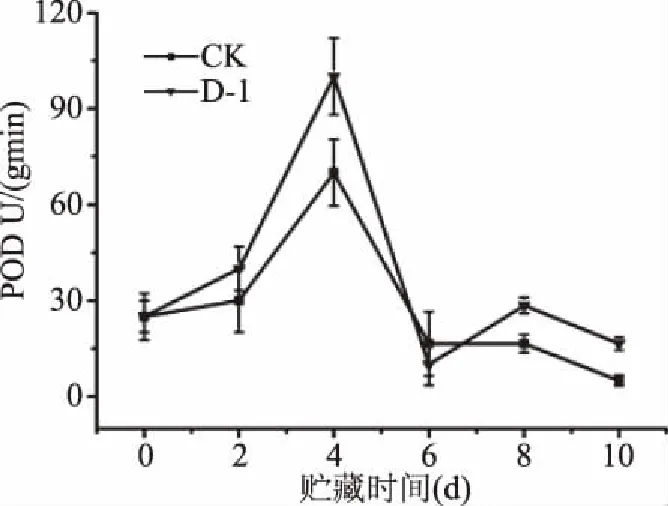
图9 拮抗菌D-1处理后莲雾果实POD活性的变化Fig.9 Dynamic changes of POD activity in the treatments in wax apple
2.4.3.3 PPO活性 如图10所示,在常温条件下,D-1处理组与对照组果实PPO活性总体呈现先升后降再升的波浪式变化。D-1处理组在贮藏前4 d酶活性迅速上升,并在第4 d达到峰值,酶活性为对照组的2.49倍,显著高于对照组(P<0.05),在第4~6 d,PPO活性下降至与对照组同一水平。而对照组在贮藏第0~6 d酶活性一直缓慢上升,直到第6 d达到一个高峰,随后下降,在第10 d又达到一个峰值。在整个贮藏期间,D-1处理组PPO活性始终高于对照组。

图10 拮抗菌D-1处理后莲雾果实PPO活性的变化Fig.10 Dynamic changes of PPO activity in the treatments in wax apple
3 讨论与结论
莲雾软腐病是莲雾采后主要的病害之一,严重影响其贮藏保鲜。本研究利用组织分离法从发病的果实病斑处分离得到了病原菌,通过科赫法则验证、形态学和分子测序,鉴定出病原菌R1为小孢拟盘多毛孢(Pestalotiopsismicrospora)。从琼海莲雾种植基地采取的根系土壤样品中分离得到一株对莲雾软腐病病原菌具有明显拮抗效果的菌株D-1,抑菌直径11.10 mm,抑菌率达55.25%,并通过形态学、生理生化特征、分子测序鉴定为沙福芽孢杆菌。之前已有利用沙福芽孢杆菌作为生防菌株的相关报道,冯玉衡[26]筛选出两株沙福芽孢杆菌用于抑制马铃薯黑痣病和枯萎病,杜秉海等[27]等发明一项关于沙福芽孢杆菌抗番茄灰霉病菌的专利,徐同伟等[28]筛选出一株沙福芽孢杆菌用于抑制烟草黑胫病。因此,拮抗菌D-1可以作为抑制莲雾软腐病的潜在生防菌。但目前商业化的拮抗菌很少,主要还是由于拮抗机理尚不清楚,对其生产应用造成了阻力。
研究表明,数量充足的拮抗菌在果实伤口处可以较病原菌更有效地利用有限的空间资源[29],一些拮抗细菌可以成功通过空间的竞争达到抑菌效果,但不会杀死病原菌[30]。张婕[31]发现拮抗菌P.membranaefaciens和K.apiculata可在李果实伤口处迅速定殖、生长,接种病原菌后,病原菌的存在未影响拮抗酵母的生长,反而对其有促进作用。Francesco等[32]发现出芽短梗霉菌和桃褐腐病菌同时接种时,出芽短梗霉菌能优先定殖,抑制病原菌生长。因此,拮抗菌若能在受伤果实表面定殖,则需要自身具有相应的附着能力,而通过近年对拮抗菌的研究,附着于果实表面的拮抗菌可有效降低果实发病率。其中很大程度与拮抗菌诱导果蔬组织增加其抗病性有关。Mahunu等[33]发现,在苹果中接入Pichiacaribbica,其抗病相关酶POD、PPO含量显著上升。周雅涵[34]发现膜醭毕赤酵母接种到柑橘伤口处后,提高了组织中PAL活性,增加柑橘抗性。Lu等[35]报道拮抗酵母菌Rhodosporidiumpaludigenum诱导果蔬抗性,提高PAL、POD和PPO活性。本研究实验表明,D-1能够占据有利空间,达到抑菌的效果,并且诱导了果实PAL、POD、PPO活性上升,提高果实自身的控病能力。
综上所述,沙福芽孢杆菌能够抑制莲雾果实软腐病病斑扩展,降低发病率,并且能够在果实伤口处快速定殖形成空间竞争,同时提高果实病程相关酶PAL、POD和PPO的活性(P<0.05),提高果实的抗病能力,为莲雾采后软腐病的生物防治研究提供理论依据。

