新疆哈萨克熏马肠煮制过程中汤汁中游离氨基酸和挥发性物质分析
刘文营 李开雄 王守伟* 李 享 成晓瑜 乔晓玲
(1 中国肉类食品综合研究中心 国家肉类加工工程技术研究中心 北京食品科学研究院 北京 100068 2 石河子大学食品学院 新疆石河子 832003)
熏马肠是哈萨克族居民每年于入冬时节加工的传统马肉制品,是哈萨克族集中居住地区特殊环境和饮食文化的重要载体[1]。随着“一带一路”倡议的实施和发展,新疆独特的区位优势和向西开放的重要窗口作用[2],使得熏马肠等特色民族食品被越来越多的消费者所接触。相应地,熏马肠等食品加工产业的发展,也必然有助于促进地区经济发展,对人们生活水平提高和社会稳定均有裨益[3-4]。
目前,研究者针对熏马肠的研究集中于开展降盐加工工艺[5],生物胺分析[6],以及与生物胺生成有关的微生物菌相[7-8]和调控研究[9]等。加工工艺会对熏马肠脂肪氧化[10]、脂肪酶活力[11]和挥发性风味物质[12]产生影响,而颜色[13-14]、滋味[14]和风味[14-17]等感官特征都是肉制品品质的重要参考,研究者也试图通过多种方法来改善肉制品的感官品质[18-19]。然而,目前除少数研究对熏马肠挥发性风味物质分析外[12],鲜有文献对熏马肠煮制成熟过程中主体风味、味觉特性和挥发性风味物质释放等感官品质进行分析,而肉制品的感官特性又是影响消费者消费体验和购买意愿的决定性因素[20]。鉴于此,本文选取哈萨克族居民以传统方法制备的熏马肠作为研究对象,对其煮制过程中汤汁滋味和风味物质释放进行分析。
1 材料与方法
1.1 材料与试剂
熏马肠,于2018 年12 月采集于新疆维吾尔自治区伊犁哈萨克自治州伊宁市。熏马肠的加工工艺:新鲜马肉经去骨和筋膜后,加入食盐(质量分数2.5%)、白砂糖(质量分数2.0%)和香辛料(质量分数0.5%,胡椒粉、八角粉、花椒粉、姜)后腌制24 h,切为小块(2 cm×2 cm×2 cm)后灌装,置于50~70 ℃烘房内烟熏12 h。
氯化钾(KCl)、酒石酸、氯化银(AgCl)、乙醇、氢氧化钾(KOH)、氢氧化钠(NaOH)、盐酸(HCl)、柠檬酸钠(Na3C6H5O7·2H2O),国药集团化学试剂有限公司;2-甲基-3-庚酮(99.9%,CAS 号13019-20-0),美国Sigma Aldrich 公司;电极内部液、清洗液,日本insent 公司;氮气(99.9%),北京如源如泉科技有限公司;茚三酮显色液(货号:299-70501),日本和光纯药工业株式会社(Wako)。
1.2 仪器与设备
Cascada BIO 纯水机,美国PALL 公司;0.22 μm 微滤膜,美国PALL 公司;BSA822-CW 天平,赛多利斯科学仪器有限公司;F6/10-10G 超细匀浆器,上海FLUKO 流体机械制造有限公司;PEN3电子鼻,德国Airsense 公司;TS5000Z 味觉分析系统,日本INSENT 公司;L-8900 高速全自动氨基酸分析仪,日本日立公司;GC-MS 联用仪(TG-Wax MS 极性柱,30 m×0.25 mm,0.25 μm),美国赛默飞世尔科技(中国)有限公司;Gerstel TDS 半自动热脱附进样器,德国Gerstel 公司。
1.3 试验方法
1.3.1 熏马肠蒸煮熟制 熏马肠经温水清洗后均分为3 组,每组1.0 kg,均切为1 cm 长小段,按照1∶3 的质量比加入纯水,置于电磁炉上保持微沸加热,分别于水沸腾0,15,30,45,60,75,90,105,120 min 取样分析,样品分别标记 为m0,m15,m30,m45,m60,m75,m90,m105 和m120。
1.3.2 煮制过程中汤汁主体风味分析 基于电子舌特定传感器会对某类化学物质产生特异性响应,不同类型传感器阵列组合可以实现不同样品主体风味的特征分析,参考文献[13,21]的方法,取10.0 mL 汤汁于4 ℃离心(5 000 r/min,5 min)后取2.0 mL 无油上清液,装瓶密封后置于样品室检测。
试验做3 次重复,3 次重复样品混匀后做5个平行测试,样品室内工作温度为50 ℃,运行时间为90 s,均取70 s 时数据进行分析。
1.3.3 煮制过程中汤汁味觉特性分析 参考文献[14]的方法,将20.0 mL 汤汁于4 ℃离心(12 000 r/min,10 min)后取中层澄清无油样品,按照1∶5 质量比加入纯水,均质混匀后离心(12 000 r/min,5 min),上清液过滤(0.22 μm)后上机检测。
检测条件:样品体积为60.0 mL,基线调整时间为30 s,单样品测定周期为330 s,每次测试后使用基准液进行冲洗,冲洗时间为30 s,采集时间为30 s,做4 次重复,取后3 次数据进行分析。
试验做3 次重复,每次3 个平行,结果标记为:平均值±标准差。
1.3.4 煮制过程中汤汁游离氨基酸含量分析 参考国家标准GB/T 5009.124-2016[22]和文献[23-24]的方法,采用氨基酸自动分析仪进行氨基酸组分分析。
检测条件:分离柱为4.6 mm ID×60 mm L;柱温为57 ℃;检测波长为440 nm 和570 nm;缓冲液流速为0.4 mL/min;反应液为茚三酮试剂,流速为0.35 mL/min;进样量为20 μL,反应单元温度为140 ℃。
试验做3 次重复,每次3 个平行,结果标记为:平均值±标准差。
1.3.5 煮制过程中汤汁挥发性成分分析 参考文献[14,25-26]的方法,略有修改,均匀取2.0 mL 汤汁,经固相吸附柱富集后采用热脱附-气相色谱质谱联用仪进行挥发性物质组分分析。
固相吸附柱吸附工作条件为50 ℃,恒温30 min,同时添加0.182 μg 2-甲基-3-庚酮作为标准物质。
TDS 程序:初始温度40 ℃,以40 ℃/min 升温至210 ℃,保持5 min;
CIS 程序:初始温度-100 ℃,以10 ℃/min 升温至215 ℃,分流比为20∶1;
GC-MS 程序:初始温度40 ℃,以5 ℃/min 升温至200 ℃,保持1 min,再以10 ℃/min 升温至220 ℃,保持3 min。氦气流速1.0 mL/min,质谱传输线温度260 ℃,离子源温度280 ℃,质量扫描范围40~600 u。
试验做3 次重复,每次取10.0 mL 样品混匀后取2.0 mL 进行测试,以2-甲基-3-庚酮(99.9%,CAS 号13019-20-0,0.182 μg/μL),添加量为1.0 μL。
1.4 数据处理
运用Winmuster 软件进行产品风味的主成分分析(Principal component analysis,PCA)和线性判别分析(Linear discriminant analysis,LDA);在挥发性风味物质分析时,依据挥发性成分的CAS号进行化学物质检索分析(http://www.chemindex.com/)。试验数据均由SPSS 9.1 进行误差性分析(F=0.05),由Origin8.0 进行作图。
2 结果与分析
2.1 熏马肠煮制过程中汤汁中游离氨基酸组分变化
氨基酸组分,尤其是必需氨基酸含量,是评价肉制品营养价值高低的重要依据,同时也在风味呈现上起着重要作用[23,27-29],氨基酸也是功能特性呈现的重要载体[30],肉制品中的游离氨基酸含量受水解度等因素的影响[31]。
熏马肠煮制过程中汤汁游离氨基酸组分如表1、图1 所示,汤汁中游离氨基酸随煮制时间的延长逐渐增加,其中m0,m15,m30,m60,m75,m90之间差异不显著(P>0.05),m15,m30,m45,m60,m75,m90 之间差异不显著(P>0.05),m30,m45,m60,m75,m90,m105,m120 之间差异不显著(P>0.05),其它组之间具有显著性差异(P<0.05),m105 的游离氨基酸含量最大,与m120 差异不显著(P>0.05)。

图1 熏马肠煮制过程中汤汁总游离氨基酸含量变化Fig.1 Variation of free amino acid content of smoked horse sausage soup during cooking
天冬氨酸、谷氨酸是呈现鲜味的主要成分[32],天冬氨酸含量与总氨基酸含量变化趋势相似,随着煮制时间的延长而逐渐增加,m0 天冬氨酸含量最低,m0,m15,m30 之间差异不显著(P>0.05),m15,m30,m60,m75 之间差异不显著(P>0.05),m30,m45,m60,m75,m90 之间差异不显著(P>0.05),m45,m60,m75,m90,m105 之间差异不显著(P>0.05),m90,m105,m120 之间差异不显著(P>0.05),其它组样品均有显著性差异(P<0.05),其中m120 的天冬氨酸含量最高;谷氨酸含量随着煮制时间的延长而逐渐增加,m0 与m15 之间差异不显著(P>0.05),m15,m30,m75 之间差异不显著(P>0.05),m30,m45,m60,m75,m90,m105,m120之间差异不显著(P>0.05),其中m120 的谷氨酸含量较高。
苏氨酸、天冬氨酸、丝氨酸、甘氨酸、丙氨酸、精氨酸、脯氨酸和羟脯氨酸是呈现甜味的主要成分,精氨酸和脯氨酸是呈现苦味的主要物质[32]。随着煮制时间的延长,丙氨酸含量逐渐增加,m0 含量较低,与m15,m30 之间差异不显著(P>0.05),m30,m45,m60,m75 之间差异不显著(P>0.05),m45,m60,m75,m90,m105,m120 之间差异不显著(P>0.05),其中m120 丙氨酸含量最高;精氨酸、甘氨酸与之变化趋势相似,总体呈增加趋势;相较于m0,m120 丝氨酸含量虽有所降低但不显著(P>0.05);脯氨酸、羟脯氨酸变化趋势不明显,m120脯氨酸含量较高。
随着煮制时间的延长,缬氨酸含量总体呈增加趋势,m0,m15 差异不显著(P>0.05),m15,m30差异不显著(P>0.05),m30,m45,m60,m75 差异不显 著(P>0.05),m45,m60,m75,m90,m105,m120差异不显著(P>0.05),其它组之间有着显著差异(P<0.05);其它如甲硫氨酸、亮氨酸、异亮氨酸、酪氨酸、苯丙氨酸、组氨酸,亦与前述氨基酸变化趋势相似,总体呈增加趋势;汤汁中的半胱氨酸含量总体呈降低趋势,m0,m15,m45,m60,m75 差异不显著(P>0.05),m15,m30,m45,m60,m75,m90,m105,m120 差异不显著(P>0.05);而赖氨酸变化趋势不明显,总体来说,m120 赖氨酸含量较低。
如表2 所示,汤汁中呈鲜味、呈愉悦甜味、呈愉悦苦味的氨基酸百分比差异均不显著,然而,汤汁中氨基酸总量呈增加趋势,即呈味氨基酸的含量随着煮制时间的延长而增加。常亚楠等[33]在煮制鸡汤时,亦发现鸡汤中游离氨基酸成分呈增加趋势;刘登勇等[34]在对扒鸡卤汤反复煮制时,发现煮制次数越多游离氨基酸含量越多;Buscailhon等[35]在火腿成熟过程中,发现游离氨基酸含量会从3.6%迅速增加到16.6%,在终产品中含量为4.4%,呈增加趋势,与本文结果相似。



2.2 熏马肠煮制过程中汤汁味觉特性变化
味觉特性是肉制品重要的质量属性之一,也是决定消费者再次购买的重要参考[36],采用阵列传感器开展食品味觉的分析,是味觉特性的重要量化手段之一[37]。熏马肠煮制过程中,呈味物质释放过程如表3 所示,在煮制过程中,咸味值呈增加趋势,其中m0,m15,m30,m45,m60,m105 之间差异不显著(P>0.05),m30,m45,m60,m75,m105 之间差异不显著(P>0.05),m30,m60,m75,m90,m105,m120 之间差异不显著(P>0.05),m120 咸味值最高,与其它组具有显著性差异(P<0.05);鲜味物质的释放过程也呈增加趋势,其中m0 鲜味值最低,m120 鲜味值最高,均与其它组有显著差异(P<0.05),m15 和m30 差异不显著(P>0.05),m45,m60,m90,m105 之间差异不显著(P>0.05),m60,m75,m90,m105 之间差异不显著(P>0.05);汤汁的味觉丰富度呈增加趋势,m120 的味觉丰富度最高(P<0.05),m0,m15,m30,m45,m60,m105 之间差异不显著(P>0.05),m30,m45,m60,m75,m105之间差异不显著,m30,m60,m75,m90,m105 之间差异不显著(P>0.05);汤汁的苦味值随着煮制时间的延长而逐渐增加,其中,m75 的苦味值最小,与m0 没有显著差异(P>0.05),m30,m60,m90,m120 的苦味值高于m0,差异不显著(P>0.05),m15,m30,m45,m90,m120 的苦味值差异不显著(P>0.05),m15,m30,m45,m105 的苦味值差异不显著(P>0.05);汤汁的苦味回味值变化趋势不明显,其中m15 的苦味回味值最低(P<0.05),m45 的苦味回味值最高(P<0.05);汤汁的涩味值和涩味回味值变化趋势不明显,其中m120 的涩味值最高(P<0.05),涩味回味值也最高(P<0.05)。
游离氨基酸具有显著的呈味作用[38],盐分含量与游离氨基酸含量具有显著的正相关[39-40],熏马肠煮制过程中汤汁咸味值呈增加趋势,与2.1 节中游离氨基酸总量的变化趋势相似。产品的涩味值会受其它组分的影响,如蔗糖、氯化钠、柠檬酸或咖啡因[41],而本文中涩味值未呈现规律性变化,可能与煮制过程中发生的水解作用等因素有关[42]。
2.3 熏马肠煮制过程中汤汁主体风味变化
熏马肠煮制过程中汤汁主体风味差异如图2所示,由主成分分析结果显示,各样品在PC1 与PC2 的中方差贡献率为97.06%,具有良好的独立性,风味主体成分能代表各自产品的风味特征。m0,m120 与其它组均无交集,m15 与m45 有微小交集,m30,m45,m60 和m75 存在不同程度的交集,m90 和m105 存在部分交集,即煮制加工对汤汁主体风味成分产生了影响,其中m15,m30,m45,m60 和m75 较为相似。煮制时间达到90 min后,汤汁主体风味成分发生了显著变化,然而与煮制105 min 仍有相同组分,当煮制时间达到120 min 时,主体风味成分与其它组均有显著差异,与2.1 节中游离氨基酸含量的变化趋势相似。样品在LD1 和LD2 方向上的总方差贡献率为85.27%,且在LD1 和LD2 方向上,虽然部分样品组存在部分交集,但是均能够进行样品区分,即随煮制时间的延长,汤汁主体风味成分发生变化,通过风味主成分分析能够对不同组样品进行识别分析,与2.1节中游离氨基酸含量变化趋势相似。
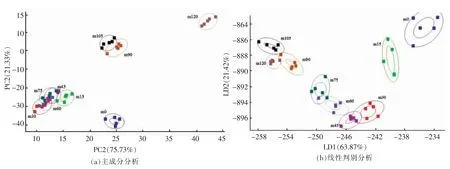
图2 熏马肠煮制过程中汤中的主体风味特征分析Fig.2 Main flavor characteristics analysis of smoked horse sausage soup during cooking
2.4 熏马肠煮制过程中汤汁挥发性物质组分变化
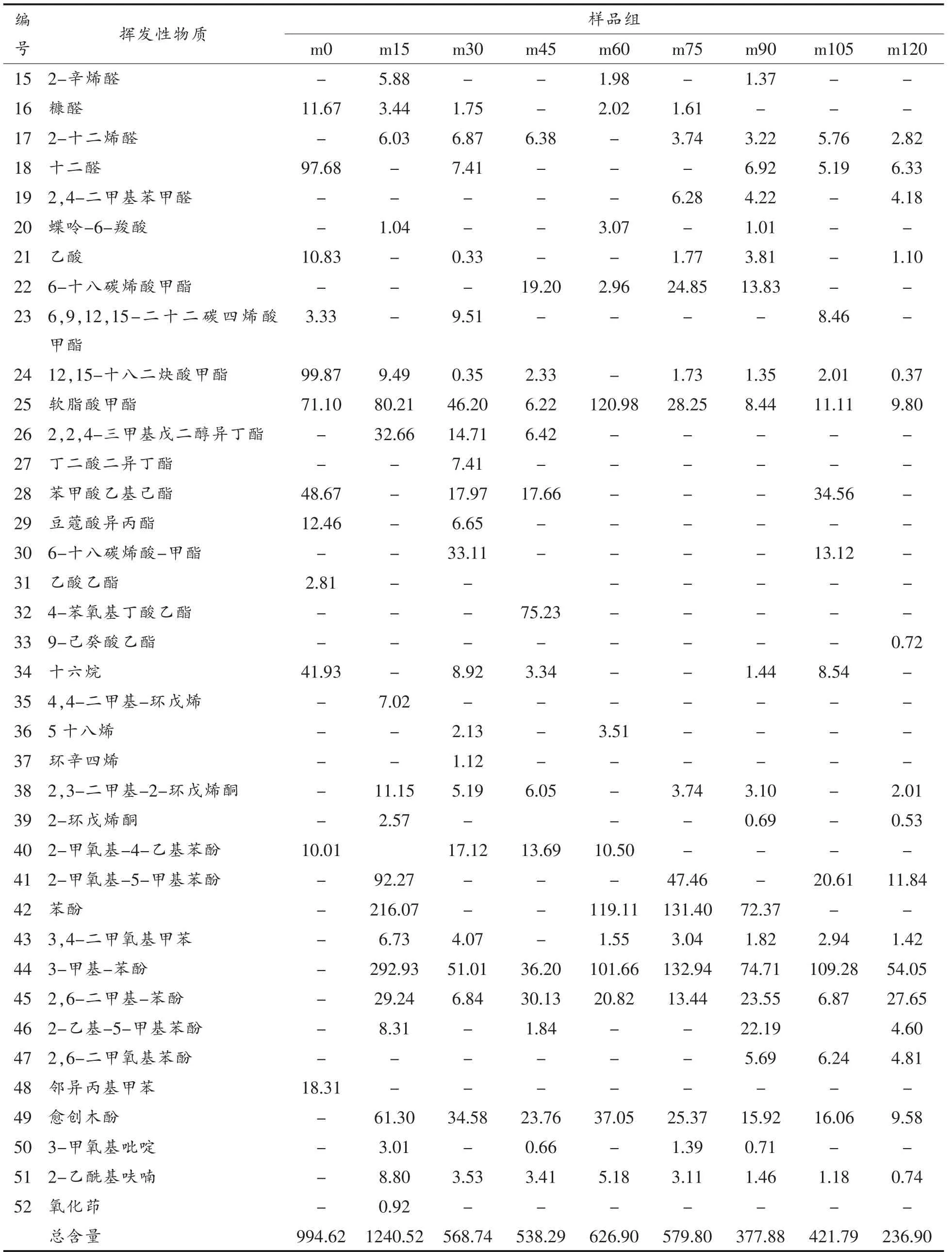
熏马肠煮制过程中汤汁挥发性成分见表4、图3 所示,汤汁中的挥发性物质含量呈先增加后降低的趋势,其中m15 挥发性物质含量最高,尤其是酚类和芳香族类物质的含量较高,这些物质也是金华火腿[43]、清爽型黄酒[44]等食品的重要风味成分。2.1 节中游离氨基酸含量呈增加趋势,其中m105 含量较高,而汤汁中挥发性物质含量在后期呈降低趋势,其中m120 含量最低,说明煮制时间的延长有助于汤汁滋味的丰富,然而不利于香味的保留。

图3 熏马肠汤汁挥发性物质含量变化Fig.3 Variation of volatile substances of smoked horse sausage soup
汤汁挥发性风味成分中,均检测到的组分为苯甲醛、软脂酸甲酯,两者均为重要的香气成分[45-46],其中苯甲醛含量呈降低趋势,软脂酸甲酯的含量则呈先增加后降低的趋势。所有样品中均检测出己醛,己醛是脂肪氧化的产物之一,其含量与氧化程度有关[47-48],说明熏马肠样品制备过程中发生了氧化反应,且脂肪氧化产物在马肉制品主体风味形成上有重要作用[49]。各组产品挥发性物质组分存在差异,说明改变煮制时间可以获得不同风味的产品,与2.3 节的结果一致。
汤汁中尚存在2-癸烯-1-醇、正戊醇你、2-乙基己醇、十二醛等变化趋势不明显的挥发性物质,这与熏马肠的加工过程及其原辅料的添加有关,也与复杂的微生物菌相有关[8],造就了熏马肠独特的风味特征。

表4 熏马肠煮制过程中汤中的挥发性物质(ng)Table 4 Volatile substances content of smoked horse sausage soup during cooking(ng)
(续表4)
3 结论
1)通过对熏马肠煮制过程中的滋味和风味物质释放进行研究,表明汤汁煮制时间不同形成不同的挥发性物质组分,均具有独特的风味特征,通过风味主体成分分析能够对不同产品进行区分。依据挥发性成分中含量及变化,PC1 为酚类和芳香族类化合物呈现的特征,其次是酯类或醛类。汤汁中游离氨基酸含量随着煮制时间的延长而增加,而呈鲜味氨基酸、呈愉悦甜味氨基酸和呈愉悦苦味氨基酸的百分比差异不显著。汤汁咸味值、丰富度、鲜味值均呈逐渐升高的趋势,苦味值、苦味回味值、涩味回味值变化不规律,煮制120 min 时涩味值显著升高。
2)熏马肠煮制过程中,汤汁味觉特征越来越明显,而风味强度会逐渐降低,即汤汁最终呈现给消费者的主要是味觉享受。结合煮制过程中游离氨基酸含量、滋味特征、风味特性的变化,煮制105 min 时,汤汁中的游离氨基酸含量较多,风味物质得到一定保持,咸味值、鲜味值和丰富度均处于较高水平,且此时汤汁的涩味没有明显增加,较适宜作为加工参数。

