人工感染维氏气单胞菌对杂交鲟体内组织抗菌肽含量的影响
张永芳, 张 飘, 蒋 娴, 米文琴, 冉越宇, 杨 浪, 姜海波, 文 明,2*
(1. 贵州大学动物科学学院,贵州 贵阳 550025; 2. 贵州省动物生物制品工程技术研究中心,贵州 贵阳 550025)
鲟鱼源于白垩纪时期的古老软骨鳞鱼,为硬骨鱼纲(Osteichthyes)辐鳍亚纲 (Actinopterygii)软骨硬鳞总目(Chondrostei)鲟形目(Acipenseriformes)的成员,其肉味鲜美、营养丰富,深受广大消费者的喜爱[1]。近年来,贵州省冷水鱼养殖产业特别是杂交鲟养殖得到快速发展,但杂交鲟疾病特别是细菌性疾病的危害也愈来愈大,因此细菌性疾病的防治研究成为保障鲟鱼养殖产业健康发展的重点之一。
抗菌肽(AMPs)是1类广泛存在于自然界生物体中的小肽类物质,是机体先天性免疫系统的重要组成部分[2]。自20世纪80年代发现第1个抗菌肽即天蚕素(cecropins)并证明其具有抑菌作用后,迄今已发现2 000多种天然抗菌肽[3,4]。由于抗菌肽具有广谱的抗菌活性和较大的研发价值,有关抗菌肽在水产养殖中的研究报道较多,如盲鳗(Myxineglutinosa)、虹鳟(Oncorhynchus)、大西洋鲑(Salmosalar)等的应用研究[5~7],而对鲟鱼的应用研究鲜有报道。本试验以维氏气单胞菌人工感染杂交鲟,检测分析抗菌肽在感染杂交鲟体内组织的含量动态规律,以期为抗菌肽在鲟鱼养殖上的开发利用提供科学依据和参考。
1 材料与方法
1.1 实验动物、菌种及试剂(1)实验用杂交鲟:购自贵州大学水产研究所,共20尾,体重0.7~0.8 kg,体长(55±5)cm,于室内水族箱中养殖, 养殖水使用循环泵和充气泵。(2)实验用维氏气单胞菌菌种:贵州大学动物疫病研究所惠赠,-80 ℃超低温冰箱15%甘油保存。(3)主要试剂:脑心浸液(BHI)肉汤培养基,购自杭州微生物试剂有限公司;抗菌肽ELISA检测试剂盒,购于江苏绿叶生物科技有限公司。
1.2 维氏气单胞菌菌种复苏取保存的维氏气单胞菌菌种1 mL于灭菌BHI液体培养基中,37 ℃恒温摇床培养12 h,以麦氏比浊法调整菌液浓度为1.0×108CFU/mL。
1.3 杂交鲟人工感染与样品采集取杂交鲟随机分为2组:正常对照组、人工感染组。正常对照组5尾,腹腔注射灭菌BHI培养液0.2 mL/尾;人工感染组15尾,腹腔注射维氏气单胞菌液0.2 mL/尾。人工感染组分别在感染后24、48、96 h采集脾脏、肝脏、心脏、肌肉、肠道、鳃组织样品;正常对照组在96 h 采集。各组织样本置于 -80 ℃冰箱保存备用。
1.4 杂交鲟体内组织抗菌肽含量测定首先按照抗菌肽ELISA检测试剂盒说明书,以抗菌肽标准品为参照物,建立抗菌肽含量与D450 nm值线性相关标准曲线和方程。然后取保存的杂交鲟组织样品,剪取各组织样品10 g于研钵中,加入生理盐水 1.0 mL,研磨匀浆,3 000 r/min离心10 min,取上清液,按照ELISA试剂盒检测步骤测定组织样品中的抗菌肽D450 nm值,分析抗菌肽含量变化动态。
1.5 数据统计分析收集正常对照组和人工感染组杂交鲟各个组织抗菌肽含量检测数据进行方差分析,以p-Value为依据,判定其是否具有统计学意义的差异。
2 结果
2.1 抗菌肽测定标准曲线绘制按照抗菌肽ELISA检测试剂盒说明书,取抗菌肽标准品系列稀释为待测样品进行ELISA检测,计6个稀释度,每个稀释度测3个重复,以抗菌肽标准品稀释度(含量)为横坐标,每个稀释度D450 nm值为纵坐标,建立抗菌肽含量与D450 nm值的标准曲线(见图1)。经测算,抗菌肽含量与其D450 nm值呈现良好的线性关系,其标准曲线线性方程为y=288.18x-3.157(R2=0.992 4)。
2.2 人工感染杂交鲟体内组织抗菌肽含量动态分析由表1、图2可见:(1)正常对照组6个组织均有抗菌肽表达,其中在鳃和肠道组织中含量最高,而在肝脏中含量最低。(2)与正常对照组比较,人工感染组杂交鲟6个组织抗菌肽含量在不同时间段上均呈明显升高,差异显著(P<0.05)。其中:在24 h和96 h鳃和肠道组织抗菌肽含量明显升高,差异极显著(P<0.01);在48 h肝脏、肌肉、心脏、脾脏抗菌肽含量明显升高,差异极显著(P<0.01)。
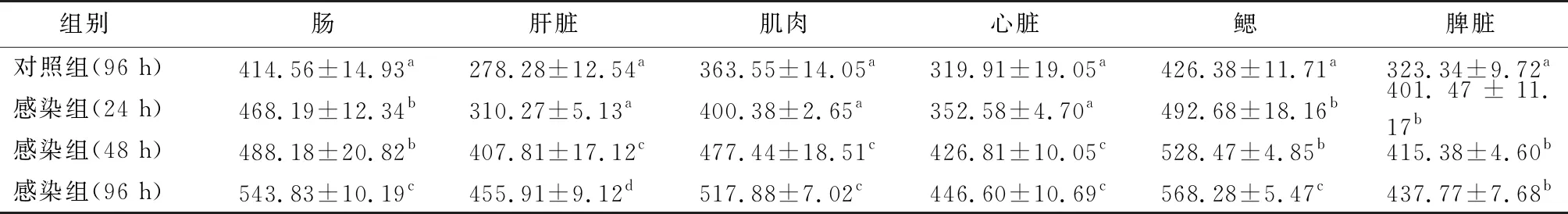
表1 各组杂交鲟体内组织抗菌肽D450 nm值
注:同列数据肩标相同字母表示差异不显著(P>0.05);肩标相邻字母表示差异显著(P<0.05);肩标相间字母表示差异极显著(P<0.01)
3 结论
本实验结果表明:杂交鲟在维氏气单胞菌感染后其机体内抗菌肽含量显著升高,提示抗菌肽在杂交鲟抗细菌感染中可能发挥着重要作用,这为今后抗菌肽在杂交鲟产业疾病防控中的研发提供了参考依据。
4 讨论
4.1抗菌肽不仅具有抗菌功能,而且还对真菌、病毒和肿瘤具有一定的抑制作用,因此抗菌肽愈来愈受到养殖行业的重视。目前有关鱼类抗菌肽研究资料较多,但大多是从mRNA水平上开展研究,较少从蛋白水平进行研究分析。在外界因素刺激下(包括病原微生物感染),动物机体(包括鱼类)的抗菌肽基因mRNA水平可能得到明显提升,但不一定有效地表达出抗菌肽[8]。因此,采用实时荧光定量PCR方法进行抗菌肽基因水平的检测,并不能真实反映动物机体抗菌肽含量变化。
4.2本实验采用ELISA方法检测人工感染维氏气单胞菌后杂交鲟6个组织器官抗菌肽的含量发现:正常对照组和人工感染组杂交鲟鳃和肠中抗菌肽含量较其他组织高,且人工感染组极显著高于正常对照组(P<0.01)。这与李伟等[9]研究正常牙鲆的结果“肝、鳃和脾等抗菌肽含量较高,而心和肠抗菌肽含量较低”不尽一致,可能是由于杂交鲟的鳃和肠与外界病原微生物接触机会较多,受到刺激后产生的抗菌肽含量就会相对较高。本实验结果还发现:无论是正常对照组还是人工感染组,杂交鲟肌肉组织的抗菌肽含量较心脏、脾脏、肝脏组织的含量高。这可能是本实验在采集肌肉组织时未能完全剥离皮肤组织,而鱼类皮肤组织表面黏液抗菌肽含量相对较高,从而导致本实验检测的肌肉组织抗菌肽含量相对较高。有研究资料表明,某些鱼类体内抗菌肽还具有针对性,如石斑鱼抗菌肽主要针对气单胞菌[10]。本实验只进行了单一维氏气单胞菌感染杂交鲟的抗菌肽含量变化分析,要明确杂交鲟抗菌肽是否具有针对性,还需进一步实验证实。

