益气活血解毒方治疗晚期上皮性卵巢癌疗效相关靶基因筛选
李娟 翁洁琼 卢雯平
摘要:目的 采用mRNA芯片探究益氣活血解毒方维持治疗晚期上皮性卵巢癌(AEOC)气虚血瘀证疗效相关基因靶点,明确其有效作用机制。方法 观察AEOC气虚血瘀证患者服用益气活血解毒方维持治疗后的无进展生存期(PFS),选取PFS最长的8例为敏感组,PFS最短的8例为不敏感组。采用mRNA芯片检测2组患者治疗后血液mRNA表达情况,并对差异表达基因进行GO、KEGG、singal-net、path-net生物信息学分析,实时荧光定量PCR(qRT-PCR)验证。结果 益气活血解毒方疗效相关差异表达基因共1157个(P<0.05),其中上调基因497个,下调基因660个。qRT-PCR显示,MAPK3、HLA-DOA、CD40、KIR2DL3差异表达有统计学意义(P<0.05)。结论 益气活血解毒方治疗AEOC气虚血瘀证患者的疗效机制可能在于抑制MAPK3及与免疫通路相关的HLA-DOA、CD40、KIR2DL3靶基因。通过对益气活血解毒方作用靶基因的探究,可为AEOC气虚血瘀证微观辨证及中医精准治疗提供依据。
关键词:晚期上皮性卵巢癌;mRNA芯片;益气活血解毒方;气虚血瘀证;靶基因
中图分类号:R273.731 文献标识码:A 文章编号:1005-5304(2020)04-0028-07
DOI:10.3969/j.issn.1005-5304.201910465
Screening of Target Genes Related to Efficacy of Yiqi Huoxue Jiedu Decoction
for Advanced Epithelial Ovarian Cancer
LI Juan, WENG Jieqiong, LU Wenping
Guanganmen Hospital, China Academy of Chinese Medical Sciences, Beijing 100053, China
Abstract: Objective To explore the gene targets related to efficacy of Yiqi Huoxue Jiedu Decoction for maintenance treatment of advanced epithelial ovarian cancer (AEOC) with qi deficiency and blood stasis syndrome using mRNA chip; To clarify effective mechanism. Methods Progression-free survival (PFS) of the AEOC patients with qi deficiency and blood stasis syndrome after taking Yiqi Huoxue Jiedu Decoction for maintenance treatment was observed, and 8 cases with the longest PFS (sensitive group) and 8 cases with the shortest PFS (insensitive group) were selected. Application of mRNA chip was used to detection the expression of mRNA in patients blood of two groups. And differentially expressed genes were analyzed by gene ontology, KEGG, singal-net, path-net bioinformatics analysis, and real-time fluorescence quantitative PCR (qRT-PCR) for verification. Results Totally 1157 differentially expressed genes related to efficacy of Yiqi Huoxue Jiedu Decoction were screened out, of which 497 up-regulated genes and 660 down-regulated genes. qRT-PCR results showed that there was statistical significance in MAPK3, HLA-DOA, CD40 and KIR2DL3 (P<0.05). Conclusion It is found that inhibition of MAPK3 pathway and co-regulating HLA-DOA, CD40 and KIR2DL3 related immune pathways may be an effective mechanism for Yiqi Huoxue Jiedu Decoction to treat AEOC patients with qi deficiency and blood stasis syndrome. The exploration of the target genes of Yiqi Huoxue Jiedu Decoction can provide the basis for the microscopic syndrome differentiation of AEOC with qi deficiency and blood stasis syndrome and the accurate treatment of TCM.
Keywords: advanced epithelial ovarian cancer; mRNA chip; Yiqi Huoxue Jiedu Decoction; qi deficiency and blood stasis syndrome; target genes
卵巢癌是病死率最高的妇科恶性肿瘤,75%的卵巢癌在诊断时已为晚期[1-2]。尽管抗血管生成药物和聚腺苷酸二磷酸核糖基聚合酶抑制剂已应用于卵巢癌的维持治疗中,并显示出一定效果,但5年生存率仍不足40%,且因价格昂贵和伴随高血压及贫血等不良反应,限制了其临床应用[3]。探究卵巢癌的生物学特点并寻找低毒价廉的维持治疗方法已成为临床迫切需要解决的问题[4]。
中医药在卵巢癌维持治疗中应用广泛。益气活血解毒方是我们在张锡纯理冲汤基础上加减而成,前瞻及真实世界的临床研究均显示其对晚期上皮性卵巢癌(advanced epithelial ovarian cancer,AEOC)的维持用药可延长患者无进展生存期(PFS),提高生活质量,但有效作用机制尚未明确[5-6]。本研究采用人基因表达谱芯片,分析益气活血解毒方治疗AEOC气虚血瘀证敏感人群与不敏感人群的差异表达基因,进行生物信息学分析并验证,探究益气活血解毒方治疗AEOC气虚血瘀证疗效相关的基因靶点。现报道如下。
1 资料与方法
1.1 一般资料
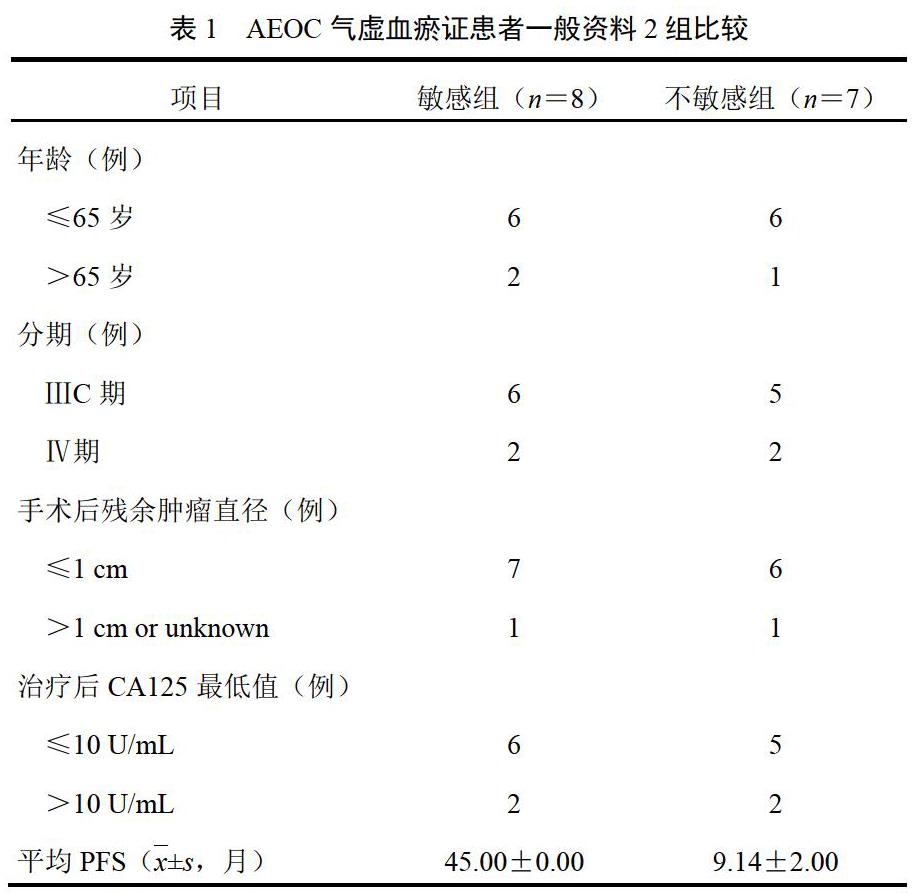
选择2015年3月-2016年12月中国中医科学院广安门医院肿瘤科门诊经益气活血解毒方维持治疗的AEOC患者300例,随访至2018年12月。PFS为3~45个月,服药时间(24.0±1.6)月。选取PFS最长的8例为敏感组,PFS最短的8例为不敏感组。由于不敏感组1例血液样本mRNA检测时不符合Affymetrix的官方芯片质检标准而排除,故为8︰7行疗效相关差异基因分析。2组PFS比较差异有统计学意义(P<0.01);年龄、分期、手术后残余肿瘤直径、治疗后糖类抗原(CA)125最低值比较差异无统计学意义(P>0.05),具有可比性,见表1。本研究经中国中医科学院广安门医院伦理委员会审查批准(2014EC035)。
1.2 西医诊断标准
参照《中国常见恶性肿瘤诊治规范》[7],根据症状、体征、影像学检查,并经细胞学和/或组织学检查确认,选取ⅢC/Ⅳ期的AEOC患者。分期采用2014年国际妇产科联盟(FIGO)分期[8]。
1.3 中医辨证标准
参照《中药新药临床研究指导原则(试行)》[9]制定气虚血瘀证辨证标准。症见乏力,气短,疼痛,肤色晦黯;舌脉:舌黯,有瘀斑,舌下静脉青紫,舌苔薄白或有齿痕,脉弱而涩。
1.4 纳入标准
①符合上述西医诊断标准及中医辨证标准;②年龄18~80岁;③完成减瘤术未超过6个月;④完成6~8个周期的铂类加紫杉醇类化疗未超过1个月;⑤患者对本研究知情,并签署知情同意书。
1.5 治疗方法
患者均予益气活血解毒方,药物组成:黄芪30 g,女贞子15 g,枸杞子15 g,白术15 g,山药15 g,三棱6 g,莪术9 g,青皮6 g,乌药6 g,肉桂6 g,白花蛇舌草15 g,青蒿12 g。饮片由中国中医科学院广安门医院药房提供。每日1剂,水煎取汁300 mL,早晚各1次口服。服药半年后(若半年内疾病进展则在进展时进行)抽取外周血10~15 mL,采用mRNA提取试剂盒提取mRNA后保存。每3个月随访1次,随访至疾病进展或至2018年12月研究结束。
1.6 mRNA提取及芯片检测
采用IANGEN RNAprepPure血液总RNA提取试剂盒从患者外周血样中提取总RNA,使用GeneChip 3 IVT PLUS Reagent Kit将总RNA制备为纯化aRNA,并将其片段化后与GeneChip? PrimeViewTM Human Gene Expression Array芯片探针杂交、洗染、扫描等得到图片和原始数据,筛选P<0.05且差异倍数>1.2的基因為差异表达基因。
1.7 生物信息学分析
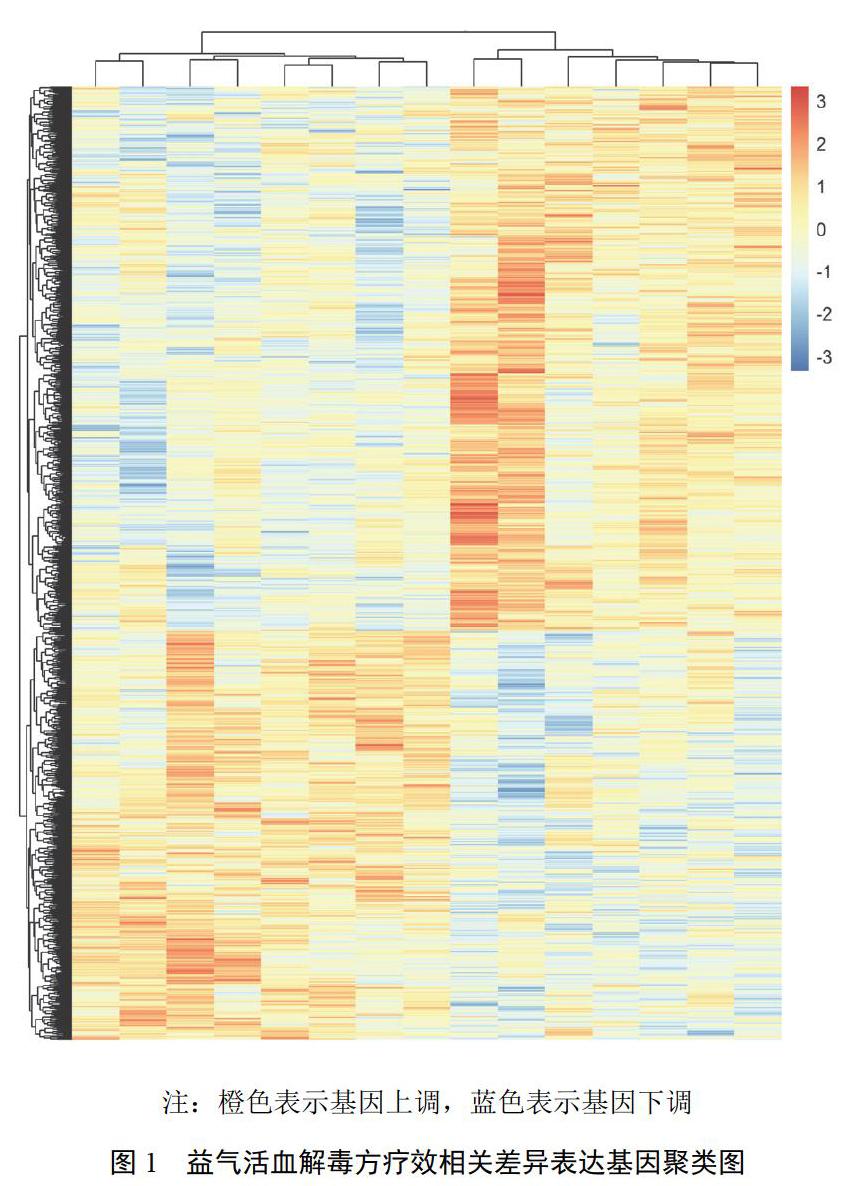
为全面直观地展示2组基因表达的关系及差异,将差异表达基因做无监督层次聚类分析,以热图形式显示。应用基因本体论(GO)分析差异表达基因的主要功能,GO分析根据差异表达基因的分子功能和生物过程将基因分为不同层次类别,以揭示差异表达基因调控网络[10]。利用京都基因与基因组百科全书(KEGG),分析差异表达基因的显著通路[11]。根据KEGG数据库中信号通路的上下游关系,建立各通路间的相互作用网络(path-net)分析[12]。基于GO和KEGG分析,建立全局信号转导网络(signal-net)分析差异表达基因间的相互作用,以分析得到核心关键基因[13]。
1.8 实时荧光定量PCR
实时荧光定量PCR(qRT-PCR)采用Trizol试剂(Life Technologies)从血液样本中分离总RNA,用反转录试剂盒(Takara)转录至cDNA。采用SYBR Green试剂(Bio-Rad)平行测定3次。采用2-ΔΔCt法通过相对定量方法比较2组mRNA表达量。
1.9 统计学方法
采用SPSS22.0统计软件进行分析。计量资料以—x±s表示,2组PFS比较采用非参数估计(Mann-Whitney U检验);计数资料采用卡方检验,2组一般资料比较采用Fisher确切概率法;等级资料采用秩和检验。P<0.05表示差异有统计学意义。
2 结果
2.1 疗效相关差异表达基因及聚类分析
经益气活血解毒方治疗,2组mRNA芯片检测得到差异表达基因1157个,其中上调基因497个,下调基因660个。聚类图见图1。
2.2 疗效相关差异表达基因基因本体论分析
对疗效相关差异表达基因行GO分析。前10个上调基因涉及核转录mRNA分解代谢过程,SRP依赖的共翻译蛋白靶向膜,核糖体RNA加工,病毒转录,平移起始,淀粉样前体蛋白生物合成过程的监管,气管腺体发育,翻译,基因表达,B细胞增殖,详见表2。
前10个下调基因涉及嗜中性粒细胞脱颗粒,消化丝氨酸磷酸化,RNA聚合酶Ⅱ启动子转录的正调控,细胞内信号转导,脂肪垫的开发,GTPase活性的正调控,受体活性的正调控,细胞对缺氧的反应,毛囊成熟,细胞脂代谢过程,详见表3。
2.3 疗效相关差异表达基因的京都基因与基因组百科全书分析
对疗效相关差异表达基因行KEGG分析。前10个上调的通路涉及同种异体移植排斥,自身免疫性甲状腺疾病,B细胞受体信号通路,造血细胞谱系,抗原处理及呈递,EB病毒感染,病毒性心肌炎,核糖体,移植物抗宿主病,Ⅰ型糖尿病,详见表4。
前10个下调的通路涉及MAPK信号通路,调节肌动蛋白细胞骨架,表皮生长因子受体酪氨酸激酶抑制剂耐药,癌症蛋白聚糖,黏着斑,促性腺激素信号通路,补体和凝血级联,T细胞受体信号通路,Rap1信号通路,FoxO信号通路,详见表5。
2.4 相互作用网络分析疗效相关差异表达基因触发的核心通路
基于显著差异通路的数据,path-net分析揭示了益气活血解毒方治疗后疗效相关的核心通路。Degree≥10的核心通路及上下调情况为MAPK信号通路下调,T细胞受体信号通路下调,肌动蛋白细胞骨架的调节下调,抗原处理及呈递上调,补体和凝血级联下调,B细胞受体信号通路上调,细胞黏附分子上调,癌症通路下调。信号通路的度越高,说明其受到其他通路的调控或被其他通路调控,其在信号网络中的作用越重要。见表6、图2。
2.5 疗效相关差异表达基因触发的核心基因
根据差异表达基因显著的GO功能和KEGG通路富集,signal-net分析揭示了该方维持治疗差异疗效的核心基因。在signal-net中获得了120个关键基因,更高的度表明这些基因与其他基因具有很强相关性,它们在信号网络中发挥着更重要的作用。见图3。
Degree≥6的核心基因是MAPK3,AKT3,MAPK13,MAPK14,CTNNB1,FOXO3,MYC,GNG12,ENTPD1,PPP2R1B。见表7。
2.6 实时荧光定量PCR验证
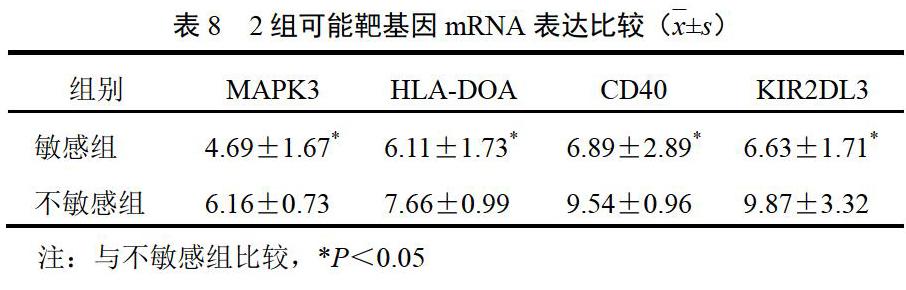
对2组患者行qRT-PCR验证可能的靶基因,与不敏感组比较,敏感组MAPK3、HLA-DOA、CD40、KIR2DL3的基因表达明显降低,差异有统计学意义(P<0.05)。見表8。
3 讨论
卵巢癌致死率高,精准治疗是未来趋势。前期临床研究表明,益气活血解毒方维持治疗AEOC气虚血瘀证可提高PFS,但相同证型的患者中药治疗后的PFS不尽相同,证型与体质密切相关,体质禀于先天、关于后天[14-16]。本研究从mRNA角度探讨益气活血解毒方的有效机制,通过探究治疗优势人群作用靶基因,为AEOC气虚血瘀证微观辨证及中医精准治疗提供依据。本研究通过mRNA芯片检测益气活血解毒方维持治疗2组的差异表达基因并分析验证,得到一些可能的靶基因。
益气活血解毒方敏感组自然杀伤细胞抑制性受体KIR2DL3下调,提示该方可能通过下调KIR2DL3发挥抗肿瘤作用。KIR2DL3是自然杀伤细胞的KIR抑制性受体,阻断自然杀伤细胞抑制性KIR受体与肿瘤细胞KIR配体间的结合,有助于恢复自然杀伤细胞抗肿瘤作用,此为自然杀伤细胞免疫检查点阻断疗法的理论依据。MD安德森癌症中心发起的抗KIR药物Lirilumab治疗骨髓异常增生综合症研究显示安全性和有效性良好[17]。本研究中,敏感组患者KIR2DL3明显下调,只有不敏感组的60%,说明益气活血解毒方可通过下调KIR2DL3释放肿瘤微环境中的免疫刹车,促进自然杀伤细胞的抗肿瘤作用。
本研究显示,敏感组HLA-DOA表达下调,抗原处理及呈递通路上调。人类白细胞抗原DM(HLA-DM)可对肿瘤抗原肽编辑以便被CD4+T细胞识别,DO分子对HLA-DM分子功能有负向调节作用,HLA-DOA表达水平可以反映机体抗肿瘤免疫监视的强弱[18]。提示益气活血解毒方可能是通过提高肿瘤微环境中抗原呈递能力,如下调HLA-DOA、上调HLA-DM,以上调CD4+T细胞表达,进而提高抗肿瘤免疫效应。
本研究发现,敏感组CD40的表达下调,对患者的生存起正面影响。CD40是肿瘤坏死因子受体(TNF-R)超家族成员,对肿瘤细胞具有促增殖和促凋亡的双重作用,可促进肿瘤血管生成和肿瘤扩散[19-20],作为免疫应答中的共刺激分子提高免疫识别,增强机体抗肿瘤免疫反应[21-22],可与CD4+T细胞结合,促进T细胞活化[23],CD40的双重作用可能导致它在肿瘤生长和抑制中的角色较为复杂。Qu等[24]发现,CD40可诱导卵巢癌细胞迁移。故益气活血解毒方可能通过下调CD40延长卵巢癌患者的生存期。CD40在促进T细胞活化的缺失,可由其他刺激因子弥补,如上述HLA-DOA的下调机制。
本研究显示,敏感组MAPK通路下调,ERK1(MAPK3)基因下调。MAPK通路异常激活能导致肿瘤发生,越来越多的证据表明,MAPK通路可以促进肿瘤微环境的免疫抑制,抵抗免疫疗法[25]。抑制MAPK通路可显著提高免疫疗法的疗效,主要通过增强肿瘤细胞的抗原呈递、增强MHC-Ⅰ表达、抑制Tregs扩增等途径,MAPK通路抑制剂联合免疫疗法是肿瘤治疗的新方向[26],目前正在进行的几项免疫检查点抑制剂联合MAPK通路抑制剂的临床试验早期结果显示,对肿瘤生长有协同抑制作用,对患者生存有益[27-28]。细胞外调节蛋白激酶(ERK)是MAPK通路的中心成员,MAPK/ERK通路异常活化是控制85%以上的人类癌症细胞增殖、转移和耐药的关键[29-30]。表明该通路和基因可能是益气活血解毒方的有效靶点。
我们利用预测生存和预后价值的Kaplan-Meier Plotter数据库分析MAPK3、HLA-DOA、CD40、KIR2DL3与Ⅲ/Ⅳ期AEOC患者PFS之间的关系[31]。结果提示,MAPK3、HLA-DOA、CD40、KIR2DL3的mRNA表达为危险因素,其表达越低,患者预后越好。
综上,益气活血解毒方治疗AEOC气虚血瘀证患者的机制可能在于抑制MAPK通路,协同调节HLA-DOA、CD40、KIR2DL3相关免疫通路,以提高抗原呈递,增强抗肿瘤免疫反应;益气活血解毒方治疗的优势人群可能为对MAPK3、HLA-DOA、CD40、KIR2DL3敏感的人群;通过对益气活血解毒方治疗优势人群作用靶基因的探究,可为AEOC气虚血瘀证微观辨证及中医精准治疗提供依据。
本研究为中医药有效机制探讨提供了新思路。但只检测了中药治疗后患者mRNA表达水平,未检测服药前后表达变化。下一步拟开展临床研究,检测益气活血解毒方维持治疗前后HLA-DOA、CD40、KIR2DL3、MAPK3基因的mRNA和蛋白表达,分析与患者生存的关系,进一步明确益气活血解毒方治疗该病的有效机制和靶点。
参考文献:
[1] SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2019[J]. CA Cancer J Clin,2019,69(1):7-34.
[2] LHEUREUX S, BRAUNSTEIN M, OZA A M. Epithelial ovarian cancer:Evolution of management in the era of precision medicine[J]. CA Cancer J Clin,2019,69(4):280-304.
[3] LU H, ARSHAD M, THORNTON A, et al. A mathematical-descriptor of tumor-mesoscopic-structure from computed-tomography images annotates prognostic- and molecular-phenotypes of epithelial ovarian cancer[J]. Nat Commun,2019,10(1):764.
[4] 中国抗癌协会妇科肿瘤专业委员会.中国卵巢上皮性癌维持治疗专家共识(2019)[J].中国实用妇科与产科杂志,2019,35(6):655-659.
[5] 卢雯平,马丹,闫会苓,等.晚期卵巢癌常规治疗后中医维持治疗的疗效分析[J].国际中医中药杂志,2014,36(1):13-16.
[6] 夏恺,闫荟苓,卢雯平.益气活血解毒方对晚期卵巢癌患者无复发生存时间及生活質量的影响[J].中国医药,2014,9(2):244-246.
[7] 中华人民共和国卫生部医政司.中国常见恶性肿瘤诊治规范[M].2版.北京:北京医科大学中国协和医科大学联合出版社,1996:16.
[8] MUTCH D G, PRAT J. 2014 FIGO staging for ovarian, fallopian tube and peritoneal cancer[J]. Gynecol Oncol,2014,133(3):401-404.
[9] 郑筱萸.中药新药临床研究指导原则(试行)[M].北京:中国医药科技出版社,2002:216-224.
[10] ASHBURNER M, BALL C A, BLAKE J A, et al. Gene ontology:tool for the unification of biology. The Gene Ontology Consortium[J]. Nat Genet,2000,25:25-29.
[11] KANEHISA M, GOTO S, KAWASHIMA S, et al. The KEGG resource for deciphering the genome[J]. Nucleic Acids Res,2004,32(Database issue):D277-280.
[12] YI M, HORTON J D, COHEN J C, et al. WholePathwayScope:a comprehensive pathway-based analysis tool for high-throughput data[J]. BMC Bioinformatics,2006,7:30.
[13] LI C, LI H. Network-constrained regularization and variable selection for analysis of genomic data[J]. Bioinformatics,2008, 24(21):1175-1182.
[14] 秦静波,王济,孟翔鹤,等.表观遗传学与体质可调论关系的探析[J].辽宁中医杂志,2018,45(4):727-729.
[15] 张振华,李娟,卢雯平.益气活血解毒方治疗晚期卵巢癌有效可能的单核苷酸多态性位点及基因靶点[J].中国医药,2018,13(4):601-605.
[16] 夏恺,车焕丽,卢雯平.晚期卵巢癌中医证型分布规律研究[J].新中医,2013,45(4):109-112.
[17] YALNIZ F F, DAVER N, REZVANI K, et al. A pilot trial of lirilumab with or without azacitidine for patients with myelodysplastic syndrome[J]. Clin Lymphoma Myeloma Leuk,2018,18(10):658-663,e2.
[18] BELLEMARE-PELLETIER A, TREMBLAY J, BEAULIEU S, et al. HLA-DO transduced in human monocyte-derived dendritic cells modulates MHC classⅡ antigen processing[J]. J Leukoc Biol,2005,78(1):95-105.
[19] KORNILUK A, KEMONA H, DYMICKA-PIEKARSKA V. Multifunctional CD40L:pro- and anti-neoplastic activity[J]. Tumour Biol,2014, 35(10):9447-9457.
[20] OUSSA N A, DAHMANI A, GOMIS M, et al. VEGF requires the receptor nrp-1 to inhibit lipopolysaccharide-dependent dendritic cell maturation[J]. J Immunol,2016,197(10):3927-3935.
[21] MURUGAIYAN G, MARTIN S, SAHA B. CD40-induced countercurrent conduits for tumor escape or elimination?[J]. Trends Immunol, 2007,28(11):467-473.
[22] DUNNILL C J, IBRAHEEM K, MOHAMED A, et al. A redox state- dictated signalling pathway deciphers the malignant cell specificity of CD40-mediated apoptosis[J]. Oncogene,2017,36(18):2515-2528.
[23] LEVIN N, PATO A, CAFRI G, et al. Spontaneous activation of antigenpresenting cells by genes encoding truncated homo-oligomerizing derivatives of CD40[J]. J Immunother,2017, 40(2):39-50.
[24] QU Q X, HUANG Q, XU J, et al. CD40 signal regulates CXCR4 mediating ovarian carcinoma cell migration:implications for extrapelvic metastastic factors[J]. Oncol Res,2013,20(9):383- 392.
[25] LIU C, PENG W, XU C, et al. BRAF inhibition increases tumor infiltration by T cells and enhances the antitumor activity of adoptive immunotherapy in mice[J]. Clin Cancer Res,2013,19(2):393-403.
[26] ATSAVES V, LEVENTAKI V, RASSIDAKIS G Z, et al. AP-1 transcription factors as regulators of immune responses in cancer[J]. Cancers (Basel),2019,11(7):1037-1058.
[27] TAWBI HA H, AMARIA R N, GLITZA I C, et al. Safety and preliminary activity data from a single center phase Ⅱ study of triplet combination of nivolumab (N) with dabrafenib (D) and trametinib (T) [trident] in patients (Pts) with BRAF-mutated metastatic melanoma (MM)[J]. J Clin Oncol,2018,36(15_suppl):9560.
[28] DUMMER R, FERN?NDEZ A M A, HANSSON J, et al. Preliminary findings from part 1 of COMBI-i:A phase Ⅲ study of anti–PD-1 antibody PDR001 combined with dabrafenib (D) and trametinib (T) in previously untreated patients (pts) with advanced BRAF V600-mutant melanoma[J]. J Clin Oncol,2018,36(5_suppl):189.
[29] DE LUCA A, MAIELLO M R, D'ALESSIO A, et al. The RAS/RAF/MEK/ERK and the PI3K/AKT signalling pathways:role in cancer pathogenesis and implications for therapeutic approaches[J]. Expert Opin Ther Targets,2012,16(Suppl 2):S17-27.
[30] CHEN K, LIU M X, MAK C S, et al. Methylation-associated silencing of miR-193a-3p promotes ovarian cancer aggressiveness by targeting GRB7 and MAPK/ERK pathways[J]. Theranostics,2018, 8(2):423-436.
[31] GY?RFFY B, LANCZKY A, EKLUND A C, et al. An online survival analysis tool to rapidly assess the effect of 22277 genes on breast cancer prognosis using microarray data of 1809 patients[J]. Breast Cancer Res Treat,2010,123(3):725-731.
(收稿日期:2019-10-29)
(修回日期:2019-11-21;編辑:季巍巍)
基金项目:国家自然科学基金(81473566)
通讯作者:卢雯平,E-mail:lu_wenping@sina.com

