皮下注射α-干扰素治疗2019年新型冠状病毒肺炎的循证快速评估
陈岷,童荣生,边原,舒永全,杨勇,杜姗,李文渊,刘心霞,闫峻峰,龙恩武,何林
(四川省医学科学院·四川省人民医院,电子科技大学附属医院药学部,个体化药物治疗四川省重点实验室,成都 610072)
新型冠状病毒肺炎在全球蔓延,其确诊人数和增长速度均超过2003年“严重急性呼吸综合征”(severe acute respiratory syndrome,SARS)。根据《传染病防治法》的相关规定,基于目前对新型冠状病毒肺炎的病原、流行病学、临床特征等特点的认识,国家卫生健康委员会决定将新型冠状病毒肺炎纳入法定传染病乙类管理,采取甲类传染病的预防、控制措施。
冠状病毒(Coronaviruses,CoVs)属冠状病毒科(Coronaviridae),其下包括4属:Alpha Coronavirus(α-CoV)、Beta Coronavirus(β-CoV)、Gamma Coronavirus(γ-CoV)、Delta Coronavirus(δ-CoV),可感染人和多种动物,引起宿主呼吸道、肠道、肝和神经系统疾病,其中又以β-CoVs对人类危害最烈。此前的中东呼吸综合征相关冠状病毒(MERS-CoV)、严重急性呼吸综合征相关冠状病毒(SARS-CoV)以及本次新型冠状病毒(国际病毒分类委员会命名为SARS-CoV-2)均属于β属冠状病毒。冠状病毒属的病毒是具外套膜(envelope)的正链单股RNA病毒,直径80~120 nm,其遗传物质是所有RNA病毒中最大的,感染人、鼠、猪、猫、犬、狼、鸡、牛、禽类脊椎动物。病毒有包膜,包膜上存在棘突,整个病毒像日冕,不同的冠状病毒的棘突有明显的差异。病毒粒子外包着脂肪膜,膜表面有3种糖蛋白:刺突糖蛋白(S,Spike Protein,是受体结合位点、溶细胞作用和主要抗原位点);小包膜糖蛋白(E,Envelope Protein,较小,与包膜结合的蛋白);膜糖蛋白(M,Membrane Protein,负责营养物质的跨膜运输、新生病毒出芽释放与病毒外包膜的形成)。此外,病毒颗粒中央的病毒基因组上结合有核壳体蛋白(nucleocapsid protein,N)也是主要结构蛋白之一,与病毒RNA复制和病毒的出芽、成熟相关。冠状病毒的5’-端帽子结构之后有60~80个碱基的先导序列和200~500个碱基的非编码区,3’-端有poly(A)尾。这一结构与真核mRNA十分相似,是RNA自身即可发挥翻译模板作用的结构基础[1]。目前显示SARS-CoV-2与蝙蝠SARS样冠状病毒(bat-sl-coVZC45)同源85%[2]。
人体产生的已知的干扰素共有13种,分为三大类:Ⅰ型,Ⅱ型,Ⅲ型。Ⅰ型干扰素以IFN-α与IFN-β为主由先天性免疫细胞分泌;Ⅱ型干扰素即IFN-γ,主要由活化后的T细胞分泌产生;Ⅲ型干扰素为几种IFN-λ,其已知的分布与功能都比较有限。Ⅰ型干扰素是参与抗病毒免疫的重要效应分子。它的产生主要由先天性免疫细胞(主要是巨噬细胞)表面或内部受体(Toll like receptor,NOD like receptor,RIG-I receptor,cGAS等)接触到病毒特异性的抗原物质,然后通过胞内的信号分子传递,最终激活转录因子IRF3/7从而启动I型干扰素基因的表达。根据干扰素蛋白质一级结构的不同,又可分成α、β、γ 三种不同的类型,分别由白细胞、成纤维细胞和免疫淋巴细胞产生,具有抗病毒、抗细胞分裂及免疫调节活性。
目前,临床上抗病毒治疗主要使用α-干扰素,临床上α-干扰素主要用于急慢性病毒性肝炎和其他病毒病毒性疾病。而在SARS和MERS的治疗中,虽然有一些关于干扰素的临床研究,但因其结果不一致,并未列入诊疗指南中。根据国家卫健委和国家中医药管理局于2020年2月4日发布的《新型冠状病毒感染的肺炎诊疗方案(第五版)》,目前主要是针对患者症状进行对症治疗,尚无有效的抗病毒药物,可尝试使用α-干扰素雾化吸入或洛匹那韦/利托那韦(LPV/r)进行抗病毒治疗,或可加用利巴韦林。我国尚无雾化吸入用α-干扰素制剂的药品,临床用药为注射用α-干扰素作为雾化制剂使用,需纳入“超说明书用药”的管理,同时使用雾化α-干扰素的射流式雾化器对器械要求也比较高,因此,临床药师运用循证药学快速评价方法,对SARS和MERS治疗中使用皮下注射α-干扰素进行抗病毒治疗的临床研究进行分析,评价在2019新型病毒治疗中使用皮下注射α-干扰素的可能性。
1 资料与方法
1.1PICO问题转换 根据循证药学的PICO法原则(包含:患者或问题、干预措施、对照干预措施及结局指标)将需要临床决策的问题转化为P:SARS或MERS,I:干扰素,C:安慰药,O:有效率,不良反应发生率。
1.2文献检索
1.2.1检索数据库 计算机检索中国期刊全文数据库(CNKI)、维普中文科技期刊全文数据库(VIP)、万方数据库(WangfangData)、中国生物医学文献数据库(CBM)、Cochrane library、PubMed等数据库,此外,检索WHO网站、美国和中国疾控中心网站、国家卫健委网站发表的疾病诊疗指南。然后再用文献追溯和人工查阅文献等方法作为辅助。
1.2.2检索词 采用主题词与自由词相结合的方式,根据数据库不同,适当调整检索策略:包括非典型肺炎、非典、严重急性呼吸综合征、SARS、MERS、冠状病毒、干扰素、interferon、IFN等。
1.2.3检索年限 2003年1 月—2020 年2月1日。
1.2.4检索策略
①中文数据库以中国知网为例:SU=干扰素 and (非典型肺炎 or 中东呼吸综合征) and *冠状病毒
②英文数据库以PubMed为例
#1:(((Coronaviren[MeSH Terms])) AND (interferon[MeSH Terms])) AND (Middle East respiratory syndrome[Title/Abstract])
#2:(((Coronaviren[MeSH Terms])) AND (interferon[MeSH Terms])) AND (Acute Respiratory Syndrome[Title/Abstract])
#3:#1AND#2
1.3纳入与排除标准
1.3.1纳入标准 研究纳入标准:①研究对象:SARS、MERS患者;②研究类型:随机对照试验(RCT),队列研究,病例-对照研究,回顾性观察研究,病例报道等;③干预措施:采用干扰素进行治疗;④对照措施:安慰药或其他治疗方法;⑤结局指标:有效率(生存率、治愈率)和不良反应发生率(死亡率、严重不良反应发生率);⑥指南性文件,包括:临床指南、国家级学会/ 团体的专家共识;⑦因语言限制只纳入中文和英文文献。
1.3.2排除标准 ①仅有摘要无全文的文献资料以及数据不完整无法利用的文献;②离体细胞试验及动物试验。
1.4结局指标 ①有效结局指标,主要结局指标:死亡率,治愈率;次要结局指标:入住ICU比例,机械通气比例,氧饱和度,激素用量减少率。②不良反应发生率。
1.5文献质量评价 系统评价质量评定采用AMSTAR量表[3];RCT采用Cochrane系统评价员手册5.1.0推荐的RCT偏倚风险评估工具;评价内容包括以下6个方面:①随机方法;②分配隐藏;③对研究对象、治疗方案实施者、研究结果测量者采用盲法;④结果数据完整性,包括干预前基线水平测量值和干预后效应参数值、失访/退出情况以及是否对失访原因加以说明;⑤选择性报告研究结果,即对于安全性问题、阴性结果是否进行报道?⑥其他偏倚来源,包括试验早停、基线不平衡等。针对每篇纳入文献,对上述6项作出“是”(低度偏倚)、“否”(高度偏倚)和“不清楚”(缺乏相关信息或偏倚情况不确定)的判断。
对于队列研究采用Newcastle-Ottawa Scale(NOS) 评价量[4]表对研究进行质量评价。一般认为大于5分为质量良好。
1.6文献数据 提取所有原始文献的纳入由2名评价员背靠背独立进行,然后交叉核对,存在意见分歧时,由第3名研究者参与决定纳入与否。资料提取内容包括研究的作者和年代、样本量、受试者基本情况、干预措施、对比措施、剂量、疗程、随访时间、有效结局指标、不良反应发生率等[5-12]。
2 结果
2.1文献检索的结果 初检获得文献1502篇,按纳入排除标准逐层筛选后,最终纳入文献11篇,含3篇指南[13-15],8篇临床研究(包括1项系统评价[6],6项回顾性队列研究[7,9-10,12-14],1项病例报道[9])。文献检索流程图见图1。
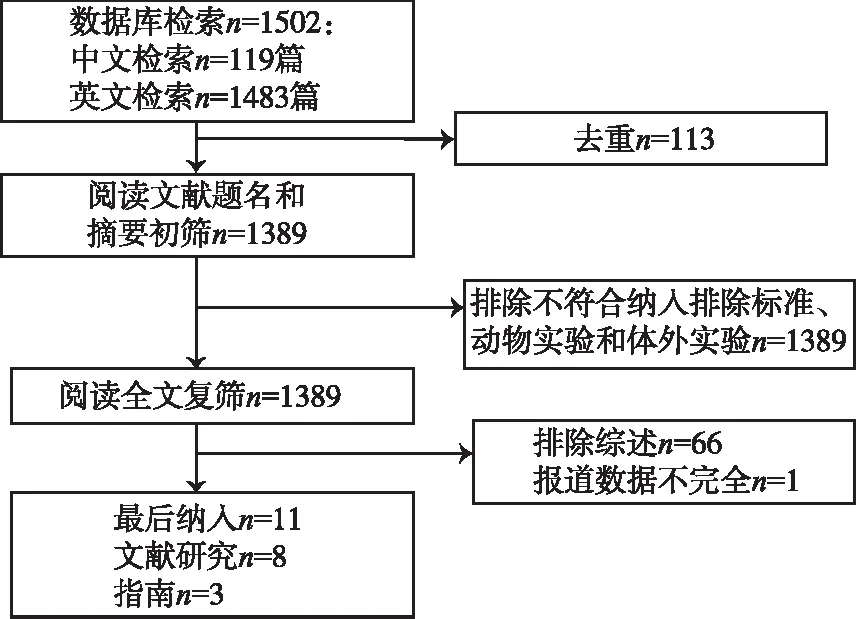
图1 文献检索流程
2.2纳入研究的质量评价
2.2.1系统评价的质量评定 根据AMSTAR量表,在11项评估项目中,文献8得分为7分,质量一般。
2.2.2队列研究的质量评定 根据Newcastle-Ottawa Scale (NOS)文献质量评价量表,评定其选择性、可比性、结局等内容。见表1。
2.3纳入文献的基本信息及结果
2.3.1队列研究 纳入的一项系统评价[6]中,有关于使用干扰素治疗MERS的8项研究共116例患者纳入最后评价。实验组α-干扰素 (包括α-干扰素-2a,α-干扰素- 2b,α-干扰素-1a)联合利巴韦林,其中α-干扰素-2a(n=35),每周180 μg,α-干扰素-2b(n=22),每周100~180 μg,β-干扰素-1a(n=12),每周44 μg。有效性研究显示,实验组和对照组患者死亡率相似,均为71%,各种类型的干扰素之间患者死亡率差异无统计学意义。而不良反应方面,关于α-干扰素与利巴韦林联合治疗的不良反应,2例患者胰腺酶升高,1例患者在α-干扰素-2a联合利巴韦林治疗时出现明显的溶血。值得一提的是,在13例患者中,有报道从患者入院确诊病毒感染到开始使用抗病毒药物(干扰素和利巴韦林)的时间,平均为12 d,因此考虑两组无差别是否与用药时间延迟有关。
在纳入的6项回顾性队列研究[5,7-8,10-12]中, MOMATTINA等[7]两项队列研究,一项是采用α-干扰素与利巴韦林片联合治疗对比支持治疗,14 d内生存率明显高于对照组(70%和29%,P=0.004)。然而,两组存活率在28 d内差异无统计学意义(30%和17%;P=0.054);在本研究的另一个队列研究中,实验组中纳入使用β-干扰素和α-干扰素,对照组单独使用利巴韦林,结果3组治愈率分别为78.3%,75%,68.4%,差异无统计学意义。
SHALHOUB等[7]回顾性队列研究中,共24例患者,实验组(n=13)α-干扰素-2a(每周180 μg,ih)联合利巴韦林(负荷剂量2 g,po,序贯600 mg,bid),对照组(n=11)β-干扰素-1a(44 μg,qod,ih)联合利巴韦林。实验组患者死亡率为85%(11/13),对照组死亡率为64% (7/11),P=0.24。实验组生存天数为21.3 d,95%CI(14.1 28.5)d,而对照组生存天数为21.4 d,95%CI(12.4 30.4)d,P=0.977。
OMRANI等[8]队列研究中,共44例患者,实验组20例,PEG-α-IFN-2a(每周180 μg,ih,连续2周)。对照组24例,采用其他支持治疗。有效性指标中,14 d生存率:实验组14例(70.0%),对照组7例(29.2%),P=0.00;28 d生存率:实验组6例(30.0%),对照组4例(16.7%),P=0.54。不良反应比较,除了血红蛋白减少外,两组不良反应相似,治疗组血红蛋白减少明显大于对照组(P=0.002),但并未中断治疗。同样值得注意的是,两组均在诊断后中位数为3 d开始治疗,所以,延迟开始治疗可能没有好处。在严重的MERS-CoV感染患者中,利巴韦林和α-干扰素-2a治疗在14 d后能显著提高生存率,但在28 d后并没有显著提高生存率。长期生存的益处,可能很难在较小的研究中显示出来。
ARABI等[10]的回顾性队列研究中,纳入349例患者,其中实验组144例,其中利巴韦林+γ-干扰素组117例,利巴韦林组18例;γ-干扰素组9例;对照组205例,使用干扰素或利巴韦林以外的其他治疗。结局指标是90 d死亡率和病毒清除率。结果两组90 d死亡率差异无统计学意义(P=0.87),两组病毒清除率差异无统计学意义(P=0.29),亚组分析证明干扰素种类之间差异无统计学意义。不良反应发生率上,两组患者血红蛋白、白细胞计数、血小板计数、天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、胆红素、INR、乳酸盐和肌酐的水平,两组差异无统计学意义(P>0.05)。文章也提到利巴韦林+γ-干扰素开始使用中位时间是患者入住重症监护病房后2 d。
李建国等[11]回顾性队列研究纳入87例患者,实验组(n=41)以糖皮质激素联合α-干扰素(100万U·d-1)治疗为主;对照组(n=46)以糖皮质激素治疗为主。实验组减少激素用量和减少患者住院天数,差异有统计学意义。对白细胞减少差异无统计学意义。使用α-干扰素治疗,可缩短患者的住院时间,促进肺部病变的吸收,减少对激素的需求量,但不会缩短发热持续时间。
LOUTFY等[12]回顾性队列研究中,纳入22例患者,实验组(n=9)使用泼尼松50 mg,bid,静脉滴注,或甲强龙40 mg,bid,静脉滴注,根据情况变化可以加用甲强龙500 mg,qd,静脉滴注,连续3 d,随后逐渐减量。α-干扰素-1a使用9 μg·d-1,每天2次,如果没有效果增加到15 μg·d-1,疗程8~13 d。对照组(n=13)使用糖皮质激素进行治疗。有效率指标:①实验组胸部影像改善50%的中位时间为4 d(范围2~5 d),对照组为9 d(范围4~12 d),P=0.02。②实验组血氧饱和度高于对照组(P=0.02)。结果两组患者发热及淋巴细胞减少情况相似。③对照组中,5例转入重症监护病房,3例需要插管和机械通气,1例死亡。实验组9例患者中,3例转入重症监护病房,1例需要插管和机械通气,无死亡。④对照组在较短时间内可达到50%的肺部X线异常分辨率(中位时间,4和9 d,P=0.001;氧饱和度更好,P=0.02,更快地解决补充氧的需求(中位数10和16 d;P=0.02)。而在不良反应上,患者对α-干扰素的耐受性良好,不良事件极少。报告的单一临床不良事件为发热,ANC短暂性下降和血清转氨酶水平升高有关,两者均在停药后1~2 d内消失,似乎没有临床后果。
2.3.2病例报道 在几个回顾性病例报道[5,9]中, MOMATTIN等[7]报道2例,患者在14 d内均好转出院,但几个月后死于其他并发症,其间出现血小板计数下降,淀粉酶升高,转氨酶升高等不良反应。AL-TAWFIQ等[9]报道的5例中,从入院到使用利巴韦林和干扰素治疗的中位时间为19 d(范围10~22 d)。所有患者对支持性或治疗性干预均无反应,均死于疾病。因此作者认为,在病程中较晚被诊断为多种共病的危重症患者可能不会受益于联合抗病毒治疗。在住院后48 h内或诊断为SARS后使用利巴韦林的早期治疗已被证明与更好预后相关。
2.3.3指南共识 在3项推荐的指南或共识中[13-15],以及WHO和国家卫健委新颁布的2019新型冠状病毒诊疗指南[2,16]中,只有国家卫健委颁布的《新型冠状病毒感染的肺炎诊疗方案(第五版)》提到雾化α-干扰素可能有效,以及韩国的《中东呼吸综合征抗病毒治疗指南》中提到干扰素可能有效。
2.4结论 基于以上证据,本快速评估得出以下有限结论:①皮下注射α-干扰素在治疗SARS和MERS中14 d内有效率和对临床症状的改善高于对照组,但是28 d有效率与对照组差异无统计学意义。②强调皮下注射器α-干扰素的早期使用,剂量为100~180 μg·d-1,尽可能在确诊冠状病毒感染后48 h内使用,随着用药时间与确诊时间的延长,有效率降低。③各种类型的干扰素之间治疗效果无显著性差异。④皮下注射α-干扰素与利巴韦林联合使用在个别研究中证实有效,但需要警惕其不良反应。不良反应多为可耐受的血红蛋白下降,转氨酶升高,淀粉酶升高,但多数不影响治疗。
3 讨论
3.1本研究的建议 2003年SARS以及2013年MERS爆发后,研究者就开始筛选有效的抗病毒药物,但至今并未研制出成熟有效的药物,因此,在SARS-CoV-2来袭时,“老药新用”也成为药物研发的一个热点。干扰素作为一个传统的抗病毒药物,在抗肝炎病毒,疱疹病毒等方面有着较好的效果,而在之前的SARS,MERS治疗中,也有一些临床研究显示其有效。其药理作用主要是宿主细胞内染色体DNA中的干扰素基因受抑制蛋白控制,呈静止状态。当病毒感染或干扰素诱导剂刺激下,细胞产生灭活抑制蛋白的特异性因子,使干扰素基因抑制得以释放。由干扰素基因生成特异的干扰素mRNA,并在细胞内的核蛋白体中,在此特异的干扰素mRNA指导下合成干扰素蛋白,并释放到细胞外。α-干扰素的抗病毒作用主要是通过其与被病毒感染细胞的细胞膜上的干扰素受体结合,结合到这些受体上有很高的亲和力,每个细胞上表达的数目可达500~20 000个。α-干扰素与受体结合后激活受染细胞内抗病毒蛋白基因,生成抗病毒蛋白mRNA,诱生多种抗病毒蛋白 (AVP),此类 AVP 能够切断病毒的mRNA,抑制病毒蛋白的翻译,还可能抑制病毒的穿入、脱壳及装配。最终抑制病毒的复制。干扰素还具有多重免疫调节作用,可提高巨噬细胞的吞噬活性和增强淋巴细胞对靶细胞的特异性细胞毒等,促进和维护机体的免疫监视、免疫防护和免疫自稳功能。
基因组研究表明,SARS-CoV-2与SARS-CoV、MERS-CoV的全基因组对比发现有40%~70%的序列相似性,且SARS-CoV-2通过S-蛋白与ACE2 蛋白的相互作用从而感染呼吸道上皮细胞,并在结构上维持SARS-CoV的S-蛋白与ACE2蛋白相互作用的结构构象[17]。因此,目前病毒的蛋白结构与SARS/MERS有很多共同之处,尽早使用皮下注射的α-IFN对SARS-CoV-2可能有效。
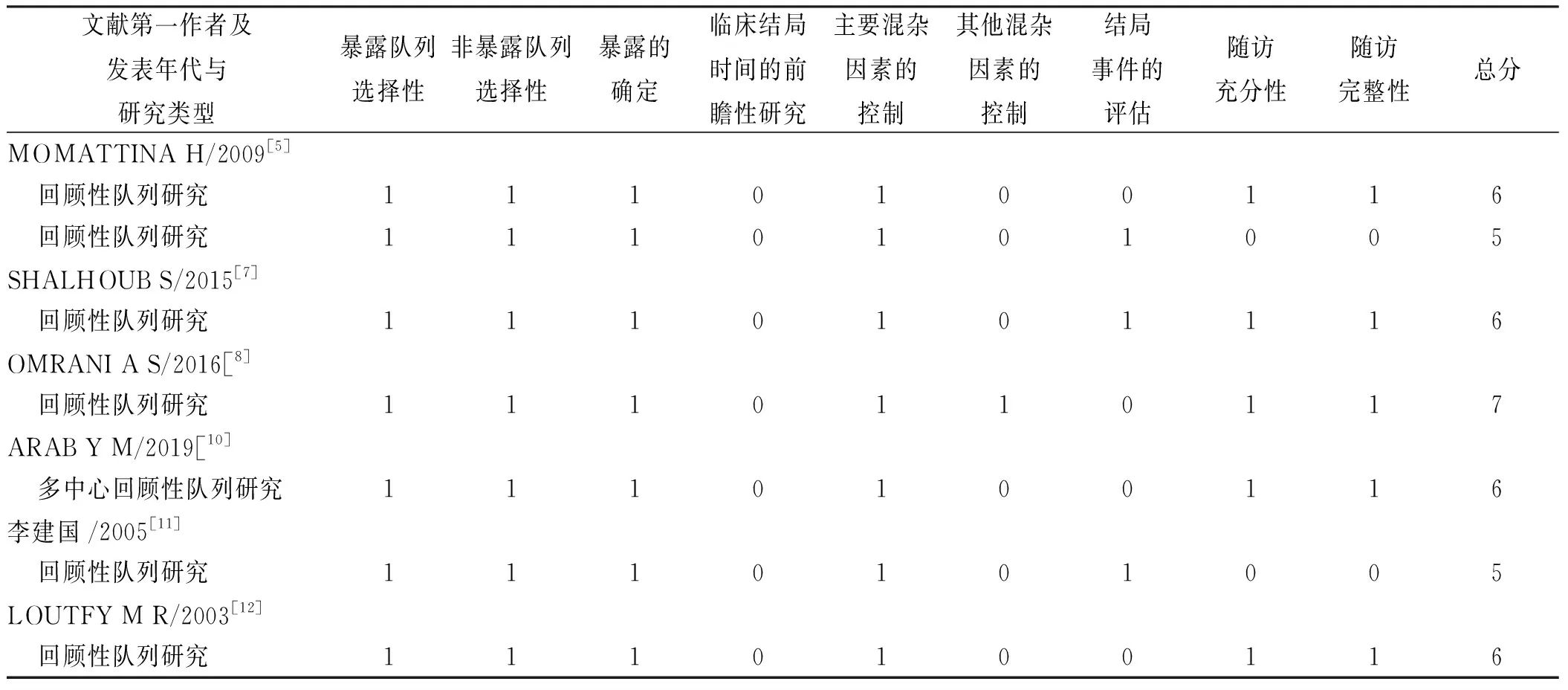
表1 纳入队列研究的NOS质量评定
3.2局限性 本研究为循证快速评估,因指南和临床研究异质性较大,且文献质量不高,无法定量分析。建议尽快展开更大样本的随机对照的试验以及真实世界研究。

