幽门螺杆菌感染小鼠胃内菌群、短链脂肪酸变化及丁酸盐对胃癌细胞增殖迁移的影响
刘庭玉,高振军,沈曼茹,黄继英,唐鄂,张国新
复旦大学附属中山医院青浦分院,上海201799
幽门螺杆菌为革兰阴性微需氧菌,属于胃内微生态环境中的代表性菌,已被世界卫生组织列为Ⅰ类致癌因子,根除幽门螺杆菌可有效降低胃癌发生率[1]。幽门螺杆菌感染可竞争性抑制胃内其他菌群定植,导致胃内菌群丰度改变,从而影响菌群代谢物的产生及其含量变化[2]。丁酸属于短链脂肪酸的一种,可由胃内菌群代谢生成,在调节宿主代谢、免疫系统和细胞增殖方面均具有关键作用。丁酸是丁酸盐在体内的主要成分,目前关于其是否参与胃癌的发生鲜见报道。2015年8月~2017年3月,本研究观察了幽门螺杆菌对小鼠胃内常见菌群及短链脂肪酸的影响,并探讨丁酸盐对胃癌细胞增殖、迁移的影响,以期为探讨幽门螺杆菌促进胃癌发生的相关机制提供依据。
1 材料与方法
1.1 材料 动物:SPF级C57BL/6雌性小鼠24只,体质量18~22 g,周龄6~8周,购于南京医科大学实验动物中心。细胞:人胃癌细胞系AGS购于上海ATCC研究所。菌株:VacA(+)、CagA(+)的幽门螺杆菌悉尼菌株(H.pylori SS1)购于上海ATCC研究所。主要试剂:FBS、RPMI 1640购于美国Gibco公司,青/链霉素混合液购于上海碧云天生物技术有限公司,布氏肉汤、哥伦比亚琼脂、丁酸盐购于美国Sigma公司,脱纤维绵羊血购于南京羊血供应站,混合型气体(10% CO2、5% O2、85% N2)购于南京天泽气体有限责任公司。主要仪器:高效液相色谱仪购于美国Waters Beeze公司。
1.2 幽门螺杆菌感染小鼠胃内常见菌群及短链脂肪酸变化观察
1.2.1 动物分组处理 所有小鼠适应性饲养1周,随机分为幽门螺杆菌组及对照组,每组12只。幽门螺杆菌组灌胃前禁食24 h、禁水6 h,每只小鼠先给予2% NaHCO30.1 mL灌胃,15 min后给予浓度为3×108cfu/mL的H.pylori SS1菌液0.3 mL灌胃;隔日1次,共3次。对照组禁食24 h、禁水6 h,给予布氏肉汤0.4 mL灌胃;隔日1次,共3次。两组灌胃后均禁食、禁水12 h,随后恢复正常饮食饮水。两组灌胃后6、12个月分别取6只小鼠,均予颈椎脱臼法处死,解剖取出胃组织,立即置于液氮中,随后转移至-80 ℃冰箱保存。
1.2.2 胃内常见菌群丰度检测 采用real-time PCR法。取两组灌胃后12个月的胃组织,将组织用剪刀剪碎,置于匀浆器中搅拌至泥浆样。采用细菌基因组DNA提取试剂盒提取DNA,由上海诺百生物科技有限公司完成细菌标准品的制备。按照1×102~1×109每10倍梯度,使用Biophotmeter检测仪自动制备标准曲线;根据制成的标准曲线,计算每个待测样本的数目。PCR反应体系10 μL:去离子水3.6 μL, SYBR Green(包括4×dNTP,MgCl2和Taq聚合酶,10×缓冲液)5 μL,上、下游引物(25 mmol/L)各0.2 μL,DNA提取模版1.0 μL。PCR反应条件:95 ℃预变性2 min,95 ℃变性10 s,60 ℃退火30 s,70 ℃延伸45 s,共40个循环,4 ℃保存。使用温度梯度PCR扩增仪检测乳酸杆菌、柔嫩梭菌、拟球梭菌、普氏杆菌、拟脆弱杆菌、肠杆菌及幽门螺杆菌等菌群丰度。
1.2.3 胃组织乙酸、丙酸、丁酸水平检测 采用高效液相色谱法。取两组灌胃后6、12个月的胃组织各100 mg,加入1 mol/L盐酸饱和氯化钠溶液100 μL进行酸化。配置SCFAs标准品10 mg/mL,并依次稀释为1、5、10、50、500 μg/mL的标准圈样本。使用高效液相色谱仪检测乙酸、丙酸、丁酸水平,参数设置:流速10 μL/20 min,柱温为室温,检测波长210 nm。
1.3 丁酸盐对胃癌细胞增殖、迁移的影响观察
1.3.1 细胞增殖能力观察 采用CCK-8法。将胃癌细胞系AGS传代接种至6孔板,调整细胞密度为1×105~5×105/孔,随机分为丁酸盐组和空白对照组。丁酸盐组分别加入终浓度为0.5、1.0、2.5 mmol/L的丁酸盐,空白对照组未予特殊处理,作用24 h。将两组细胞按3×103~5×103/孔接种于96孔板,每组设5个复孔。每孔加入完全培养基100 μL,于37 ℃、5% CO2培养箱中进行培养,接种孔四周加入PBS 100 μL。两组分别于培养0、12、24、48 h向孔中加入CCK-8溶液10 μL,37 ℃孵育1 h。采用酶标仪检测450 nm波长处的光密度(OD)值,以此表示细胞增殖能力。
1.3.2 细胞侵袭能力观察 采用Transwell侵袭实验。将胃癌细胞系AGS传代接种至6孔板,调整细胞密度为1×105~5×105/孔,随机分为丁酸盐组和空白对照组。丁酸盐组加入终浓度为2.5 mmol/L的丁酸盐,空白对照组未予特殊处理,作用24 h。收集两组细胞,重悬于无血清培养液中,调整细胞密度为1×105/100 μL。于Transwell小室上室加入细胞悬液100 μL、含2% FBS的RPMI 1640培养液200 μL,下室加入含10%~20% FBS的RPMI 1640培养液600 μL,置于37 ℃、5% CO2培养箱中培养36 h。取出孔板,常规进行固定、染色,显微镜下对进入下室的细胞进行计数。
2 结果
2.1 幽门螺杆菌组与对照组胃内常见微生物菌群丰度情况 幽门螺杆菌组胃内的微生物菌群按照丰度排序依次为:幽门螺旋杆菌(0.908 5±0.119 6)lg cfu/mg,柔嫩梭菌(0.763 4±0.108 5)lg cfu/mg,拟球梭菌(0.759 7±0.102 4)lg cfu/mg,乳酸菌(0.748 2±0.094 6)lg cfu/mg,普氏菌(0.690 2±0.040 3)lg cfu/mg。对照组胃内的微生物菌群按照丰度排序依次为:拟球梭菌(0.724 2±0.175 5)lg cfu/mg,乳酸菌(0.722 6±0.115 9)lg cfu/mg,肠杆菌(0.707 5±0.093 3)lg cfu/mg,柔嫩梭菌(0.705 8±0.082 5)lg cfu/mg。
2.2 幽门螺杆菌组与对照组胃组织乙酸、丙酸、丁酸水平比较 幽门螺杆菌组灌胃后6个月胃组织丁酸水平高于对照组(P<0.05)。与灌胃后6个月比较,幽门螺杆菌组与对照组灌胃后12个月胃组织乙酸、丙酸、丁酸水平均升高,且幽门螺杆菌组升高更明显(P均<0.05)。见表1。
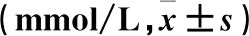
表1 幽门螺杆菌组与对照组胃组织乙酸、丙酸、丁酸水平比较
注:与同组灌胃后6个月比较,*P<0.05;与对照组同时间点比较,#P<0.05。
2.3 丁酸盐组与空白对照组细胞增殖能力比较 与对照组同时间点比较,加入不同浓度丁酸盐的丁酸盐组作用24、48 h的OD值均升高(P均<0.05)。相同作用时间下,丁酸盐组OD值随着丁酸盐浓度的升高而升高,以2.5 mmol/L作用48 h时的OD值最高(P均<0.05)。见表2。

表2 丁酸盐组与空白对照组细胞增殖能力比较
注:与空白对照组同时间点比较,*P<0.05;与加入0.5 mmol/L丁酸盐的丁酸盐组比较,#P<0.05;与加入1.0 mmol/L丁酸盐的丁酸盐组比较,△P<0.05。
2.4 丁酸盐组与空白对照组细胞迁移能力比较 丁酸盐组与空白对照组进入下室的细胞数分别为(221±32)、(85±14)个,两组比较P<0.05。
3 讨论
胃内微生态是胃肠道微生态系统中的一个独特区域,幽门螺杆菌的存在可影响其微生物菌群组成,但组成成分的改变仍具有争议性。既往研究显示,幽门螺杆菌阴性个体中最丰富的菌群依次是链球菌、乳酸杆菌、韦荣菌、普氏菌[3],而幽门螺杆菌阳性个体中最丰富的菌群依次是幽门螺杆菌、变形杆菌、厚壁菌、放线菌[4]。幽门螺杆菌阳性可导致变形杆菌、螺旋菌及酸类杆菌丰度升高[5]。Andersson等[2]发现,在幽门螺杆菌阳性个体中,幽门螺杆菌占胃内微生物菌群的70%~95%。本研究结果显示,幽门螺杆菌组灌胃后12个月胃内微生物菌群按照丰度排序依次是幽门螺旋杆菌、柔嫩梭菌、拟球梭菌、乳酸菌、普氏菌,对照组依次是拟球梭菌、乳酸菌、肠杆菌、柔嫩梭菌,说明幽门螺杆菌感染会引起大鼠胃内微生物菌群改变。
细菌的代谢产物可作为肿瘤细胞能量代谢的原料,在肿瘤发生、发展中具有重要作用。短链脂肪酸包括乙酸、丙酸及丁酸等,由细菌发酵碳水化合物衍生而来。丁酸是膳食纤维经胃肠道细菌发酵产生的代谢产物,属于短链脂肪酸的一种,是体内丁酸盐的主要有效成分。能够产生丁酸的微生物统称为丁酸盐产生菌,主要由厚壁菌门、放线菌门、变形菌门、梭菌门、螺旋体门等微生物组成[7]。肠道内产丁酸盐的细菌主要分布在厚壁菌门梭菌科中的梭菌属,其中丰度最高的是柔嫩梭菌,其次是拟球梭菌[6]。研究发现,丁酸盐可通过调节Treg细胞、NF-κB通路而影响炎症反应,参与维持肠道上皮细胞完整性及内环境稳定性[8]。Belcheva等[9]研究发现,肠道微生态可以通过产生丁酸盐,刺激结肠上皮细胞增殖、分化,从而导致结肠癌的发生。Qin等[10]采用16 S rRNA高通量测序方法发现,当肠道丁酸盐产生菌增多以及菌群活动增强时,易诱发机体发生胰岛素抵抗,从而导致2型糖尿病的发生。目前,大部分研究是关于丁酸盐对结肠上皮细胞的影响,且结果具有争议性[11,8]。丁酸盐理论上可作为氧化能量和胃酸分泌过程中的氧化代谢来源[12],但是目前关于丁酸盐是否存在于胃黏膜上皮及其对胃癌发生的影响鲜见报道。本研究结果显示,幽门螺杆菌组灌胃6个月胃组织丁酸水平即开始升高,灌胃12个月胃组织乙酸、丙酸、丁酸水平均高于对照组,其中丁酸水平升高最明显;这与幽门螺杆菌组灌胃12个月丁酸盐产生菌(柔嫩梭菌、拟球梭菌)丰度升高的结果相符合,提示微生物菌群丰度改变势必导致微生物代谢产物的变化。
目前,关于丁酸盐对消化道肿瘤细胞增殖能力影响的研究多集中于结肠癌细胞,且其影响存在争议。Xu等[13]研究发现,丁酸盐可通过增强miR-200c表达而抑制结肠肿瘤细胞增殖能力。Singh等[14]研究发现,丁酸盐可激活Gpr109a,从而抑制结肠炎症及结肠癌进展。Donohoe等[15]研究发现,丁酸盐对结肠癌细胞增殖能力的影响取决于其浓度,在较低剂量(0.5、1.0 mmol/L)时丁酸盐能够促进结肠癌细胞增殖,而在高剂量(>1.0 mmol/L)时则呈现抑制作用。本研究结果显示,丁酸盐可促进胃癌细胞增殖和迁移,且在浓度为2.5 mmol/L时促增殖能力最强。
综上所述,幽门螺杆菌感染可以导致小鼠胃组织中丁酸水平及产丁酸盐的菌群丰度升高,而丁酸盐可促进胃癌细胞增殖、迁移,这可能是幽门螺杆菌导致胃癌发生的机制之一。但本研究样本量较小,尚需进一步扩大实验标本、增加胃内微生物菌群构建数量及种类,为研究幽门螺杆菌对胃内微生态及微生物代谢组学的影响提供依据。

