血清外泌体对高糖作用后HUVECs细胞增殖、迁移及管腔形成能力的影响
刘慧竹,黄群,闫美玉,吉懿,许小朋,刘奇良,王明亮,谢赟
同济大学附属普陀区人民医院,上海200060
既往研究显示,高糖会导致内皮细胞功能失常并促进其凋亡[1],而内皮功能障碍是血管相关疾病发生的关键因素。外泌体是广泛存在于细胞外间质及血液中的、具有脂质双层分子层膜结构的囊泡,能够通过运载蛋白质、脂质、miRNA、非编码RNA等信息物质,参与细胞间的相互作用,影响靶细胞的生物学活性[2]。此外,外泌体的内含物可以特异性反映其来源细胞的内含物,提示外泌体具有的巨大生物信息内涵[3]。研究显示,糖尿病患者多种组织、细胞来源的外泌体参与了动脉粥样硬化的发生发展过程[4~6],但是正常个体生理状态下血液循环中的外泌体对高糖作用下的内皮细胞是否具有保护作用鲜见报道。2018年3月~2019年11月,本研究分离提取正常大鼠血清外泌体,并观察其对高糖培养条件下人脐静脉内皮细胞(HUVECs)增殖、迁移及管腔形成能力的影响,为外泌体治疗糖尿病血管疾病提供一定的理论基础。现报告如下。
1 材料与方法
1.1 材料 实验动物:正常雄性SD大鼠10只,45~49日龄,体质量220~280 g,购于上海同济大学医学院实验动物中心。细胞:HUVECs购于南京科佰生物科技有限公司。主要试剂:胎牛血清、0.25%胰酶、DMEM培养基、青/链霉素双抗均购于美国Gibco公司,BCA蛋白浓度测定试剂盒、CCK-8试剂盒购于碧云天科技有限公司,兔单抗CD81、鼠单抗CD63均购于英国Abcam公司,HRP标记羊抗小鼠二抗、HRP标记羊抗兔二抗均购于武汉博士德生物工程有限公司,血清外泌体分离试剂盒购于美国Invitrogen公司,细胞培养级D-(+)-葡萄糖(下称葡萄糖)购于美国Sigma公司。主要仪器:倒置显微镜购于日本Olympus公司,酶标仪购于美国Thermo Fisher公司。
1.2 HUVECs复苏及培养 细胞复苏:将HUVECs从液氮中取出,快速放入37 ℃水浴锅中,轻摇冻存管使冻存液溶解;溶解后将细胞转移至含有5 mL培养基的离心管中,该培养基包含F12K、10%胎牛血清及1%青/链霉素双抗;室温条件下1 000 r/min离心5 min,弃上清,收集细胞后用含10%胎牛血清的完全培养基悬浮细胞;将细胞悬液接种到培养皿中,轻轻吹打混匀,37 ℃、5% CO2饱和湿度条件下培养。细胞传代:待细胞融合度达到80%时,以0.25%胰酶消化细胞,终止消化后收集细胞;PBS冲洗2次,1 500 r/min离心5 min;加入完全培养基,吹打细胞,制成单细胞悬液;按1∶3的比例进行传代,37 ℃、5% CO2饱和湿度条件下扩大培养。
1.3 大鼠血清外泌体分离及鉴定
1.3.1 大鼠血清外泌体分离 取45~49日龄SD大鼠10只,静脉麻醉后心脏采血,2 000 r/min离心30 min,取上清。以5∶1的比例加入工作液,充分混匀后静置30 min。10 000 r/min离心10 min,弃上清,加入PBS重悬。以上操作均在4 ℃条件下完成,并严格按照外泌体分离试剂盒说明书进行操作,分离的外泌体-20 ℃储存备用。
1.3.2 大鼠血清外泌体鉴定 ①电镜观察:取1.3.1提取的外泌体,采用透射电镜观察其形态特征。结果显示外泌体具有双层膜结构,大小为50~100 nm。②外泌体标志蛋白CD63、CD81表达检测:采用Western blotting法。采用BCA试剂盒检测样本蛋白质浓度,配制5%浓度浓缩胶、12%浓度分离胶,固定于电泳槽上。微量加样器将制备好的蛋白样品和Maker加入上样孔,各样品总蛋白量为40 μg。加样后先恒压80 V电泳至溴酚蓝指示剂在浓缩胶与分离胶交界处呈线状,再改为恒压120 V至溴酚蓝至凝胶底部,转膜后5%脱脂奶粉封闭2 h。加入CD63、CD81一抗(稀释比例分别为1∶1 000、1∶2 000),4 ℃孵育过夜;TBST洗涤后浸泡于HRP标记二抗稀释液中,37 ℃摇床孵育2 h。洗去多余二抗,经ECL试剂显色曝光。结果显示外泌体表达CD63、CD81,证实成功分离大鼠血清外泌体。
1.4 葡糖糖作用浓度筛选
1.4.1 细胞处理 取处于对数生长期、生长状态良好的HUVECs,用F12K培养基调整细胞密度为5×104/mL,以每孔100 μL细胞悬液接种于96孔板;同时设空白孔,在细胞孔周围孔内加入100 μL无菌PBS,37 ℃培养过夜。将细胞分为六部分,分别加入含7、10、20、30、40、50 mmol/L葡萄糖的DMEM完全培养基。
1.4.2 浓度筛选 采用CCK-8法。HUVECs经不同浓度葡萄糖作用6、12、24、36、72 h,分别向每孔加入CCK-8溶液10 μL,采用酶标仪检测各孔450 nm处的光密度(OD)值。结果显示,随着作用时间的延长,加入7、10、20 mmol/L葡萄糖的细胞OD值呈升高趋势,加入30 mmol/L葡萄糖的细胞OD值先升高后降低;加入40、50 mmol/L葡萄糖的细胞OD值呈逐渐降低趋势,且二者相同作用时间下的OD值无明显差异;相同作用时间下加入40、50 mmol/L葡萄糖的细胞OD值最低;见图1。选择40 mmol/L葡萄糖进行后续实验。
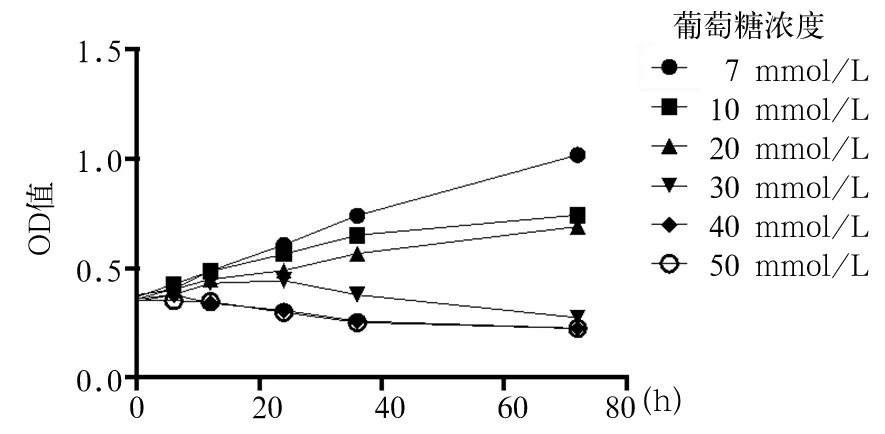
图1 HUVECs经不同浓度葡萄糖作用后的OD值(CCK-8法)
1.5 外泌体对高糖作用后HUVECs细胞增殖、迁移、管腔形成能力的影响观察
1.5.1 细胞增殖能力观察 将处于对数生长期、生长状态良好的HUVECs分为外泌体组、高糖组和对照组,外泌体组、高糖组加入40 mmol/L葡萄糖,对照组加入7 mmol/L葡萄糖;同时外泌体组分别加入10、40、160 μg/mL大鼠血清外泌体,高糖组和对照组不加入外泌体。各组分别于培养0、12、24、36 h,参照1.4.2,采用CCK-8法检测OD值。
1.5.2 细胞迁移能力观察 采用细胞划痕实验。在6孔板背面用记号笔通过孔的直径划一标记线,将HUVECs以2×105/孔接种于6孔板,参照1.5.1进行分组处理,培养24 h。待细胞长成单层后用灭菌枪头在6孔板底部垂直于标记线作一划痕,PBS冲洗3次。各组作用0、24 h后显微镜下拍照,采用Image J软件测量划痕宽度。细胞迁移率(%)=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%。
1.5.3 管腔形成能力观察 采用管腔形成实验。将基质胶按50 μL均匀铺在96孔板的底部,置于37 ℃、95%相对湿度、5 %CO2培养箱中2 h,使基质胶凝固。将HUVECs以5×105/孔接种于96孔板,参照1.5.1进行分组处理,每组设3个复孔。各组培养8 h,倒置显微镜下观察管腔形成情况,采用Image J软件测量成管长度和成管分支点数。
2 结果
2.1 三组不同时间点细胞增殖能力比较 见表1。

表1 三组不同时间点细胞增殖能力比较
注:与对照组比较,aP<0.05;与高糖组比较,bP<0.05;与加入160 μg/mL外泌体的外泌体组比较,cP<0.05;与加入40 μg/mL外泌体的外泌体组比较,dP<0.05。
2.2 三组细胞迁移率、成管长度和成管分支点数比较 见表2。

表2 三组细胞迁移率、成管长度、成管分支点数比较
注:与对照组比较,aP<0.05;与高糖组比较,bP<0.05;与加入160 μg/mL外泌体的外泌体组比较,cP<0.05;与加入40 μg/mL外泌体的外泌体组比较,dP<0.05。
3 讨论
血管壁作为一个整体,由内皮细胞、平滑肌细胞、成纤维细胞和细胞外基质组成。血管重构涉及细胞增殖、凋亡、迁移和细胞外基质的产生及分解过程,其中内皮细胞的增殖、凋亡和迁移在血管重构过程中具有重要作用[7]。外泌体具有沟通各个器官、组织的信使作用,使个体成为一个整体。外泌体存在于各种体液中,在不同的病理生理状态下其数量和内含物均存在动态改变,对疾病预后具有潜在预测价值[8~11],许多药物也是通过改变外泌体的质和量而发挥治疗作用[12,13]。此外,外泌体具有生物相容性、生物屏障可通过性、低毒性、低免疫原性以及高稳定性,是治疗疾病的理想载体[14~16]。糖尿病患者多合并多种血管病变,外泌体在调控患者内皮细胞功能中的作用逐渐得到证实,但外泌体信号转导影响靶器官的具体作用机制尚未完全明确。研究表明,多种细胞来源的外泌体均可通过血液循环作用于远处的组织器官,参与2型糖尿病血管病变的病理过程[17~19]。
既往研究多着重于疾病状态下循环外泌体数量及其所携带的特异生物信息参与疾病进展的过程,目前关于健康个体外泌体对于糖尿病内皮细胞保护作用的研究并不多。本实验为探索该领域的初步实验,考虑鼠与人的基因高度相似,且鼠具有可及性高、成本低、均质性强、可控性强等特点,同时以大鼠血清外泌体作为研究对象有利于进展下一步大鼠模型的在体实验,故首先采用健康大鼠血清外泌体进行研究。本研究HUVECs经不同浓度葡萄糖作用后结果显示,相同作用时间下加入40、50 mmol/L葡萄糖的细胞OD值最低,且二者OD值无明显差异,因此选择40 mmol/L葡萄糖进行后续实验。本研究结果显示,与对照组比较,高糖组作用12、24、36 h的OD值及细胞迁移率、成管长度、成管分支点数均降低,说明高糖会导致HUVECs细胞增殖、迁移及管腔形成能力下降;与高糖组比较,加入10 μg/mL外泌体的外泌体组作用12、24、36 h的OD值及细胞迁移率、成管长度、成管分支点数均无明显变化,加入40、160 μg/mL外泌体的外泌体组作用24、36 h的OD值及细胞迁移率、成管长度、成管分支点数均升高,且加入160 μg/mL外泌体的外泌体组升高更明显;这说明高浓度血清外泌体可逆转高糖对HUVECs的损伤,对HUVECs具有保护作用。目前关于健康个体外泌体对糖尿病内皮细胞保护作用的机制尚不明确,考虑可能与正常生理状态下外泌体所携带的miRNA等生物信使可激活相关促进正常代谢的信号转导通路有关。
综上所述,高糖会导致HUVECs细胞增殖、迁移及管腔形成能力下降,而高浓度的正常大鼠血清外泌体可逆转上述损伤,对HUVECs具有保护作用。但是本研究中外泌体来源于正常大鼠外周血,为循环系统中存在的外泌体,可能为多种细胞分泌而来,具体来源混杂,不利于进一步指导临床靶向应用及提取。另外,外泌体对内皮细胞保护作用的相关机制尚不明确,未来需进行大鼠的在体实验,并考虑提取人的正常血清外泌体进一步探索表型变化及其相关机制。
——外泌体与老年慢性疾病相关性的研究进展

