连续施用不同氮量对半干旱地区马铃薯根际真菌群落结构的影响
邓德雷,罗超越,邱慧珍,张 健,张春红,付 笑,沈其荣
(1.甘肃农业大学资源与环境学院/甘肃省干旱生境作物学重点实验室,甘肃 兰州 730070;2.甘肃省畜禽废弃物资源化利用工程研究中心,甘肃 兰州 730070;3.南京农业大学资源与环境学院,江苏 南京 210095)
根际是土壤和根之间的界面,是土壤的生物活性区域[1]。农业系统中根际微生物群落的多样性受植物类型、土壤类型、农田管理和其它环境因素的影响[2]。农田管理如长期连作和施肥等栽培措施,特别是过量施氮肥已成为限制甘肃省马铃薯主产区定西市马铃薯产业可持续发展的主要限制因素[3]。在马铃薯种植过程中为了片面追求高产,过量施氮和长期连作现象十分普遍[4-5]。过量施氮和长期连作都会导致土壤微生物区系从“细菌型”向“真菌型”转化,最终引发土壤微生物群落结构与组成失衡,导致土壤微生物区系失衡[3,6]。定西市集约化种植马铃薯过程中的施氮用量平均为230 kg·hm-2,而马铃薯生产中每形成1 t块茎产量,仅需纯氮6.5±1.77 kg[3]。土壤中氮残留量或损失量显著增加,长期连续施用氮肥,将会导致农田土壤中的微生物群落结构遭受破坏[7-8],群落组成发生改变[9]。
对于马铃薯来讲,过量施氮和连作均能够引起土壤微生物群落结构的显著变化,使得土壤从抑病型向导病型的方向转变,土传病害滋生,作物长势变差并且大幅度降低农作物的经济产量,而这其中大部分是真菌型的土传病害[3,10]。因此,了解土壤真菌群落结构对于农业可持续发展具有十分重要的理论和实践意义。许多研究证明,土壤类型是影响细菌的最主要因素[10-11],而农田管理是影响真菌的最主要因素[12-13]。
目前,有关不同施氮量对微生物群落的影响多侧重于细菌,而对真菌群落结构的影响研究较少。过量施氮和长期连作都是不健康的农田管理,这将会导致植株生长发育受阻,块茎产量和品质下降,特别是土传病害猖獗等一系列的问题,严重影响企业和农民的种植效益。本课题组前期对马铃薯连作与土壤的真菌群落结构之间的相互作用做了大量研究,孟品品等[5]研究了马铃薯连作对根际土壤真菌种群结构的影响及其生物效应,结果表明,随着连作年限的增加,马铃薯根际土壤土传病害病原菌尖孢镰刀菌和茄病镰刀菌的数量明显增加。牛秀群等[14]研究了马铃薯连作根际土壤镰刀菌分布与马铃薯连作之间的关系,结果显示连作1~3 a的优势种均为茄病镰孢。李瑞琴等[15]通过荧光定量PCR快速检测及在根际的动态变化的研究,结果显示连作1~5 a的马铃薯根际土壤茄病镰孢菌和接骨木镰孢菌随连作年限的递增呈现上升趋势,其中连作5 a的累积量达到最大。
作物增产的农业措施之一是施用氮肥,而目前在我国粮食生产中存在氮肥用量不足和过量的问题,这两方面都将会严重阻碍农业的可持续发展进程[3]。因此,了解氮肥施用量对土壤微生物群落结构的影响,对于农业可持续发展具有十分重要的理论和实践意义。针对当地因长期过量施氮而导致的诸如立枯病、干腐病和黄萎病等真菌类土传病害严重的现象,将真菌群落结构作为我们研究的重点。因此,本研究利用Illumina PE250基因测序,比较连续不同施氮条件下的马铃薯根际真菌群落结构差异,旨在探明和揭示过量氮素施用对半干旱地区马铃薯根际真菌群落结构的影响,为该地区马铃薯生产的可持续发展提供科学依据。
1 材料与方法
1.1 试验区概况
田间定位试验始于2013年4月,试验地位于甘肃省定西市安定区香泉镇,当地地理位置35°27′7″N,104°30′34″E,海拔2 053~2 556 m。试验地所在区域年均温度6.9℃,≥10℃的积温为2 075.1℃,年降雨量400 mm左右,多集中在7—9月,无霜期140 d,蒸发量1 400 mm以上,属中温带半干旱气候,土壤类型为黄绵土。
1.2 试验设计
本研究共设置6个不同的氮用量:N0(对照,不施氮肥)、N75(施氮量为75 kg·hm-2)、N150(150 kg·hm-2)、N225(225 kg·hm-2)、N300(300 kg·hm-2)、N375(375 kg·hm-2)。本研究是以当地常规施氮量225 kg·hm-2为依据,不施氮肥为对照处理,每一处理4次重复,随机区组排列,小区面积为9 m×7.2 m =64.8 m2。每个处理配施等量的磷钾肥,施磷量为P2O5225 kg·hm-2,施钾量为K2O 292.5 kg·hm-2。N肥为尿素(N,46%),配施磷肥为过磷酸钙(P2O5, 16%),钾肥为硫酸钾镁(K2O, 24%)。肥料按小区称重撒施后旋耕,旋耕后起垄。垄宽60 cm,垄距60 cm,垄高20 cm,起垄后覆膜。人工点播的方法播种,宽垄双行,深10 cm,株距25 cm,种植密度为4 450株·667m-2。马铃薯品种是“青薯九号”原种。于2017年5月12日播种,10月20日收获。
1.3 土壤样品采集与处理
根际样品在马铃薯成熟期进行采集,采集时间为2017年10月18日。根际土的采集方法:将马铃薯的根完整挖出,先用抖土法抖落掉多余的土后(将附着在根表面不能被抖下来的土视为根际土),装于灭菌后的自封袋内,并于当天带回实验室用灭菌蒸馏水冲洗(三角瓶内加40~50 ml蒸馏水,在摇床上以200 r·min-1的转速震荡5~10 min),过滤后用真空泵抽取多余的水分,随后在真空冷冻干燥机上冻干,并装于5 ml的无菌管中,放置于-80℃冰箱,用于土壤微生物DNA的提取。
1.4 测定指标及方法
土壤理化性质的测定参照《土壤农化分析》[16]的方法进行测定。速效磷的测定采用钼锑抗比色法;有机质的测定采用重铬酸钾氧化外加热法测定;土壤硝态氮和铵态氮的测定:以0.01 mol·L-1的CaCl2溶液浸提,震荡1 h,后用连续流动分析仪测定;土壤pH值测定采用电极法测定。
1.5 土壤DNA提取及PCR扩增
DNA提取:采用E.Z.N.A. Soil DNAKit(OMEGA)试剂盒进行土壤总DNA的提取,每个样品进行3次平行PCR扩增。在测序前参照电泳初步定量结果,将PCR产物用QuantiFluorTM-ST蓝色荧光定量系统(Promega公司)进行检测定量,之后按照每个样本的测序量要求,进行相应比例的混合。用Qubit2.0 DNA检测试剂盒对基因组进行DNA精确定量,以确定PCR反应应加入的DNA量。PCR所用引物序列为ITS1-F:5′-CTTGGTCATTTAGAGGAAGTAA-3′和ITS2:5′-GCTGCGTTCTTCATCGATGC-3′ ,PCR所用引物为Miseq测序平台的通用引物。热启动PCR反应体系如下: 5 × FastPfu Buffer 4 μl,2.5 mM dNTPs 2 μl,Forward Primer(5 μM) 0.8 μl,FastPfu Polymerase 0.4 μl,Template DNA 10 ng,加去离子水至20 μl。反应条件如下:95℃ 5 min预变性,95℃ 30 s,55℃ 30 s,72℃ 10 min进行30个循环,最后72°延伸7 min。PCR结束后,全部样本按照正式实验条件进行,每个样本3个重复,将同一样本的PCR产物混合后用2%琼脂糖凝胶电泳检测,使用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物,Tris-HCl洗脱;2%琼脂糖凝胶电泳检测。
PCR 采用TransGen AP221-02:TransStart Fastpfu DNA Polymerase。PCR仪:ABI GeneAmp© 9700型
1.6 数据处理
土壤的基本理化性质数据处理及图表绘制采用Excel 2013和Origin 2017软件,SPSS 23.0软件进行数据的统计分析。同时运用R 3.3.1等相关软件计算土壤真菌群落Alpha多样性指数如Chao 1指数、Shannon指数、Simpson指数等,同时进行根际真菌群落的Beta多样性分析。
2 结果与分析
2.1 连续施用不同氮量对马铃薯根际真菌群落结构的影响
Illumina PE250测序结果优化后共获得297623条有效序列,通过OTU(Operational taxonomic units)聚类分析得到3459个OTU;同时检测出根际真菌主要分布在7个门,22个纲,64个目,158个科,333个属,676个种中。在97%相似水平条件下得到土壤真菌多样性指数如表1所示。由表1可知各处理样本文库覆盖率均大于99.7%,说明本试验样品取样合理,置信度高、结果可靠,测定结果能够真实地反映各处理根际样本的真菌群落组成。通过对根际样品中真菌群落的相对丰度指数(Chao 1)分析发现,N150处理Chao 1指数为758.25,显著高于其它施氮处理,过量施氮降低真菌丰富度,N150处理相比N0、N75、N225、N300和N375高36.56%、19.83%、16.79%、1.34%、16.25%。同时通过对根际样品中真菌群落的多样性(Shannon和Simpson)进行分析,分析结果表明,不同施氮量对土壤真菌群落的多样性影响无显著差异。
为进一步分析不同施氮量对根际真菌群落结构的影响,首先从门水平对真菌群落进行分析。根际样品共检测出3个优势门类真菌(相对丰度>1.0%),主要由子囊菌门(Ascomycota)、Mucoromycota和担子菌门(Basidiomycota)组成,如图1所示。
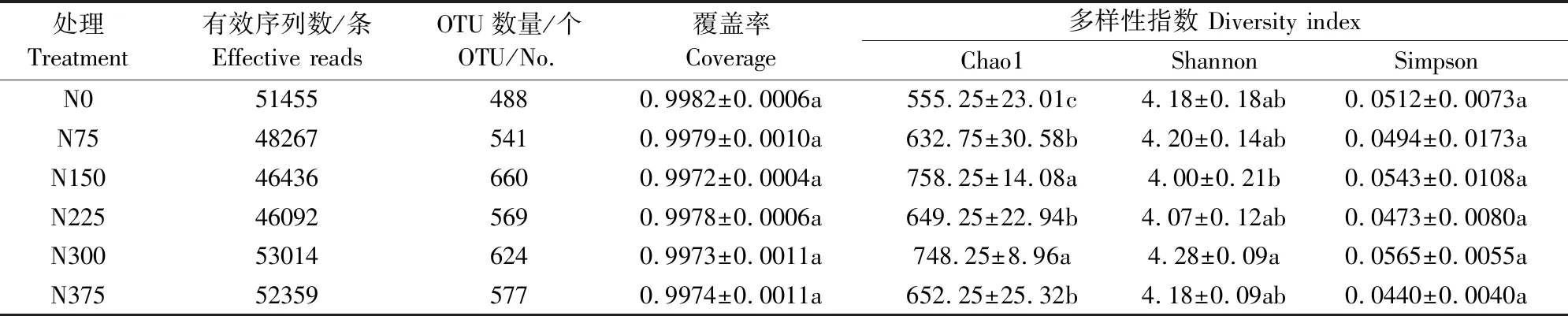
表1 连续施用不同氮量对根际真菌群落相对丰度与多样性的影响
注:不同字母表示处理间差异显著(P<0.05),下同
Note: Different letters indicate significant difference among treatments (P<0.05). The same below.
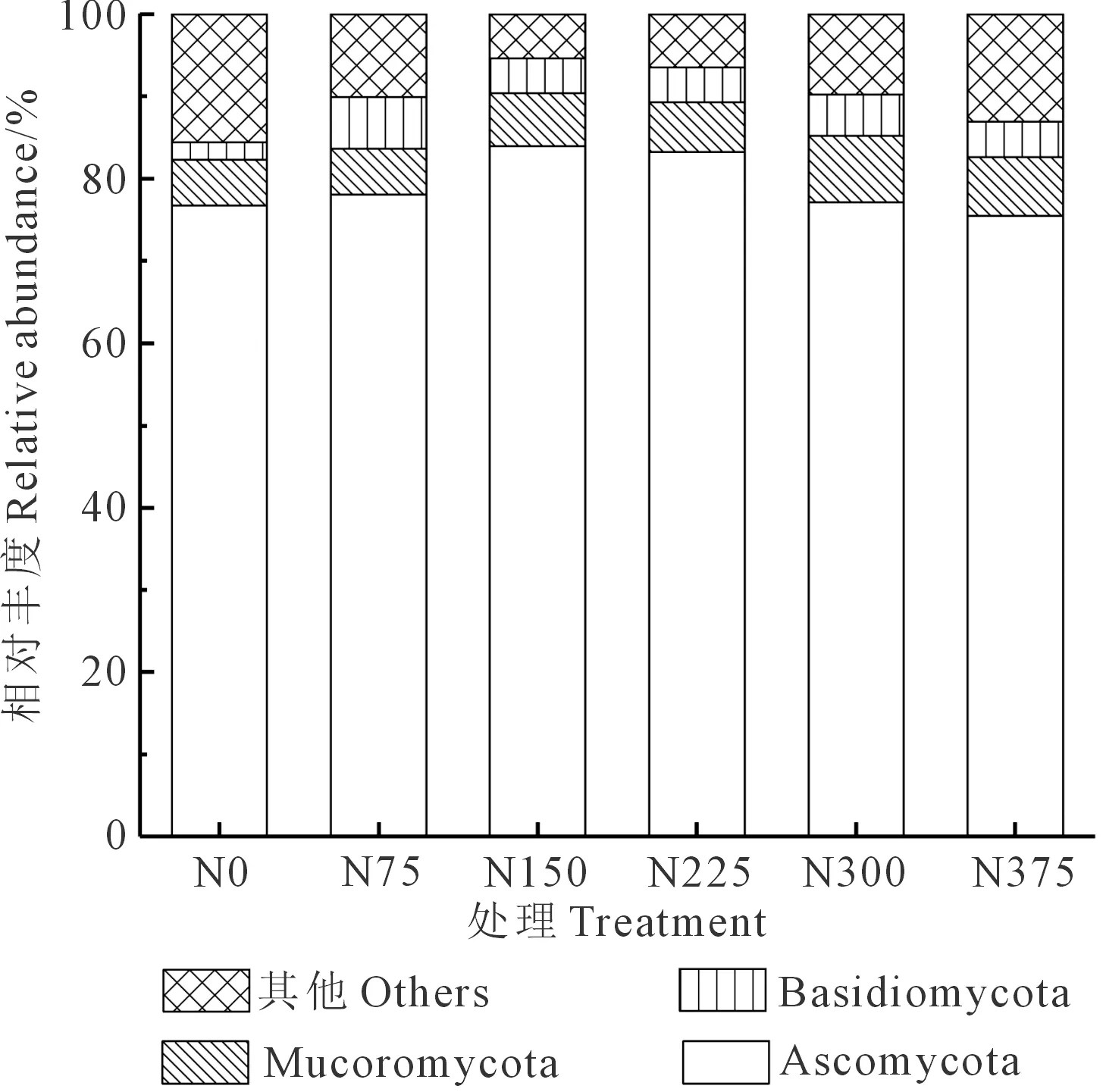
图1 连续施用不同氮量根际土壤真菌优势门群落组成Fig.1 Continuous application of different N content in rhizosphere soil fungi phylum community composition
分析结果显示,不同施氮量对根际真菌群落物种组成造成了显著影响。其中子囊菌门的相对丰度最大,占总序列的75.48%~83.95%;N150和N225处理的子囊菌门相对丰度分别为83.95%和83.24%,显著高于其它处理。同时,子囊菌门相对丰度的变化趋势可以分为低氮量(N0和N75处理)、中氮量(N150和N225处理)和高氮量(N300和N375处理),中氮量子囊菌门相对丰度分别比低氮和高氮多8.04%和9.54%。这说明适量的氮肥用量可以增加子囊菌门的相对丰度,但过量施氮反而会使其受到抑制。各处理的担子菌门相对丰度分别为2.10%、6.31%、4.19%、4.23%、5.03%和4.31%,N75处理的担子菌相对丰度显著高于其它处理,施氮量超过75 kg·hm-2时担子菌的相对丰度呈下降趋势。各处理Mucoromycota相对丰度分别为5.62%、5.62%、6.45%、6.09%、8.09%和7.15%,随施氮量的增加呈现递增的趋势。虽然随施氮量的增加促进了马铃薯根际子囊菌门和担子菌门的丰度,但过量施氮会抑制子囊菌和担子菌的生长。
如图2所示,土壤中真菌纲水平的优势物纲(相对丰度>1.0%)主要有粪壳菌纲(Sordariomycetes)、座囊菌纲(Dothideomycetes)、银耳菌纲(Tremellomycetes)、锤舌菌纲(Leotiomycetes)、散囊菌纲(Eurotiomycetes)、Accomycota-norank和Mucoromycota-norank共7个优势纲。研究结果显示粪壳菌纲是子囊菌门的第一大优势类群,其相对丰度为47.36%~64.12%,在真菌纲中处于最优势菌纲,随施氮量的增加呈现先增加后降低的趋势,N150处理相对丰度达到最大。座囊菌纲的变化趋势与粪壳菌纲一致,相对丰度为7.16%~11.36%,N150处理相对丰度达到最大。银耳菌纲相对丰度可以占到所有真菌纲的3.18%~10.63%,N300处理相对丰度均达到最大,结果显示施氮可以增加银耳菌纲的相对丰度,过量施氮则会受到抑制。锤舌菌纲的相对丰度为0.89%~2.37%,N0处理高于其它处理,与N0相比各施氮处理分别降低了47.79%、62.56%、29.72%、51.46%和61.81%,说明随着施氮量的增加锤舌菌纲相对丰度呈下降趋势。
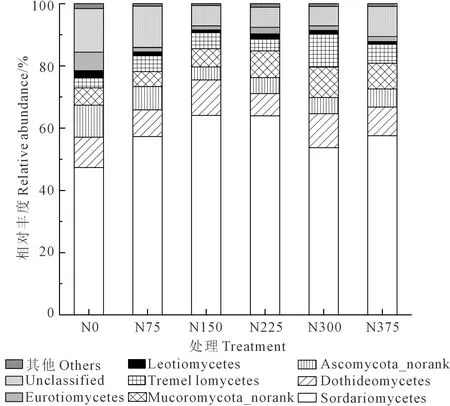
图2 不同施氮量处理纲水平下土壤真菌优势群落组成Fig.2 Composition of class community of soil fungi under different levels of N application
进一步从根际真菌属的角度分析不同施氮量对真菌群落结构的影响,结果如表2所示。供试土壤样品共检测出13个优势属(相对丰度>1.0%)。其中Plectosphaerella、镰刀菌属(Fusarium)、梭孢壳属(Thielavia)、短梗蠕孢属(Trichocladium)、枝孢属(Cladosporium)、Paramyrothecium、四枝孢菌属(Tetracladium)、链格孢属(Alternaria)、毛壳菌属(Chaetomium)、Lectera、枝顶孢属(Acremonium)属于子囊菌门;被孢霉属(Mortierella)属于Mucoromycota门;Vishniacozyma属于担子菌门。
由表2可知,过量施氮显著增加Fusarium(镰刀菌属)的相对丰度,且N375处理达到最大,其相对丰度为13.54%,显著高于N75处理的相对丰度(8.38%),N0处理的相对丰度为9.63%。且N375和N0处理的镰刀菌属丰度相比N75处理多 61.58%及14.91%,结果表明低氮量和高氮量增加了镰刀菌属的丰度。Alternaria(链格孢属)各处理的相对丰度分别为1.89%、1.39%、1.17%、0.70%、1.07%和1.80%,N225处理的丰度最低,N0和N375处理的链格孢属相对丰度别是N225处理的2.70、2.57倍。据报道,镰刀菌属和链格孢属是引起植物破怀性病害的主要病原真菌[17-18],以上结果说明过低或过高的施用氮肥会加剧镰刀属和链格孢属的相对丰度,病原菌的增加对马铃薯生产不利,影响马铃薯的产量,造成经济收益下降。随施氮量的增加能产生脂肪酸等有机化合物的被孢霉属(Mortierella)也明显增加,其相对丰度分别为5.59%、4.81%、5.79%、8.55%、9.71%和8.24%,且N75、N150、N225、N300以及N375处理比N0处理增加了-13.95%、3.58%、52.95%、73.70%及47.41%。由于被孢霉属可以产生有机酸,结果可能导致根际土壤酸化。
2.2 连续施用不同氮量对土壤理化性质的影响
连续施用不同氮量对马铃薯土壤理化性质产生了显著影响,在大量的试验数据中,我们选取了硝态氮、铵态氮、pH值、有效磷和有机质以展开进一步的分析,详细结果如表3所示。分析结果显示,随着施氮量的增加土壤中NO-3-N含量呈现增加的趋势,在N375处理NO-3-N含量达到最大,为21.90 mg·kg-1,并且显著高于其它处理,N75、N150、N225、N300和N375处理分别是N0处理的1.24、1.70、1.94、2.98倍和3.76倍。随着施氮量的增加土壤中NH+4-N含量与NO-3-N含量变化趋势一致。结果说明连续施用氮肥显著提高了土壤中的矿质氮含量。由表3可知,随着施氮量的增加土壤pH值呈现下降的趋势,各施氮处理分别比N0降低了0.06、0.07、0.08、0.15和0.17个单位。土壤pH值结果说明,长期大量的连续使用氮肥,已导致土壤pH值下降。因此,在农田管理过程中不宜大量的施用氮肥。
由表3数据可以看出,施氮量对表层速效磷含量的变化有显著影响。随施氮量增加速效磷含量呈现降低的趋势,N0处理速效磷含量显著高于其他处理,与N0相比其它施氮处理分别降低了7.34%、18.31%、26.19%、29.68%和32.10%。可能的原因是随着施氮量的增加提高了马铃薯的生长发育以及其对磷素的需求,从土壤中吸收磷素也就更多,显著降低了速效磷含量。连续5 a施用不同氮量的研究发现,与N0相比,本研究中随着施氮量的增加土壤的有机质的含量稍有提高,然而不同的施氮处理对土壤有机质的影响差异不显著。
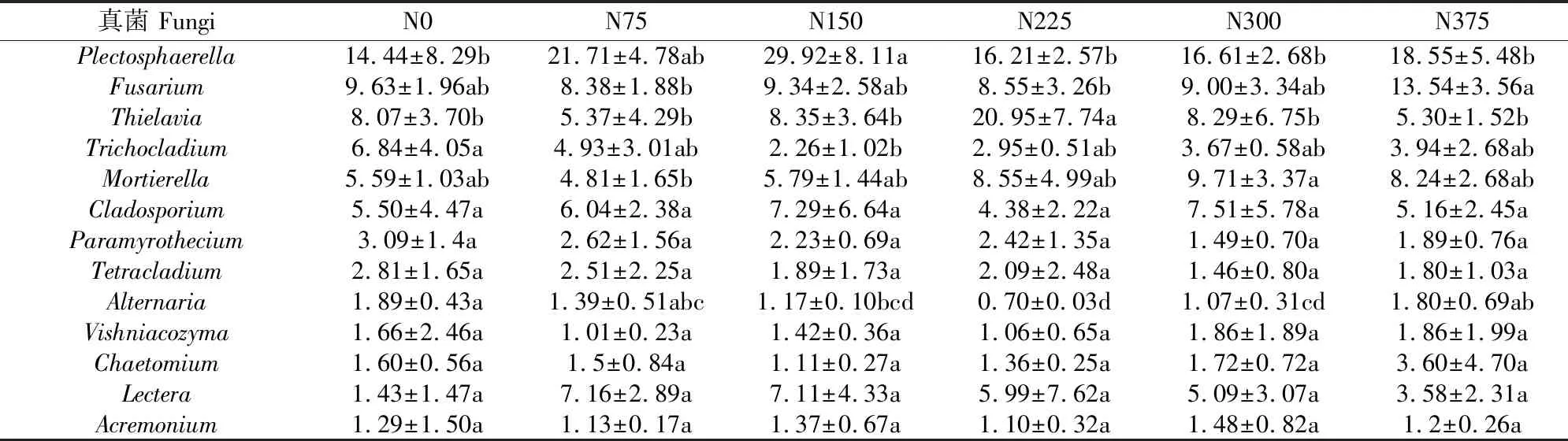
表2 连续施用不同氮量处理属水平下根际真菌优势群落组成及相对丰度
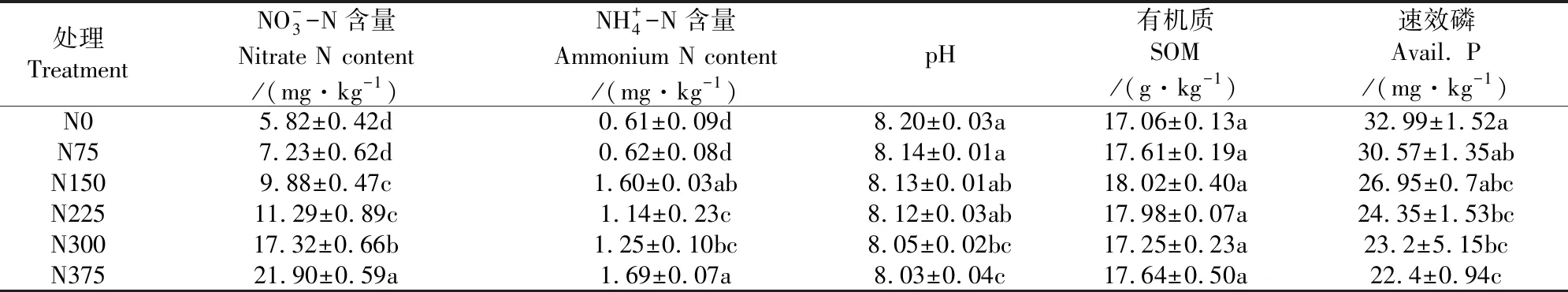
表3 连续施用不同氮量对土壤理化性质的影响
2.3 真菌群落与土壤理化性质的冗余分析(RDA)
为进一步了解环境因素对根际真菌群落结构的影响,将真菌群落的变化与环境因子如有机质(SOM)、pH值、速效磷(AP)、硝态氮(NO-3-N)和铵态氮(NH+4-N)之间进行了冗余分析(RDA),结果如图3所示。真菌群落结构差异在两个排序轴上的解释率分别为8.10%、5.22%,NO-3-N和NH+4-N呈正相关,而pH值和AP呈负相关关系,同时从图中可以看出,NO-3-N指向了N150、N225、N300和N375四个处理的真菌群落。判断排序的结果可以接受环境因子对物种分布的解释量的结果显示,NO-3-N是影响根际真菌群落变化的主要因子(F=1.571,P=0.043*)。
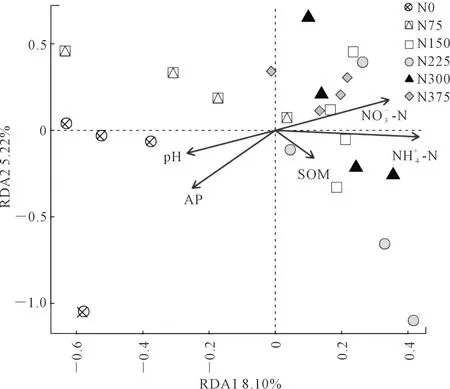
注:SOM,AP,NO-3-N,NH+4-N分别代表土壤有机质,速效磷,硝态氮含量,铵态氮含量;P值通过999次置换检验得出,显著性标记为*P<0.05;**P<0.01;***P<0.001.Note:SOM, AP, NO3-N, and NH+4-N represent soil organic matter, available phosphorus, nitrate N content, ammonium N content; P value was obtained by 999 replacement tests. * P < 0.05 ; ** P < 0.01; *** P < 0.001.图3 土壤真菌与环境因子之间的RDA分析Fig.3 RDA analysis between soil fungi and environmental factors
2.4 真菌群落结构的变化与土壤理化性质的相关性分析
为进一步确定影响真菌的优势菌群的环境因子,将部分土壤理化性质与根际真菌群落结构的分布进行Spearman相关性分析,结果见表4、表5和表6。分析结果显示真菌群落结构在门水平、纲水平和属水平上与NO-3-N含量具有显著相关性,与AP呈显著正相关的真菌优势菌群为链格孢属(Alternaria),与pH和AP呈显著负相关同时与NO-3-N含量呈显著正相关的真菌优势菌群有Mucoromycota_norank和被孢霉属(Mortierella)。而粪壳菌纲(Sordariomycetes)和镰刀菌属(Fusarium)仅与AP含量显著负相关。
2.5 连续施用不同氮量处理对马铃薯产量的影响
氮素是马铃薯产量形成的关键限制因子,通过实际测产,马铃薯块茎产量结果如图4所示。分析结果显示,N75处理马铃薯产量最高,为26 410 kg·hm-2,与N75相比,N0、N150、N225、N300、N375的块茎产量分别降低了7.58%、3.46%、22.81%、26.05%和25.32%。结果说明,随施氮量的增加马铃薯块茎产量并不会随之升高,过量的施用氮肥反而会导致马铃薯产量下降,造成严重的氮肥资源浪费。
通过对马铃薯产量与土壤的NO-3-N、NH+4-N、pH、有机质和速效磷的相关性分析,结果如表7所示。结果显示,马铃薯产量与NO-3-N呈极显著负相关关系(P<0.01,r=-0.578),与NH+4-N含量呈显著负相关关系(P<0.05,r=-0.437),与土壤pH值呈极显著正相关关系(P<0.01,r=0.556),与有机质和速效磷则没有显著的相关性。这说明NO-3-N和NH+4-N含量的增加以及pH值下降导致了马铃薯产量降低。
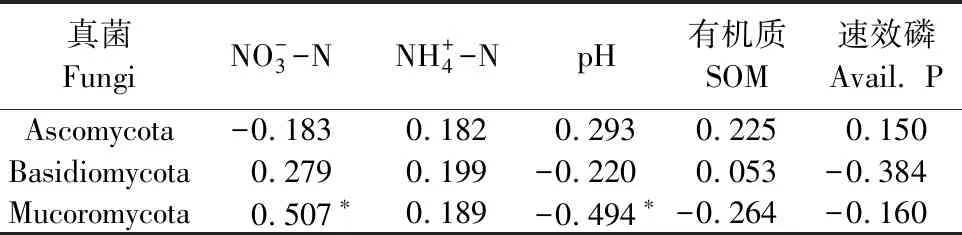
表4 真菌优势菌群与土壤理化性质之间的相关性分析(门水平)
注 Note: *P<0.05;**P<0.01.下同 The same below.
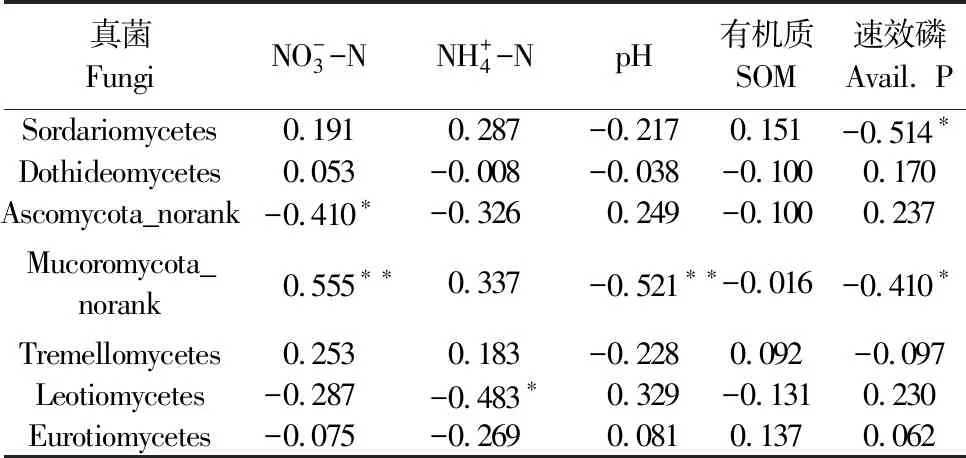
表5 真菌优势菌群与土壤理化性质之间的相关性分析(纲水平)
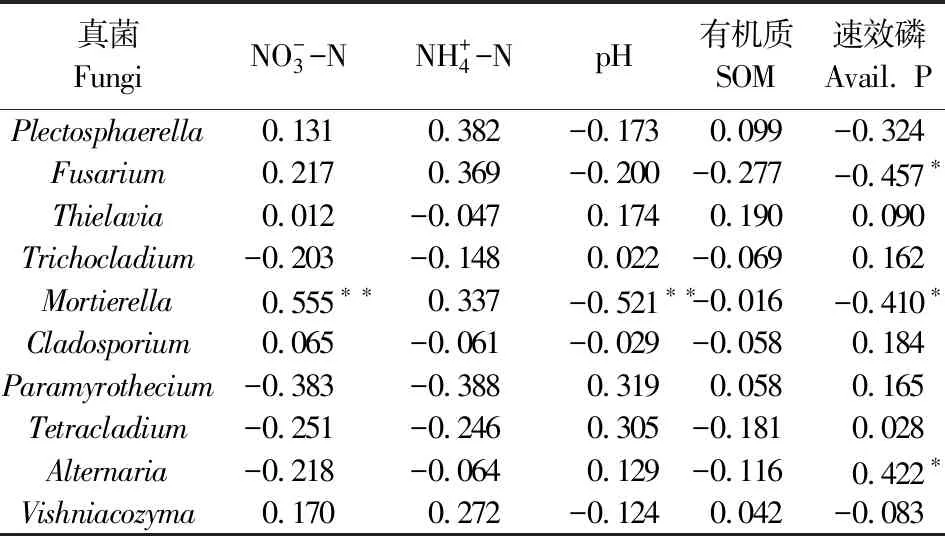
表6 真菌优势菌群与土壤理化性质之间的相关性分析(属水平)
3 讨 论
3.1 连续施用不同氮量对土壤理化性质和马铃薯产量的影响
本研究结果显示,随着施氮量的增加显著降低了土壤pH值,这主要是因为尿素施入土壤后,在脲酶作用下先将酰胺态氮水解生成NH+4,然后在硝化作用下将NH+4转化成NO-3,而硝化过程中会产生大量的H+,使土壤pH值下降[19]。有研究表明,随着施氮量的增加,浅层土壤的硝态氮含量显著增加,当施氮量高于207 kg·hm-2时,随着施氮量增加土壤NO-3-N的积累量显著增加[20],这与本研究结果基本一致,其原因是在硝化作用下氨态氮向硝态氮转化,使土壤中硝态氮含量大量富集。Wang Qi等[21]的研究表明,在有限的灌溉条件下,当施氮量为221 kg·hm-2时表层土壤NO-3-N积累量增加,当施氮量增加至300 kg·hm-2时,0~200 cm土层中土壤NO-3-N积累量显著增加。
我国在有限的土壤上投入大量的化肥,与迅速增长的化肥施用量相比,作物产量并没有达到预期的结果[22]。本研究中,N0处理的马铃薯产量为24 408 kg·hm-2,然而,当施氮量为75 kg·hm-2时,产量为26 410 kg·hm-2,仅提高了8.20%。与N75相比,N150、N225、N300和N375产量分别降低了3.46%、22.81%、26.05%和25.32%,随着施氮量的增加,马铃薯的产量并没有持续增加。对于马铃薯来讲,过量施氮和连作均能够引起土壤微生物群落结构的显著变化,使得土壤从抑病型向导病型的方向转变,土传病害滋生,作物长势变差并且大幅度降低农作物的经济产量[23]。因此,本研究结果表明,连续大量施氮不利于马铃薯高产。
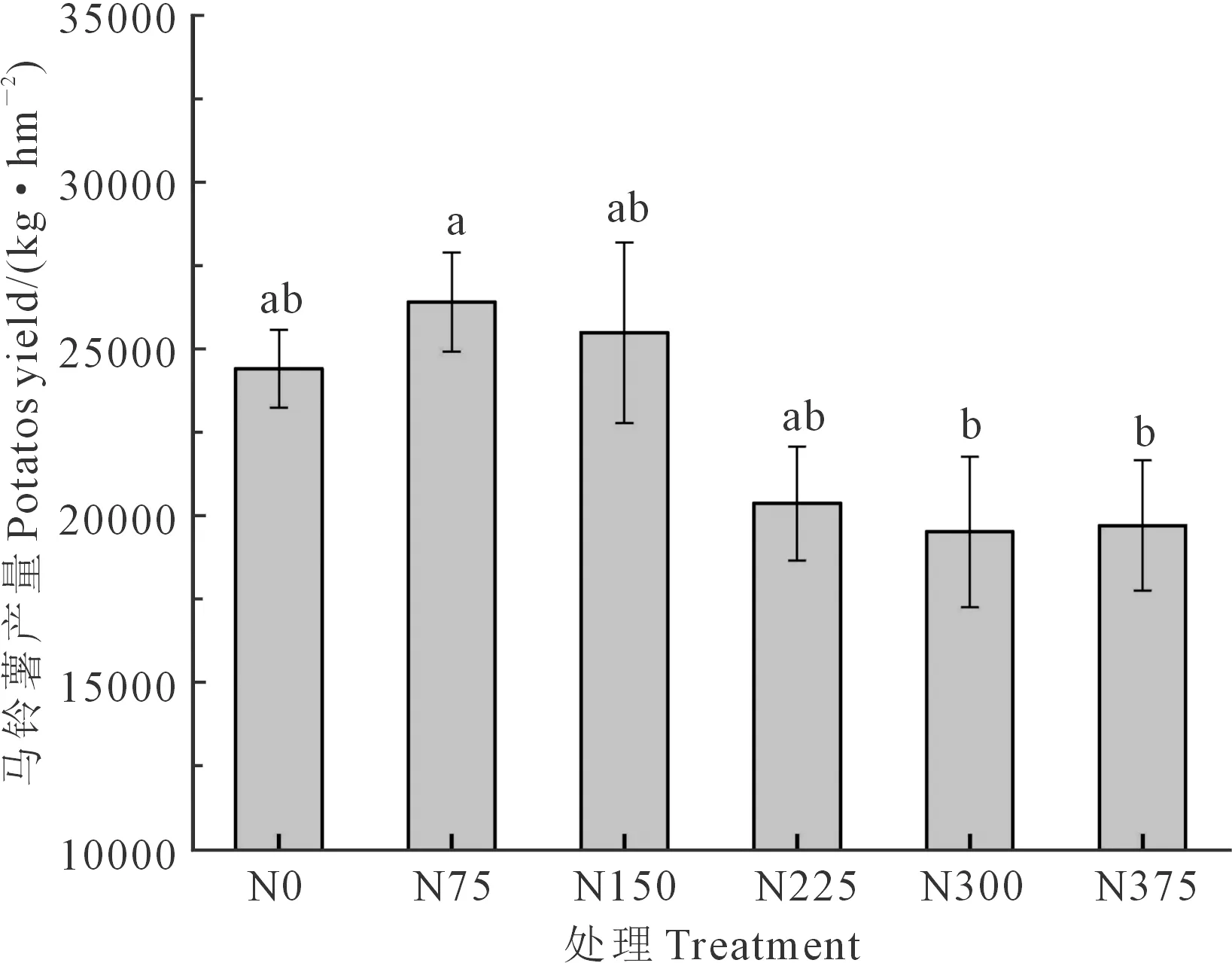
图4 连续施用不同氮量对马铃薯块茎产量的影响Fig.4 Effects of continuous application of different nitrogen rates on potato tuber yield
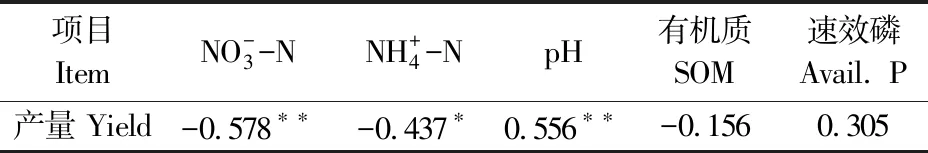
表7 Spearman相关性分析
3.2 连续施用不同氮量对马铃薯根际真菌Alpha多样性和群落结构的影响
本研究结果显示,过量施氮会降低马铃薯根际真菌群落多样性,这与Biotechnology[24]和Vandenkoornhuyse[25]等的研究结果基本一致。但也有研究[26]发现,长期施用氮肥会增加真菌群落的多样性,究其原因可能是因为在土壤营养物质增加时,丰富类群能利用有效碳源快速生长,因此可以在较高氮含量的环境下较好地生长繁殖,而贫瘠类群在环境中生长速度较低,吸收营养物质的能力较弱,因此在营养物质较高时,这些贫瘠类群与丰富类群相比竞争力较弱,不能良好生长繁殖[27],导致其数量下降。
马铃薯根际真菌群落结构主要由子囊菌门、Mucoromycota和担子菌门构成,这与季凌飞等[28]、陈丹梅等[29]、Hedlund K等[30]在茶园土壤、植烟土壤和南方典型水稻土壤的研究结果相一致。有研究发现,子囊菌门的生长与氮素的含量有关[31]。Wang等[32]研究发现,过高的氮素对子囊菌门的生长有害。长期大量施氮可能会促使根际真菌群落多样性降低,群落结构主要朝子囊菌,Mucoromycota和担子菌三个方向演替。本研究发现,适量施氮(N150和N225)条件下子囊菌门的相对丰度为83.95%和83.24%,显著高于其他处理,说明适量的施用氮肥可以增加子囊菌门的丰度,但当施氮量过低或过高时不利于子囊菌的生长。Paungfoo-Lonhienne等[33]在甘蔗根际和土壤中研究结果显示,与低氮处理相比,高氮肥条件下真菌群落子囊菌的相对丰度通常较高,而担子菌较低,增加氮肥会改变真菌群落的组成,并且通过促进病原真菌,可能对植物健康产生负面的影响。
本研究中子囊菌门的群落构成与Sun等[26]在不同施肥模式的旱地土壤中的结果相一致,子囊菌门的优势种群是粪壳菌纲(Sordariomycetes)。Sordariomycetes纲是马铃薯根际真菌的优势物种,表明连续施用不同氮量可能会导致根际真菌群落组成的差异。Sordariomycetes纲的相对丰度为47.36%~64.12%,该类群中的肉座菌目(Hypocreales)、Hypocreales和散囊菌目(Eurotiales)和散囊菌纲(Eurotiomycetes)等多数物种有研究被证实具有产生N2O的能力[34]。众所周知,N2O是一种潜在的温室气体,而且还能够破坏大气中的臭氧层[35]。因此增加施氮量将会促进Sordariomycetes真菌微生物的繁殖,进一步促进N2O的产生。N0处理土壤中锤舌菌纲(Leotiomycetes)数量最高且显著高于其它施氮处理,与N0相比N75~N375处理分别降低了47.79%、62.56%、29.72%、51.46%和61.81%。不同氮肥处理的锤舌菌纲类群中75.33%~86.08%的类群属于柔膜菌目(Helotiales),此类群真菌多数是根际真菌,能够为宿主植物提供养分,帮助其固定有机物等营养物质[36],本研究结果显示,该类真菌的数目随施氮量的增加而降低。Dean等[37]也曾报道过类似的结果,它们丰度的降低预示着高氮环境中真菌与作物的共生关系将会减弱。
在优势属水平细菌的分析结果中发现,长期连续施用氮肥过程中低氮量和高氮量显著增加了Fusarium(镰刀菌属)的丰度,N375处理和N0处理的镰刀菌属丰度相比N75处理多61.58%及14.91%。这个结果与孟品品等[5]、牛秀群等[14]的研究结论相符。孟品品等[5]研究表明随着连作年限的增加,马铃薯收获期根际土壤土传病害病原菌尖孢镰刀菌和茄病镰孢菌的数量明显增加。牛秀群等[14]研究认为在1~3 a连作中,随着连作年限的增加,马铃薯根茬中分离的镰刀菌数量呈上升趋势。据资料显示,马铃薯连作导致土壤微生物群落结构显著改变,病原菌成为优势种群,比如Rhizoctoniasolani和Fusariumsp.等土传病原真菌的数量显著增加,导致病害大面积发生,块茎产量降低[38-40]。健康的微生物区系是高产高效土壤的重要特征,同时具有抑制土传病害的作用[41]。因此,连续长期大量施氮可能会抑制土壤中有益真菌微生物群落的生长,对土壤健康造成负面影响。结果表明,增加施氮量将会改变真菌群落的组成,并且通过促进致病真菌群落的丰度,可能对植物健康产生负面影响。
4 结 论
本研究结果表明,长期大量施氮使马铃薯根际硝态氮大量积累,且氮肥过量施用降低了土壤pH值,进而改变了根际真菌群落结构,过量施氮使真菌群落丰富度及多样性降低,RDA及相关性分析结果表明硝态氮含量是影响真菌群落结构变化的主要理化因子。长期过量施氮增加了根际土壤真菌病原菌的相对丰度,可能会加剧植物病害以及危害土壤健康,同时过量施氮导致了马铃薯产量下降。因此,大量施氮不利于马铃薯产量的增加和根际土壤真菌生态系统的平衡。

