子痫前期危险因素分析及血清25-(OH)D、PLGF及NF-κB检测的诊断价值
李娟 石国素 杨瑞冰 刘慧丽 姚莉芸


摘 要
目的:探讨子痫前期(PE)发生的危险因素及血清25羟基维生素D(25-(OH)D)、胎盘生长因子(PLGF)、核转录因子κB(NF-κB)检测对子痫前期的诊断价值。方法:选取2018年1月至2018年9月本院290例妊娠孕妇为研究对象,其中51例子痫前期孕妇为PE组,63例妊娠高血压患者为妊娠高血压组,176例健康孕妇为正常妊娠组。收集各组孕妇临床资料,检测血25-(OH)D、PLGF及NF-κB水平;探讨子痫前期发生的危险因素,分析血25-(OH)D、PLGF及NF-κB检测对PE的诊断价值。结果:PE组患者年龄、孕期体重增长量、高血压病史、神经精神类疾病史及血清NF-κB水平均显著高于正常妊娠组和妊娠高血压组(P<0.05),PE组患者血清25-(OH)D、PLGF水平低于正常妊娠组和妊娠高血压组(P<0.05)。年龄、孕期体重增长量、高血压病史、血清NF-κB水平升高及血清25-(OH)D、PLGF低表达是诱发PE的独立危险因素(P<0.05)。血25-(OH)D、PLGF及NF-κB诊断PE的ROC曲线下面积分别为0.807、0.823、0.877,诊断灵敏度为74.5%、70.6%、76.5%,特异度为73.2%、77.0%、81.6%。结论:PE的发生与孕妇年龄、孕期体重增长量、高血压病史及血清25-(OH)D、PLGF及NF-κB水平有关,检测血清25-(OH)D、PLGF及NF-κB水平对PE临床诊断具有一定价值。
关键词
子痫前期;危险因素;25羟基维生素D;胎盘生长因子;核转录因子κB
中图分类号: R714.244;R446.1 文献标识码: A
DOI:10.19694/j.cnki.issn2095-2457.2020.05.054
子痫前期(PE)是妊娠期孕妇的特有疾病,发生率约为2.3%-7.6%,多表现为高血压、蛋白尿、水肿等,不仅会影响胎儿生长发育,也会对孕妇造成严重影响[1]。PE的发病机制复杂,早期预测和及早诊治对改善母婴结局具有重要意义。目前,临床上尚无准确有效的指标用于PE的早期诊断,若患者出现明显症状后才开始治疗,往往预后较差[2]。25羟基维生素D(25-(OH)D)是维生素D在人体内存在的活性形式,具有调节机体免疫和促进细胞增殖分化的作用。有研究[3]表明,25-(OH)D缺乏与原发性高血压的发生有关,但其与PE发生的相关性尚不清楚。胎盘生长因子(PLGF)属于血管内皮生长因子(VEGF)家族成员,具有促进胎盘血管及滋养细胞发育的作用[4]。核转录因子κB(NF-κB)是一种前炎症介质转录因子,广泛存在于机体各细胞中,能够调控机体炎症反应、启动免疫应答,参与PE的发生和发展过程[5]。本研究选取2018年1月至2018年9月本院51例PE孕妇、63例妊娠高血压孕妇及176例健康孕妇为研究对象,分析影响PE发生的危险因素,探索血清25-(OH)D、PLGF及NF-κB检测在PE诊断中的应用价值。
1 资料与方法
1.1 一般资料
选取2018年1月至2018年9月本院妇产科建档产检的51例子痫前期孕妇为PE组,年龄22-37岁,平均(29.91±4.16)岁;产次:初产妇35例,经产妇16例;高血压病史18例,神经精神类疾病史18例。选取同期63例妊娠高血压患者为妊娠高血压组,年龄21-35岁,平均(27.93±3.41)岁;产次:初产妇35例,经产妇18例;高血压病史13例,神经精神类疾病史10例。由同期建档产检孕妇中随机选取176例健康妊娠孕妇为正常妊娠组,年龄22-35岁,平均(27.22±3.58)岁;产次:初产妇136例,经产妇40例;高血压病史11例,神经精神类疾病史14例。
纳入标准:①年龄>18岁;②单胎妊娠,妊娠期28-34周;③符合子痫前期及妊娠高血压相关诊断标准[6-7];④无重要脏器受累,无胎儿异常;⑤病理资料完整,自愿参加研究;⑥研究资料经医学委员会审核批准。
排除标准:①合并其他妊娠并发症者;②心、肺、肾、肝等重要脏器功能不全者;③患有感染性疾病、心脑血管疾病、恶性肿瘤患者;④不配合医护人员完成研究者;⑤胎儿畸形或染色体异常者。
1.2 研究方法
①收集孕妇年龄、孕前体重指数(BMI)、产次、孕期体重增长量、居住地、高血压病史、神经精神类疾病史等一般资料;②采集孕妇28-34周体检时空腹外周血5mL,低速低温(4℃,3000r/min)离心10min,取血清备用;③应用全自动免疫分析仪(C702,罗氏)检测血清25-(OH)D水平,检测试剂购于北京普迈德公司;采用酶联免疫试验(ELISA)法检测血清PLGF、NF-κB水平,试剂盒购于武汉菲恩生物公司和上海酶联生物公司。
1.3 统计学方法
采用SPSS19.0软件分析,计量资料用±s表示,组间采用t检验或单因素方差分析;计数资料用%表示,采用χ2檢验;采用Logistic回归进行多因素分析,探索影响子痫前期发生的独立危险因素;绘制受试者工作特征曲线(receiver operating characteristic curve,ROC)分析血清25-(OH)D、PLGF及NF-κB检测对子痫前期的诊断价值;P<0.05为差异有显著性。
2 结果
2.1 各组孕妇临床特征比较
PE组患者年龄、孕期体重增长量、高血压病史、神经精神类疾病史及血清NF-κB水平均显著高于正常妊娠组和妊娠高血压组(P<0.05),PE组患者血清25-(OH)D、PLGF水平低于正常妊娠组和妊娠高血压组(P<0.05);而三组孕妇孕前BMI、产次和居住地比较,差异无显著性(P>0.05)。见表1。
2.2 子痫前期危险因素Logistic回归分析
以患者是否发生PE为因变量,以组间存在显著差异的年龄、孕期体重增长量、高血压病史、神经精神类疾病史、血清25-(OH)D、PLGF及NF-κB水平为自变量进行Logistic回归分析。结果显示,年龄、孕期体重增长量、高血压病史、血清NF-κB水平升高是PE发病的危险因素(P<0.05),血清25-(OH)D、PLGF高表达是避免PE的保护因素(P<0.05)。见表2。
2.3 血清25-(OH)D、PLGF及NF-κB检测对PE的诊断价值
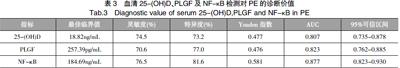
以PE组为阳性组,正常妊娠组和妊娠高血压组为阴性组,绘制ROC曲线。血清25-(OH)D检测的AUC为0.807(95%CI:0.735-0.878),以25-(OH)D>18.82 ng/mL为临界值,其诊断灵敏度为74.5%,特异度为73.2%;PLGF检测的AUC为0.823(95%CI:0.762-0.885),以PLGF >257.39 pg/mL为临界值,其诊断灵敏度为70.6%,特异度为77.0%;NF-κB检测的AUC为0.877(95%CI:0.823-0.930),以NF-κB >184.69ng/mL为临界值,其诊断灵敏度为76.5%,特异度为81.6%。见表3。
3 讨论
PE是妊娠期常见合并症,随着孕期增加,PE患者病情呈加重趋势,当胎盘娩出后,病情可迅速缓解和控制[8]。PE可导致胎儿宫内窘迫、发育迟缓、胎盘早剥等,而且会造成孕妇产后出血、肝肾衰竭等并发症,极大增加了不良妊娠结局和威胁母婴安全[9]。目前,对于PE的发病机制尚不清楚,其发病原因受多方面因素影响,认识和预防PE发病相关因素,寻找准确有效的早期诊断指标对控制疾病发展,改善母婴结局具有重要意义[10]。本研究观察290例孕妇临床特征发现,PE组孕妇在年龄、孕期体重增长量、高血压病史、神经精神类疾病史方面与正常妊娠组和妊娠高血压组存在明显差异;Logistic回归分析显示,年龄、孕期体重增长量、高血压病史是导致PE发病的独立危险因素。分析其原因为:
①年龄因素,25-28岁是女性肾盂和内分泌功能最佳时期,之后随着年龄增加,血管收缩和舒张功能衰退,容易发生血管痉挛,故而高龄孕妇容易诱发PE;②孕期体重增长过多可能造成内分泌紊乱,增加心肌负担,引起血小板凝集、血管收缩等,导致血压逐步升高;③高血压病史患者血管内皮存在一定损伤,血管收缩和舒张存在异常,妊娠期机体内分泌功能改变,对各类刺激的敏感性增加,极易产生过度反应诱发PH。
PE的发病机制研究一直是产科领域的热点,目前关于PE病因学说包括营养缺乏、血管内皮损伤学说、炎症免疫过度学说等[11-12]。孕妇在孕期应摄入充足营养以满足自身和胎儿生长发育需求,维生素D是在正常妊娠过程中起重要作用[13]。维生素D与妊娠糖尿病、肥胖等妊娠期疾病密切相关,维生素D缺乏会影响胎儿骨骼发育,也会增加先兆性流产、产褥期感染等风险。25-(OH)D是体内维生素D的主要储存和利用形式,是评价体内维生素D是否缺乏的最佳指标。PE的发生与胎盘浅着床存在一定关系,孕妇血中PLGF主要由胎盘滋养细胞所表达,通过调节胎盘内皮功能和促进血管内皮增殖,从而为胎盘着床和正常发育提供充足血供[14]。炎症反应在PE病理过程中的作用已被广泛关注,NF-κB多种炎症因子转录的激活因子,在炎症因子表达过程中发挥枢纽作用,通过启动和调控免疫应答、炎症反应,参与多种疾病的病理过程[15]。本研究发现,PE组患者血清25-(OH)D、PLGF显著低于正常妊娠组和妊娠高血压组,血清NF-κB水平则高于正常妊娠组和妊娠高血压组;Logistic回归分析显示,除年龄、孕期体重增长量、高血压病史外,血清25-(OH)D、PLGF及NF-κB的表达水平同样是影响孕妇发生PE的独立危险因素。25-(OH)D缺乏会激活血管紧张素系统,促进甲状腺激素分泌,导致血管柔韧性改变和血管肥厚,诱发动脉粥样硬化,进而造成血栓性病变和高血压[16]。PLGF具有強烈促血管生成作用,其表达量降低会引起胎盘血管再生障碍,影响胎盘正常血供,继发PE[17]。NF-κB能够通过促进炎症介质的表达和释放,造成血管狭窄和血管内皮损伤,引起PE的各种病理改变[18]。
PE患者根据发病时间不同分为早发型(孕34周前)和晚发型(孕34周后),其中早发型PE与胎盘受累存在密切联系,是导致不良母婴结局的重要原因[19]。本研究选择早发型PE患者为研究对象,以期更为有效地提高孕妇及胎儿安全,研究发现,PE组孕妇在孕28-34周时血清25-(OH)D、PLGF及NF-κB水平已明显提高,故而三项血液指标的改变时间可能早于PE的发生,血清25-(OH)D、PLGF及NF-κB可作为早期诊断PE的参考指标。ROC曲线分析显示,血清25-(OH)D、PLGF及NF-κB检测对PE早期诊断的ROC曲线下面积分别为0.807、0823、0.877,三者最佳临界值分别为25-(OH)D>18.82ng/mL、PLGF>257.39pg/mL、NF-κB>184.69ng/mL,提示血清25-(OH)D、PLGF及NF-κB检测对PE的早期诊断具有较高临床应用价值,当检测指标偏离临界值时孕妇可能会继发PE,应给予积极预防和及早干预治疗。
综上所述,PE的发生与孕妇年龄、孕期体重增长量、高血压病史及血清25-(OH)D、PLGF、NF-κB表达情况有关,检测血清25-(OH)D、PLGF及NF-κB水平对早期诊断PE的发生具有一定参考价值。
参考文献
[1]庄彩霞,刘俊涛,高劲松.中国人群子痫前期发病率和临床危险因素分析[J].生殖医学杂志,2019,28(4):336-341.
[2]Zhao Y,Lin L,Lai A.Expression and significance of aquaporin-2 and serum hormones in placenta of patients with preeclampsia[J].J Obstet Gynaecol,2018,38(1): 42-48.
[3]Legarth C,Grimm D,Wehland M,et al.The Impact of Vitamin D in the Treatment of Essential Hypertension [J]. Int J Mol Sci,2018,19(2) pii: E455.
[4]Bian X,Biswas A,Huang X,et al. Short-Term Prediction of Adverse Outcomes Using the sFlt-1(Soluble fms-Like Tyrosine Kinase 1)/PlGF (Placental Growth Factor) Ratio in Asian Women With Suspected Preeclampsia[J].Hypertension,2019, 74(1):164-172.
[5]Zheng L,Shi L,Zhou Z,et al.Placental expression of AChE,α7nAChR and NF-κB in patients with preeclampsia [J].Ginekol Pol,2018,89(5):249-255.
[6]沈鏗,马丁.妇产科学[M].第3版.人民卫生出版社,2015,130-139,193-196.
[7]中华医学会妇产科学分会妊娠期高血压疾病学组.妊娠期高血压疾病诊治指南(2015)[J].中华围产医学杂志,2016,19(3):161-169.
[8]You SH,Cheng PJ,Chung TT,et al.Population-based trends and risk factors of early-and late-onset preeclampsia in Taiwan 2001-2014[J].BMC Pregnancy Childbirth,2018,18(1):199.
[9]Cerdeira AS,O'Sullivan J,Ohuma EO,et al.Randomized Interventional Study on Prediction of Preeclampsia/Eclampsia in Women With Suspected Preeclampsia: INSPIRE[J].Hypertension,2019,74(4):983-990.
[10]刘晓宁,潘晓华,申彩霞.孕早中期血清PLGF、PAPP-A 检测联合B 超对子痫前期[J].中国优生与遗传杂志,2019,27(5):566-568,555.
[11]孙秀荣,邓宇傲,陈学琳,等.子宫动脉超声定量分析联合血管内皮功能相关因子变化与子痫前期发病的相关性分析[J]. 湖南师范大学学报(医学版), 2019, 16(2): 19-22.
[12] 王琼, 王永红. 子痫前期早期血清学预测标记物研究进展[J]. 国际妇产科学杂志, 2019, 46(4): 412-416.
[13] Eggemoen R,Jenum AK,Mdala I,et al. Vitamin D levels during pregnancy and associations with birth weight and body composition of the newborn:a longitudinal multiethnic population-based study[J].Br J Nutr,2017,117(7):985-993.
[14]Sabrià E,Lequerica-Fernández P,Ganuza PL,et al.Use of the sFlt-1/PlGF ratio to rule out preeclampsia requiring delivery in women with suspected disease.Is the evidence reproducible?[J].Clin Chem Lab Med,2018,56(2):303-311.
[15]Black KD,Horowitz JA.Inflammatory Markers and Preeclampsia:A Systematic Review[J].Nurs Res,2018,67(3):242-251.
[16]Purswani JM,Gala P,Dwarkanath P,et al.The role of vitamin D in pre-eclampsia: a systematic review[J].BMC Pregnancy Childbirth,2017,17(1):231.
[17]Fabjan-Vodusek V,Kumer K,Osredkar J,et al.Correlation between uterine artery Doppler and the sFlt-1/PlGF ratio in different phenotypes of placental dysfunction[J]. Hypertens Pregnancy,2019,38(1):32-40.
[18]Kim S,Lee KS,Choi S,et al.NF-κB-responsive miRNA-31-5p elicits endothelial dysfunction associated with preeclampsia via down-regulation of endothelial nitric-oxide synthase[J].J Biol Chem,2018,293(49):18989-19000.
[19]Masturzo B,Di Martino D,Prefumo F,et al.Higher rate of early-onset preeclampsia in pregnancies following oocyte donation according to increasing maternal age[J].Arch Gynecol Obstet,2019,300(4):861-867.

